Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ІІІ стадия. Значительных расстройств мочеиспускания.Содержание книги
Поиск на нашем сайте
По данным урофлоуметрии: Qmax <10 мл/сек. ІІІа. Остаточной мочи нет, незначительная выраженность симптомов (I-PSS). ІІІв. Наличное незначительное количество остаточной мочи (до 100 мл) и/или умеренная или незначительная выраженность симптомов (I-PSS). ІІІс. Наличное значительное количество остаточной мочи (>100 мл) и/или умеренная или значительная выраженность симптомов (I-PSS), наличие осложнений ДГПЖ. В Іа стадии показано динамическое наблюдение. В Ів стадии показано медикаментозное лечение. Во ІІа стадии показано медикаментозное лечение. В ІІв стадии показано медикаментозное или малоинвазивное лечение. В ІІІа стадии показано медикаментозное либо малоинвазивное лечение. В ІІІв и ІІІс стадиях оптимальным является хирургическое лечение. Методом выбора при средних размерах простаты (V до 80 см3) является трансуретральная резекция предстательной железы и ее модификаци. При значительных размерах (V >80 см3) методом выбора является открытая аденомэктомия. Хирургическое лечение показано и при неэффективности медикаментозного и малоинвазивного лечения на различных стадиях заболевания. В отдельных случаях в ІІІв и ІІІс стадиях показаны малоинвазивные методы лечения. М е д и к а м е н т о з н о е л е ч е н и е.Проблемы патогенеза и лечение доброкачественной гиперплазии предстательной железы (ДГПЖ) до сих пор, остаются недостаточно изученными. В последние годы появились сведения о возможной медикаментозной коррекции нарушений мочеиспускания у пациентов с ДГПЖ. Известны несколько природных и химических препаратов, которые улучшают мочеиспускания Пермиксон (Pierre Fabre Medicament) – экстракт из плодов вееролистной пальмы Serenoa repens; Проскар (МSD) – ингибитор 5-альфаредуктазы; Кардура (Pfizer) – доксазозин, блокатор альфа-1-адренорецепторов и другие препараты. Выраженность клинических симптомов ДГПЖ зависит не только от механического компонента инфравезикальной обструкции, вызванную сужением простатического отдела уретры аденоматозными узлами, но не менее важную роль в возникновении этих симптомов играет, также и динамический компонент обструкции. Известно, что тонус нижних мочевыводящих путей регулируется a-адренергическим звеном периферической нервной системы. Максимальное количество a-адренергических рецепторов размещено в шейке мочевого пузыря, капсуле простаты и мышечных элементах простаты.
При этом строма гиперплазированной ткани (45% всей массы опухоли) состоит на 60% из мышечных структур. Таким образом, рост процента мышечных структур является одним из главных моментов в патогенезе обструктивной симптоматики. Благодаря современным возможностям фармакологии и молекулярной биологии установлено не только то, что в строме ДГПЖ локализованы преимущественно a1-адренорецепторы (соотношение (a1:a2 – 4:1), но и то, что a1-рецепторы делятся на a1А, a1В, a1D. В гиперплазированной ткани предстательной железы доминируют преимущественно a1A-рецепторы (a1A>a1D >>(a1B). Стимуляция этих рецепторов приводит к сокращению гладких мышц шейки мочевого пузыря, предстательной железы и тем самым внутриуретральному сопротивлению струи мочи. Блокирование упомянутых рецепторов медикаментозными средствами приводит к расслаблению гладких мышц, уменьшению инфравезикальной обструкции и соответственно к улучшению мочеиспускания. Начиная с конца 70-х лет впервые начали использовать a-адреноблокаторы для лечения больных с ДГПЖ. Согласно классификации a-адреноблокаторы делятся на: a1/a2 – неселективные (феноксибензамин), (1 – селективные краткого действия (празозин, альфузозин), a1 – селективные пролонгированного действия (теразозин, доксазозин) и последнее поколение простатоселективные a1A (тамсулозин). Препарат "Omnic" (тамсолузин) испытан уже во многих странах мира. Во многочисленных публикациях о результатах его использования сообщается о высокой эффективности препарата для уменьшения выраженности симптомов обструкции и улучшения объективных уродинамических показателей, в частности, максимальной (Qmax) и средней (Qave) скорости потока мочи, уменьшению остаточной мочи. Обладая рядом преимуществ при его приеме не отмечается снижения артериального давления, что характерно для других групп адреноблокаторов, и отрицательного влияния на половую функцию мужчин. Продолжительный период выведения препарата из организма позволяет принимать его однократно на протяжении суток, что, без сомнения, удобно для пациента. Рекомендуются для применения при ДГПЖ следующие группы препаратов: ингибиторы 5- a-редуктазы и a - адреноблокаторы. Проводится изучение действия фитотерапевтических препаратов при ДГПЖ.
М а л о и н в а з и в н ы е м е т о д ы л е ч е н и я. Гипертермия и термотерапия. Лечебное применение тепла имеет давнюю и богатую историю. Свидетельства о лечебном действии горячих ванн и других термических процедур при заболеваниях предстательной железы можно найти в истории Древнего Египта, Римской Империи, Киевской Руси. Хорошо известно благоприятное воздействие тепловых процедур при лечении воспалительных заболеваний предстательной железы. В лечении хронического простатита широкое применение находят теплые микроклизмы с лечебными веществами или лекарственными травами, индуктотермия, теплые ванны и грязевые тампоны. Повышение температуры тела человека одной её области области или отдельного органа выше 41°С, вызванное с терапевтической целью, определяется термином "гипертермия". Более четкая позиция у авторов P.Van Erps и L. Denis, которые выделяют 2 принципа, как различные методы лечения – гипертермия и термотерапия. О гипертермии следует говорить тогда, когда температура в тканях поддерживается в интервале 42–45 °С, что позволяет эффективно действовать на опухолевые клетки, сохраняя интактными здоровые. Термотерапия предусматривает повышение температуры в тканях выше 45°С. По способу подведения тепловой энергии к предстательной железе выделяют трансректальную и трансуретральную гипертермию. Еще в 1948 году A.Yerushalmi с соавторами доложили о применении локальной гипертермии у пациентов с ДГПЖ. Объединенные данные об эффективности современной микроволновой аппаратуры в лечении ДГПЖ свидетельствует, что приблизительно в 70% наблюдений объективно уменьшается обструкция, а субъективное улучшение состояния улучшается у 90% больных. Вместе с этим различные авторы дают разные сведения о результативности лечения, зависящие от метода подачи энергии, времени и интенсивности воздействия, рабочей температуры, продолжительности и числа сеансов лечения. Даже при использовании однотипной аппаратуры разные авторы часто используют разнообразные протоколы лечения, которые затрудняют оценку результатов. В режиме гипертермии при нагревании ткани простаты, близкой к физиологической температуре, происходит улучшение микроциркуляции, происходит повышение уровня тканевого обмена веществ, активация клеточного звена иммунитета и уменьшения конгестии. С другой стороны, использование гипертермии с температурой от 42°С до 45°С, вызывает незначительный склеротический и нейроанальгезирующий эффект. Большинство авторов отмечают, что точный механизм тепловой энергии на ткань простаты еще неизвестен и находится на стадии изучения. Вместе с этим, есть данные, которые указывают на то, что гипертермия приводит к релаксации гладкомышечных элементов предстательной железы и эффект сравнивают с результатом действия адреноблокаторов. Трансуретральная радиочастотная термодеструкция. Метод базируется на использовании энергии электромагнитных колебаний длинноволнового диапазона, который дает лечебный эффект при ДГПЖ с выраженными склеротическими изменениями в предстательной железе. Антена (в уретральном катетере) преобразовывает енергию электромагнитного поля в тепловую энергию, которая в свою очередь вызывает деструкцию тканей предстательной железы вследствие локального повышения температуры (от 70 до 80°С). Образовывается зона коагуляционного некроза. Через 6-8 недель некротические массы отторгаются и ликвидируется причина инфравезикальной обструкции. После процедуры показанным является установка постоянного катетера на протяжении 10-14 дней.
Трансректальная фокусированная ультразвуковая термоабляция. Метод базируется на использовании принципа сфокусированного ультразвукового воздействия с преобразованияем кинетической энергии механических колебаний в тепловую энергию, что приводит к локальному повышению температуры до 120°С. Образуется зона коагуляционного некроза. Через 6-8 недель некротические массы отторгаются и ликвидируется причина инфравезикальной обструкции. После процедуры показанным является установка постоянного катетера на протяжении 5-7 дней. Трансуретральная игольчатая абляция – TUNA. Технически метод трансуретральной игольчатой абляции базируется на преобразовании энергии радиочастотного генератора в тепловую энергию. В ткань предстательной железы вводятся два игольчатых электрода под эндоскопическим контролем. Во время воздействия (до 5 мин.) образуется зона коагуляционного некроза диаметром около 1,0 см. (Т =80-110°С). Зоны некроза со временем превпащаются в фиброзные рубцы. Соответственно уменьшаются размеры предстательной железы. Балонная дилятация. Принцип метода базируется на механическом расширении простатического отдела уретры. Происходит механическое растяжение уретры, передняя и задняя комисуротомия, компрессия долей предстательной железы. С этой целью используют балонный катетер. Балон расширяет уретру до 60-90 Сh под давлением 3-4 атмосферы. Отдаленные результаты являются неудовлетворительными, поэтому данный метод широко не используются, но в отдельных случаях возможно его использование. Уретральные стенты. Установка уретральных стентов относится к паллиативным методам лечения ДГПЖ. Уретральные стенты делят на постоянные и временные. К временным стентам относятся: урологические спирали, интрауретральные катетеры и стенты, которые самостоятельно рассасываются. Постоянные стенты необходимы для прижизненного дренрования мочевого пузыря. После установки слизистая уретры прорастает стент с эпителизацией на протяжении 4-6 месяцев. Устанавливают стенты под ультразвуковым, эндоскопическим, рентгенологическим контролем. Х и р у р г и ч е с к и е м е т о д ы л е ч е н и я. Трансуретральная резекция предстательной железы (ТУРП) и её модификации занимают ведущее место в лечении ДГПЖ. Основными преимуществами ТУРП перед открытой аденомэктомией являются: уменшение срока послеоперационного периода, расширения показаний к оперативному лечению, отсутствие послеоперационной раны, уменьшения количества и тяжести осложнений, контролированный гемостаз во время операции (рис.28,78-80).
Рис.78 Внешний вид современного резектоскопа. При трансуретральной электровапоризации предстательной железы (ТУВП) используется новый роликовый электрод. При контакте электрода с тканью предстательной железы происходит выпаривание ткани с коагуляцией. Сила электрического тока на 40-50% выше чем при ТУРП. Зона коагуляции значительно глубже чем при ТУРП. Эти преимущества значительно уменьшают вероятность кровотечения. ТУВП показана при ДГПЖ средних размеров.
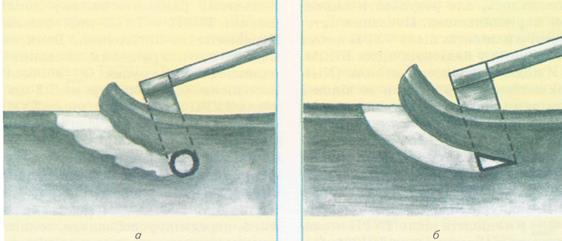
Рис.79 Клинические особенности применения резекционной петли: а-обычная резекционная петля;б-утолщенная(клиноподобная)резекционная петля со специальным покрытием При трансуретральной вапорезекции предстательной железы (ТУВРП) используется другой электрод, который позволяет проводить и резекцию и вапоризацию. При контакте электрода с тканью предстательной железы, в зависимости от режима работы диатермии происходит резекция и испарение ткани с коагуляцией. Сила электрического тока не выше, чем при ТУРП. Зона коагуляции глубже, нежели при ТУРП. Эти преимущества уменьшают вероятность кровотечения, но остаются и преимущества резекции. ТУВРП показана при ДГПЖ средних размеров.
Рис.80.Разные типысовременных петель и вапортродов. Трансуретральная инцизия предстательной железы (ТУИП) метод лечения ДГПЖ, при котором проводится только инцизия предстательной железы и шейки мочевого пузыря. Показаниями к использованию данного метода является: небольшой размер предстательной железы (30-35 см3), молодой возраст больного. Много исследователей сравнивали результаты лечения пациентов, которым выполнялась резекция увеличенной простаты с пациентами, которым была выполнена инцизия шейки мочевого пузыря (ИШМП) или трансуретральная инцизия простаты (ТУИП), то есть группы, где можно было ожидать различные результаты. Есть несколько исследований, в которых сравнивают ИШМП и ТУРП и включают в себя группы пациентов с приблизительно одинаковым размером предстательной железы. В 1987 году Оrandi описал исследование 132 пациентов, которым было показано ИШМП, но им выполнялась как ИШМП, так и ТУРП. Пациенты обеих групп имели одинаковые выходные показатели объемного потока мочи. Выяснилось, что пиковой поток мочи улучшился с 8,2 до 13,7мл/с у пациентов после ИШМП и с 7,6 до 12,7 мл/с у больных после ТУРП. Никаких статистических обработок не проводилось, но результаты оказались сравнимыми. Удивительно, что показатель потока мочи у пациентов после ТУРП не был выше, нежели у пациентов после ИШМП. В дальнейших исследованиях (Nielsen) пациенты были объединены по возрасту и размеру простаты. Улучшение симптомов было одинаковым у больных обеих групп после 12 месячного наблюдения: улучшение симптомов наблюдалось у 78 % пациентов после ТУРП и у 82% пациентов после ТУИП. Nielsen отметил статистически более значимое улучшение показателя Qmax у пациентов после ТУРП, сравнительно с пациентами после ИШМП. Но 87% больных после ИШМП имели размеры предстательной железы больше, нежели 30 граммов (по данным пальцевого ректального исследования), то есть они установили группу пациентов, которым бы не рекомендовали ИШМП. Несмотря на это, показатель Qmax у пациентов этой группы повышался (с 5 до 10 мл/сек) и все пациенты считали операцию удачной. Nielsen также отмечает значительно меньшее время оперативного вмешательства, меньшее кровотечение и меньшую необходимость трансфузий крови при ИШМП. Hellstrom сравнивал унилатеральную ИШМП и ТУРП в небольшой группе пациентов, но очень тщательно. Размеры предстательной железы были меньше, нежели 30 граммов и оценивались с помощью трансабдоминальной ультрасонографии. Результаты изменений симптомов были одинаковыми у пациентов в обеих групп. Однако, хотя Qmax увеличилась у больных после ИШМП (с 8,6 до 12,9 мл/сек), что не дало возможности определить статистическую значимость. Это могло произойти за счет малой выборки, только 11 больных после ИШМП и 13 больных после ТУРП. Также было отмечено, что время оперативного вмешательство было значительно меньшим при ИШМП, как и койко-день.
Larsen сравнивая результаты ТУИП и ТУРП в рандомизированном исследовании пациентов с размерами простаты меньше 20 граммов, оцененной цистоскопически. Используя шкалу симптомов Madsen-Iversen, они нашли статистически значимые и подобные улучшения симптоматики в двух группах, вместе с одинаковыми изменениями Qmax.Наблюдения проводились от 3 до 12 месяцев после операции. В дальнейшем рандомизированном исследовании ТУРП с ТУИП сравнивали Bruskewitz и Christensen. Они нашли, что улучшения симптомов были одинаковые в обеих группах. Qmax улучшился после обеих процедур: увеличился на 8,2 мл/сек после ТУРП и на 5,6 мл/сек после ТУИП. Осложнениями ТУРП являются: интаоперационные кровотечения, поздние и ранние кровотечения послеоперационного периода, перфорации капсулы предстательной железы, перфораци мочевого пузыря, поражения устья мочеточников; травма уретры, предстательной железы, внешнего сфинктера уретры, семенного бугорка; ТУР-синдром (водная интоксикация организма), острые воспалительные заболевания мочевых путей и половых органов. Поздними осложнениями ТУРП являются: стриктуры уретры и склероз шейки мочевого пузыря, недержание мочи, рецидив ДГПЖ, эректильная дисфункция, ретроградная эякуляция. М е т о д и к а Т У Р П. Перед ТУРП проводится стандартная уретроцистоскопия. Пациентам под спинномозговой анастезией вводится резектоскоп в мочевой пузырь и процедура продолжается при постоянном введении промывной жидкости. Мы проводим резекцию сначала средней доли и от шейки к семенному бугорку. Потом мы резецируем боковые доли простаты последовательными движениями от шейки к семенному бугорку, идя сначала против часовой стрелки от 11 до 7 часов, а потом по часовой стрелке от 1 до 5 часов, пока не удалим необходимого объема ткани. Выравнивающими движениями завершаем резекцию с целью достичь желаемого размера и формы полости. Резекцию проводим до перекрестных волокон хирургической капсулы. В конце операции вводим постоянный уретральный катетер 20-22 Сh, баллон которого раздуваем в зависимости от объема и формы послеоперационной полости. При необходимости проводим тракцию и ирригацию мочевого пузыря физиологическим раствором (рис.28). Вместе с трансуретральной резекцией предстательной железы (ТУРП) для хирургического лечения ДГПЖ используются различные методы открытой простатэктомии (ОП): промежностная, надлонная, позадилонная. ОП проводим пациентам с предстательной железой больших размеров и пациентам, которым невозможно выполнить ТУРП. Эту операцию обычно выполняют чрезпузырным путем: высокое рассечение мочевого пузыря, вылущивание аденомы из предстательной железы через разрез или разрыв слизистой оболочки в области шейки мочевого пузыря или простатической части мочеиспускательного канала. Преимуществами данного оперативного вмешательства считаем: простоту выполнения оперативного вмешательства; минимальное техническое обеспечение для выполнения оперативного вмешательства; осмотр полости мочевого пузыря; возможность проведения вмешательства без полной релаксации. Единственным недостатком этой методики является относительная тяжесть остановки кровотечения. Операция может быть проведена в два этапа, что целесообразно только при резкой гипотонии или атонии мочевого пузыря и вызванной этим почечной недостаточности. Первый этап – наложение надлобкового мочепузырного свища (эпицистостомия), ликвидируя застой мочи в мочевой системе, содействует улучшению почечной деятельности. Второй этап (аденомэктомия) выполняют через 1-2 мес. После первой операции, в зависимости от общего состояния больного и функции почек при аденомэктомии, как одноэтапной, так и двухэтапной, у мочевом пузырь временно оставляют надлобковую дренажную трубку или ушивают его наглухо, дренируя катетером через мочеиспускательный канал. Осложнениями открытой простатэктомии являются: интраоперационные кровотечения, поздние и ранние кровотечения послеоперациионного периода (5-12%), острые гнойно-воспалительные осложнения (6-11%), острая сердечно-сосудистая недостаточность (4-5%), тромбоэмболия легочной артерии (0,3-3,2%), инсульт (0,1-0,3%), желудочно-кишечные кровотечения (0,3-0,4%).Поздними осложнениями открытой простатэктомии являются: стриктуры мочеточника и склероз шейки мочевого пузыря, недержание мочи (1,5-2%) предпузырь, рецидив ДГПЖ (1-2%), эректильная дисфункция, ретроградная эякуляция. Для профилактики острых воспалительных осложнений в послеоперациионном периоде со стороны половых органов (эпидидимит, эпидидимоорхит) перед аденомэктомией выполняют вазорезекцию. Методы лазерной хирургии базируется на достижении локального термического эффекта. В последние годы используются с целью лечения ДГПЖ следующие типы лазеров: гольмиевый (2100 nm), Nd:Yag (1064 nm), диодные полупроводниковые (880 nm). Основными видами техники лазерной хирургии при ДГПЖ является коагуляция и вапоризация. Лазерная коагуляция делится на интерстициальную, бесконтактную и контактную. Лазерная вапоризация делится на бесконтактную и контактную. При дистанционной эндоскопической лазерной коагуляции используют фиброоптические волокна со специальными насадками, которые определяют угол лазерного луча. Этот метод часто называют визуальной лазерной абляцией предстательной железы. Трансуретральная контактная лазерная вапоризация проводится при контакте специальних насадок фиброоптического волокна с тканью предстательной железы(рисм.81,82)
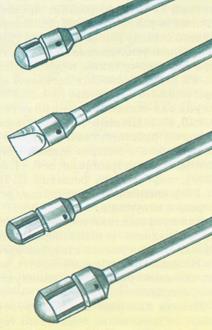
Рис.81.Внешний вид специальных наконечников для контактной лазерной вапоризации(STL) В области контакта создается высокая температура и происходит испарение. При интерстициальной лазерной коагуляции световод вводится непосредственно в ткань предстательной железы под эндоскопическим контролем. Вследствие термического воздействия образуется зона коагуляционного некроза (до 3 см в диаметре). В зависимости от размеров ДГПЖ необходимо от 3 до 10 изменений положения световода.
Рис.82.Вапоризация ткани простаты при непосредственном контакте с лазерным зондом.
Рак предстательной железы
Рак предстательной железысоставляет 3-6% всех онкологических заболеваний у мужчин.Он встречается, как правило, после 50 лет. В последние годы в мире, по данным эпидемиологических исследований, наблюдается значительное увеличение заболеваемости раком предстательной железы. В связи с особенностями клинического течения и недостаточно развитой ранней диагностикой большинство больных раком предстательной железы обращаются к врачам в поздних стадиях заболевания. Причины рака предстательной железы до конца не изучены. В развитии рака предстательной железы важную роль играют нарушения баланса половых гормонов: нарушения соотношения между андрогенами, гестагенами и эстрогенами. Развитие рака предстательной железы базируется на дибалансе половых гормонов во время старения организма мужчины, изменениях метаболизма гормонов на клеточном уровне, влиянии экзогенных канцерогенных факторов. Рак предстательной железы исходит из ткани предстательной железы, чаще из периферических ее участков. При прорастании рака в шейку мочевого пузыря, семенные пузырьки и мочеточники возникает нарушения оттока мочи из почек, развивается уретерогидролнефроз, хроническая почечная недостаточность. Опухоль может прорастати в окружающие ткани. Метастазирует рак предстательной железы по лимфатическим сосудам в тазовые лимфатические узлы. Он может метастазировать гематогенно в таз, позвоночник, ребра, шейку бедра и другие кости. Редко наблюдаются метастазы в печень. Наиболее частой гистологической формой рака предстательной железы является аденокарцинома.Значительно реже наблюдаются плоско-клеточная и склерозная солидная формы рака. Согласно Международной классификации по системе TNM, рак предстательной железы классифицируют следующим образом: Т – первичная опухоль Тх –первичная опухоль не может быть диагностирована; Т0 – признаков первичной опухоли нет; Т1 – опухоль выявлена случайно по данным гистологического исследования после ТУРП или аденомэктомии; Т1а – опухоль определяется случайно по данным гистологического исследования, не больше чем 5 % исследованного материала; Т1в – опухоль определяется случайно по данным гистологического исследования, больше чем у 5 % исследуемого материала; Т1с – опухоль определяется случайно по данным биопсии, выполненной при повышении концентрации PSA в сыворотке крови; Т2 –опухоль определяется клинически или макроскопически ограничена железой; Т2а – опухоль занимает одну дольку или меньше чем долька; Т2в – опухоль занимает обе дольки; Т3 – подвижная опухоль, которая распространяется за пределы капсулы; Т3а – односторонне или двухстороннее распространени опухоли за пределы капсулы; Т3в – распространение опухоли за пределы капсулы на семенные пузырьки; Т4 - неподвижная опухоль или опухоль, которая распростаняется на соседние структуры, не указанные в Т3; N –лимфатические узлы Nх – недостаточно данных для оценки регионарных лимфатических узлов; N0 – при обследовании нет изменений регионарных лимфатических узлов; N1 – единичные или множественные метастазы; М - отдаленные метастазы; Мх – определить отдаленные метастазы невозможно; М0 – отдаленные метастазы отсутствуют; М1 – определяются отдаленные метастазы.
В мире широко используется классификация Flocks i Jewett (1975), которая делит рак предстательной железы на 4 стадии: А – небольшой изолированный узел в предстательной железе; В – узел, который можно пальпаторно выявить в пределах одной доли предстательной железы; С - раковая опухоль выходить за пределы капсулы предстательной железы; D – наличие отдаленных метастазов. Размеры опухоли не имеют значения. С и м п т о м а т и к а. В начальном периоде заболевание протекает безсимптомно или вызывает расстройства мочеиспускания, которые не отличаются от таких, как при доброкачественной гиперплазии предстательной железы. Иногда заболевания проявляется гематурией, возникающей вследствие венозного стаза или прорастания опухолью стенки мочевого пузыря. По мере роста раковой опухоли она может прорасти капсулу предстательной железы, перейти на окружающие ткани, семенные пузырьки, сдавить нижние отделы мочеточников, инфильтрировать шейку мочевого пузыря. Метастазы рака предстательной железы возникают чаще в костях таза, крестце, поясничных позвонках, в бедренных костях, реже в лимфатических узлах, печени, легких. Нередко первым и даже единственным симптомом заболевания являются поясчнично-крестцовая боль, которая зависит от костных метастазов или давления опухоли на нервные стволы и корешки. Иногда первым проявлением заболевания может быть патологический перелом кости на месте метастаза. При сдавлении нижних отделов мочеточников на первый план выступают боли в области почек и почечная недостаточность. Нарушения пассажа мочи являются причиною развития цистита, пиелонефрита, которые могут осложниться развитием уросепсиса. Регионарные метастазы могут стать причиной отека нижних конечностей, полового члена и мошонки. При росте опухоли в сторону прямой кишки отмечается нарушения акта дефекации. Прорастание прямой кишки встречается очень редко. Болезнь обычно протекает сравнительно медленно. Раковая кахексия наблюдается редко. Д и а г н о с т и к а. Анамнез поможет выявить особенности течения заболевания. При общем осмотре больного необходимо обратить внимание на общее состояние больного, кожные покровы, лимфатические узлы, состояние почек, печени, мочевого пузыря. В общем анализе мочи и крови нет характерных признаков рака предстательной железы. В большинстве больных отмечается увеличение СОЭ. В некоторых больных наблюдается лейкоцитоз, анемия, лейкоциурия и другие проявления осложнений рака предстательной железы. При подозрении на рак предстательной железы больному в первую очередь необходимо выполнить три исследования: 1. пальцевое ректальное исследование; 2. определение простатоспецифического антигена сыворотки крови (PSA); ультразвуковое исследование предстательной железы, при необходимости с пункцией предстательной железы. 1. При пальпаторном исследовании через прямую кишку обнаруживаются бугристые узлы или один массивный инфильтрат в предстательной железе, отсутствие четких ее контуров, а также рост опухоли вверх, в сторону семенных пузырьков. В секрете предстательной железы находят атипичные клетки. 2. Определение PSA кроме первичной диагностики рака предстательной железы, показано с целью: обнаружения рецидивов после радикальной простатэктомии; оценки эффективности лечения рака предстательной железы разными методами. Такой контроль концентрации PSA сыворотки крови (каждые 3-6 месяцев) позволяет своевременно менять тактику лечения. Методы определения простатоспецифического антигена. В данное время широкое распространение получил иммуноферментный метод определения простатоспецифического антигена (PSA). Для этого применяются наборы разных зарубежных фирм: Abbott laboratories, Нуbritech, Dianon systems и другие. Во всех методиках используются моноклональные антитела к простатоспецифическому антигену. Комплекс PSA-антитело атакуется иммуноконъюгатом фермента и поликлональными антителами к PSA, в результате чего образуется “сэндвич”, энзимная составляющая, которая реагирует с субстратом, который дает окраску или начинает флюоресцировать. Степень окраски или флюоресценции оценивается соответствующим устройством, в который вмонтирован спектрофотометр или флуориметр. Устройства разных фирм, отличаются прежде всего по степени автоматизации процесса определения. Рассмотрим методику определения PSA на примере иммуноферментного флюоресцентного анализа на устройство ІМХ (фирмы Abbott). В методике используются моноклональные антитела, фиксированные к микрочастичкам. Сыворотку больных разливают по кюветам и автоматически переносят в реакционную камеру, где она реагирует с моноклональными антителами, потом к комплексу, который образовался, добавляют поликлональные антитела из сыворотки козы против PSA, конъюгированные с щелочной фосфатазой. В результате реакции образуется “сэндвич”. Образовавшийся комплекс атакует 4-метилумбелилферол, который разлагается до метилумбелилферола, способного к флюоресцении. Устройство регистрирует скорость реакции, строит калиброванную кривую по набору стандаров и автоматически обсчитывает концентрацию PSA в пробе. Методика позволяет определить концентрацию вещества до 0,01 нг/мл и может использоваться для определения дельты PSA. Точность методов различных фирм идентичная, поэтому они широко применяются в практическом здравоохранении. 3.По данным ультразвукового исследования можно обнаружить ранние стадии рака предстательной железы. При ультрасонографии визуализируются гипоэхогенные узлы. Заключительный диагноз ставят на основании результатов биопсии предстательной железы. В последние годы ее успешно применяют под ультразвуковим наведенням. Биопсию предстательной железы можно проводить трансректальным, трансуретральным и промежностым доступом. Трансуретральная резекция предстательной железы (ТУР) позволяет получить большое количество материала для гистологического исследования и восстановить пассаж мочи. ТУР рекомендуется при верифицированном диагнозе рака предстательной железы только после проведения специфической гормональной терапии. При уретроцистоскопии может быть обнаружено прорастание шейки мочевого пузыря, искривление простатического отдела уретры узлами опухоли. По данным экскреторной урографии можно оценить состояние почек и верхних мочевых путей (несимметричное расширение почечных лоханок и мочеточников). Для рентгенологической картины костных метастазов характерной является пятнистость, мраморность. Для раннего распознавания костных метастазов в последние годы успешно применяют радиоизотопные методы исследования. Лимфангиоаденография позволяет обнаружить поражение лимфатических узлов. Успешно используется рентгеновская компъютерная томография и МРТ. Они дополняют полученную информацию полученную при ультразвуковом исследовании. По данным КТ и МРТ выявляют: узлы опухоли, размеры, локализацию, прорастания и инфильтрацию капсулы, шейки мочевого пузыря, окружяющих тканей, семенные пузырьков, увеличение и деформацию лимфатических узлов. Важное значение в раннем распознавании рака (как и ДГПЖ) предстательной железы имеет проведение профилактических ректальных исследований у мужчин старше 45 лет, так как нередко мужчины преклонного возраста считают появление у них расстройств мочеиспускания нормальным явлением для своего возраста и не всегда вовремя обращаются к врачу. Л е ч е н и е. При раке предстательной железы лечение в принципе должно быть оперативным и радикальным: удаление всей железы с клетчаткой, лимфатическими узлами, семенными пузырьками, промежностым, трансабдоминальным или позадилонним путем. Однако операция показана только на ранних стадиях болезни (Т1 і Т2 при отсутствии отдаленных метастазов и поражения лимфатических узлов). Таких больных в связи с малосимптомным началом заболевания немного. Наиболее распространенным сейчас в Украине методом лечения рака предстательной железы является: кастрация или энуклеация (вылущивание паренхимы) яичек для уменьшения продукции андрогенов с последующей терапией антиандрогенами, что приводит к значительному уменьшению опухоли и ее метастазов. Возможна медикаментозная кастрация. С этой целью используют препараты аналоги гонадотропин-релизинг гормона (золадекс, декапептил). Антиандрогены. Эффективность данной группы препаратов в данное время не вызывает сомнений. Одним из наиболее известных препаратов является флутамид (флуцином). Он може применяться, как для монотерапии, так и в сочетании с орхэктомией (доза-250 мг 3 раза в сутки). Доказана високая эффективность андрокура. Он может применяться, как для монотерапии, так и в сочетании с орхэктомиейй (доза-50-100 мг 2 раза в сутки). Наиболее эффективной в лечение рака предстательной железы считается “максимальная андрогенная блокада”, которую можно достичь сочетанием применения аналогов гонадотропин-релизинг гормона и антиандрогенов. Лучевая терапия. В последние годы благодаря появлению новых мощных источников лучевой энергии стала более эффективной лучевая терапия рака предстательной железы. Лучевое лечение возможно на всех стадиях рака предстательной железы. Возможно лучевое лечение, как первичной опухоли, так и метастазов. Также применяется локальное введение радиофармпрепарата непосредственно в опухоль предстательной железы при Т1N0M0 и Т2N0M0. Наиболее часто используются b-источники: радиоактивное золото 198Au; радиоактивный йод 125I. Для внутритканевой g -терапии используют в виде проволоки радиоактивный иридий 192Ir. Радиоактивный йод 125I наиболее широко используется в последние годы. Препарат вводится непосредственно в область поражения под контролем УЗИ в виде маленьких капсул. Курс лечения продолжается несколько месяцев. Процедура не требует госпитализации, простая, представляет возможность контролировать введенную дозу, практически нет таких осложнений, как поражение окружающих тканей, недержание мочи и эректильная дисфункция. Химиотерапия. Опухоли предстательной железы имеют низкую чувствительность к химиопрепаратам. При низкой чувствительности к гормональному лечению показано сочетание последнего с химиотерапией. Для химиотерапии рака предстательной железы применяют следующие препараты: адриамицин, цисплатин, метотрексат, 5-фторурацил, циклофосфан. Однако её эффективность является низкой и достигает 15-20%. Эффективным препаратом является эстрацит (30-60%). Он имеет свойства эстрогена и алкилизирующего агента. Может применяться внутривенно (300 мг) и per os (180 мг 3-4 раза в сутки). Необходимым является применение симптоматической терапии и коррекция иммуного статуса. При полной или частичной задержке мочеиспускания на почве рака предстательной железы применяют трансуретральную электрорезекцию, восстановливающую мочеиспускание. Лечение и наблюдение должно продолжаться до конца жизни больного. При таких условиях, жизнь больных раком предстательной железы может быть
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.92.6 (0.022 с.) |