
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятии и общая характеристика энтропииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Несоответствие между превращением теплоты в работу и работы в теплоту приводит к односторонней направленности реальных процессов в природе, что и отражает физический смысл второго начала термодинамики в законе о существовании и возрастании в реальных процессах некой функции, названной энтропией, определяющей меру обесценения энергии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях обратимого течения процессов: Общая характеристика: Энтропия (греч. en в, внутрь + trope поворот, превращение) - одна из величин, характеризующих тепловое состояние тела или системы тел; мера внутренней неупорядоченности системы; при всех процессах, происходящих в замкнутой системе, энтропия или возрастает (необратимые процессы), или остается постоянной (обратимые процессы). Впервые понятие энтропии было введено немецким физиком Рудольфом Клаузиусом в середине прошлого века. Он и английский лорд Вильям Томсон (Кельвин) открыли второе начало термодинамики и сделали из него неожиданные выводы. Это начало устанавливает наличие в природе фундаментальной асимметрии, то есть однонаправленности всех происходящих в ней самопроизвольных процессов. Об этой асимметрии свидетельствует все окружающее нас: горячие тела с течением времени охлаждаются, однако холодные сами по себе отнюдь не становятся горячими; прыгающий мяч в конце концов останавливается, однако покоящийся мяч самопроизвольно не начнет подскакивать. Здесь проявляется то свойство природы, которое Кельвин и Клаузиус смогли отделить от свойства сохранения энергии. Оно состоит в том, что, хотя полное количество энергии должно сохраняться в любом процессе, распределение имеющейся энергии изменяется необратимым образом. Второе начало термодинамики указывает естественное направление, в котором происходит изменение распределения энергии, причем это направление совершенно не зависит от ее общего количества. При всех превращениях различные виды энергии в конечном счете переходят в тепло, которое, будучи предоставлено себе, рассеивается в мировом пространстве. Так как такой процесс рассеяния тепла необратим, то рано или поздно все звезды погаснут, все активные процессы в Природе прекратятся, и наступит состояние, которое Клаузиус назвал "тепловой смертью" Вселенной. В ходе рассуждений о "тепловой смерти" Вселенной Клаузиус ввел некоторую математическую величину, названную им энтропией. По сути дела энтропия служит мерой степени беспорядка, степени хаотичности состояния физической системы. Второе начало термодинамики гласит, что энтропия изолированной физической системы никогда не убывает, - в крайнем случае она может сохранять свое значение неизменным. Принцип возрастания энтропии Всякие естественные процессы сопровождаются возрастанием энтропии Вселенной; такое утверждение часто называют принципом энтропии. Также энтропия характеризует условия, при которых запасается энергия: если энергия запасается при высокой температуре, ее энтропия относительно низка, а качество, напротив, высоко. С другой стороны, если то же количество энергии запасается при низкой температуре, то энтропия, связанная с этой энергией, велика, а ее качество - низко. Возрастание энтропии является характерным признаком естественных процессов и соответствует запасанию энергии при более низких температурах. Аналогично можно сказать, что естественное направление процессов изменения характеризуется понижением качества энергии. Такое истолкование связи энергии и энтропии, при котором энтропия характеризует условия запасания и хранения энергии, имеет большое практическое значение. Первое начало термодинамики утверждает, что энергия изолированной системы (а возможно, и всей Вселенной) остается постоянной. Поэтому, сжигая ископаемое топливо - уголь, нефть, уран - мы не уменьшаем общих запасов энергии. В этом смысле энергетический кризис вообще невозможен, так как энергия в мире всегда будет оставаться неизменной. Однако, сжигая горсть угля и каплю нефти, мы увеличиваем энтропию мира, поскольку все названные процессы протекают самопроизвольно. Любое действие приводит к понижению качества энергии Вселенной. Поскольку в промышленно развитом обществе процесс использования ресурсов стремительно ускоряется, то энтропия Вселенной неуклонно возрастает. Нужно стремиться направить развитие цивилизации по пути снижения уровня производства энтропии и сохранения качества энергии. Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов: В действительности принципы существования и возрастания энтропии ничего общего не имеют. Физическое содержание: принцип существования энтропии характеризует термодинамические свойства систем, а принцип возрастания энтропии - наиболее вероятное течение реальных процессов. Математическое выражение принципа существования энтропии - равенство, а принципа возрастания - неравенство. Области применения: принцип существования энтропии и вытекающие из него следствия используют для изучения физических свойств веществ, а принцип возрастания энтропии - для суждения о наиболее вероятном течении физических явлений. Философское значение этих принципов также различно. В связи с этим принципы существования и возрастания энтропии рассматриваются раздельно и математические выражения их для любых тел получаются на базе различных постулатов. Вывод о существовании абсолютной температуры T и энтропии s как термодинамических функций состояния любых тел и систем составляет основное содержание второго закона термодинамики и распространяется на любые процессы - обратимые и необратимые. Термодинамические потенциалы. Термодинами́ческие потенциа́лы (термодинамические функции) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе. Термин был введён Пьером Дюгемом, Гиббс в своих работах использовал термин «фундаментальные функции». Выделяют следующие термодинамические потенциалы: § внутренняя энергия § энтальпия § свободная энергия Гельмгольца § потенциал Гиббса § большой термодинамический потенциал Внутренняя энергия Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами:
[править]Энтальпия Определяется следующим образом:
где Поскольку в изобарном процессе работа равна [править]Свободная энергия Гельмгольца Также часто называемый просто свободной энергией. Определяется следующим образом:
где Поскольку в изотермическом процессе количество теплоты, полученное системой, равно [править]Потенциал Гиббса Также называемый энергией Гиббса, термодинамическим потенциалом, свободной энергией Гиббса и даже просто свободной энергией (что может привести к смешиванию потенциала Гиббса со свободной энергией Гельмгольца):
[править]Термодинамические потенциалы и максимальная работа Внутренняя энергия представляет собой полную энергию системы. Однако второе начало термодинамики запрещает превратить всю внутреннюю энергию в работу. Можно показать, что максимальная полная работа (как над средой, так и над внешними телами), которая может быть получена от системы в изотермическом процессе, равна убыли свободной энергии Гельмгольца в этом процессе:
где В этом смысле В некоторых приложениях приходится различать полную и полезную работу. Последняя представляет собой работу системы над внешними телами, исключая среду, в которую она погружена. Максимальная полезная работа системы равна
где В этом смысле энергия Гиббса также является свободной.
|
||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 1258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.008 с.) |

 .
. ,
, — давление, а
— давление, а  — объем.
— объем. , приращение энтальпии в квазистатическом изобарном процессе равно количеству теплоты, полученному системой.
, приращение энтальпии в квазистатическом изобарном процессе равно количеству теплоты, полученному системой. ,
, — температура и
— температура и  — энтропия.
— энтропия. , то убыль свободной энергии в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
, то убыль свободной энергии в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами. .
. ,
, — свободная энергия Гельмгольца.
— свободная энергия Гельмгольца.
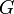 — энергия Гиббса.
— энергия Гиббса.


