
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 2. Энтропия и энергия Гиббса
Раздел 1. Термохимия Примеры задач с решениями v Задача 1. Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразного хлороводорода HCl из простых веществ в стандартных условиях выделяется 92 кДж теплоты. Решение Термохимическими уравнениями называют уравнения химических реакций, записанные с указанием значения энтальпии DH (кДж) и агрегатного состояния участвующих в реакции веществ. Энтальпия реакции DH0 = Qp = ‑92 кДж, появление знака (‑) связано с тем, что энтальпии экзотермических реакций принято считать отрицательными. Термохимическое уравнение реакции 1/2H2(г) + 1/2Cl2(г) = HCl(г), ∆Н0 = – 92 кДж. Возможен другой вариант ответа, получаемый удвоением этого уравнения: H2(г) + Cl2(г) = 2HCl(г), ∆Н0 = – 184 кДж. v Задача 2. Рассчитайте стандартную энтальпию образования Al2O3(т), если известно термохимическое уравнение 4Al (т) + 3O2 (г) = 2Al2O3 (т), DH0 = – 3340 кДж. Решение Энтальпией образования вещества называют энтальпию реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях. Уравнение приведенной реакции соответствует образованию 2 моль оксида алюминия из простых веществ – алюминия и кислорода. С термохимическими уравнениями можно проводить простейшие математические процедуры: складывать, вычитать, умножать или делить на какое-либо число. Разделим уравнение реакции на два, чтобы оно соответствовало образованию 1 моль вещества (пропорционально уменьшим и значение энтальпии): 2Al (т) + 3/2O2 (г) = Al2O3 (т), Ответ: стандартная энтальпия образования оксида алюминия v Задача 3. Расположите формулы веществ (см. таблицу) в порядке увеличения устойчивости. Ответ мотивируйте.
Решение Значения энтальпий образования позволяют сравнивать устойчивость однотипных соединений: чем меньше значение энтальпии образования, тем устойчивее соединение. Расположение формул веществ в порядке увеличения устойчивости H2Te (г) H2Se (г) H2S (г) H2O (г). v Задача 4. Запишите, какое соотношение существует между энтальпиями реакций DH1, DH2 и DH3, если известны термохимические уравнения. 1) С (графит) + O2(г) = CO2(г), DH1; 2) С (графит) + 1/2O2(г) = CO(г), DH2; 3) CO(г) + 1/2O2(г) = CO2 (г), DH3.
Решение Термохимические уравнения можно складывать, вычитатьи т. д.Уравнение (1) может быть получено сложением уравнений (2) и (3), т.е.
Ответ: v Задача 5. Определите по справочным данным стандартную энтальпию реакции С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г).
Решение Значение энтальпии реакции находим по первому следствию закона Гесса
v Задача 6. Рассчитайте количество теплоты, выделяющейся (или поглощающейся) при гашении 1 кг извести в стандартных условиях. Значения стандартных энтальпий образования веществ приведены в таблице.
Решение Уравнение реакции гашения извести: CaO(т) + Н2О(ж) = Са(ОН)2(т). Тепловой эффект реакции равен энтальпии реакции, значение которой находим по первому следствию закона Гесса:
Энтальпия реакции отрицательна, т.е. при гашении извести теплота выделяется. Количество теплоты Q = DH0 = ‑66 кДж соответствует гашению 1 моль СаО. Рассчитываем количество вещества, содержащееся в 1 кг оксида кальция:
Количество теплоты, выделяющейся при гашении 1 кг извести,
Ответ: при гашении 1 кг извести в стандартных условиях выделяется 1175 кДж теплоты. 1.2. Вопросы для самоподготовки 1. Укажите, что показывает величина DH0 для реакций (1) и (2): значение энтальпии реакции, значение энтальпии образования CaCO3(т) и FeO(к) соответственно или то и другое. Ответ обоснуйте. 1) CaO(т) + СO2(г) = CaCO3(т), DH0 = ‑180 кДж; 2) Fe(к) + 1/2O2(г) = FeO(к), DH0 = ‑272 кДж. 2. Укажите, какой из оксидов, Hg2О или K2О, разлагается на простые вещества при более высокой температуре, если энтальпии образования оксидов соответственно равны (кДж/моль): ‑91, ‑360. 3. Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразной воды из простых веществ в стандартных условиях выделяется 242 кДж теплоты. 4. Рассчитайте значение
5. Рассчитайте стандартную энтальпию образования метилового спирта CH3OH(ж), термохимическое уравнение реакции горения которого
CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж), DH0 = ‑726,5 кДж/моль. Значения стандартных энтальпий образования веществ приведены в таблице.
Примеры задач с решениями v Задача 1. Не производя вычислений, укажите знак DS следующих процессов: а) 2NO(г) + O2(г) = 2NO2(г); б) CO2(к) = CO2(г); в) 2CH3OH(ж) + 3O2(г) = 2CO2(г) + 4H2O(ж). Решение В ходе реакций (а) и (в), сопровождающихся уменьшением количества газообразных веществ, энтропия уменьшается (DS<0).Реакция (б) – процесс сублимации (твердое ® газ), энтропия увеличивается (DS>0). Ответ: а) DS<0; б) DS>0; в) DS<0. v Задача 2. Оцените термодинамическую возможность прохождения реакции CaO(т) + CO2(г) = CaCO3(т) в стандартных условиях. Справочные данные приведены в таблице.
Решение Способ 1. Стандартная энергия Гиббса химической реакции
Способ 2. Значение стандартной энергии Гиббса реакции рассчитываем по формуле Стандартная энтальпия химической реакции
Стандартная энтропия химической реакции
2.2. Вопросы для самоподготовки 1. Не проводя вычислений, обоснуйте, как изменяется энтропия системы в ходе реакций 4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г); 2NO (г) + O2 (г) = 2NO2 (г); C (т) + H2O (г) = CO (г) + H2 (г). 2. Рассчитайте по справочным данным значение DS0 реакции С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г).
3. Рассчитайте значение DG0 по справочным данным и оцените возможность самопроизвольного прохождения в стандартных условиях реакции MgCO3(т) = MgO(т) + CO2(г).
4. Рассчитайте значение CCl4(г) + 4HCl (г) = СH4(г) + 4Cl2(г), если известны значения
Примеры задач с решениями v Задача 1. Для реакции 2NO(г) + Cl2(г) = 2NOCl(г) экспериментальное кинетическое уравнение совпадает с математическим выражением закона действующих масс. Определите, во сколько раз увеличится скорость реакции при увеличении концентрации оксида азота (II) в три раза. Решение Кинетическим уравнением называют математическую зависимость скорости реакции от концентрации. Согласно закону действующих масс, скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам. Кинетическое уравнение данной реакции
Константа скорости реакции k, входящая в кинетическое уравнение, не зависит от концентрации веществ. Обозначим скорость реакции в системе исходного состава
Ответ: в 9 раз. v Задача 2. Рассчитайте, во сколько раз возрастает скорость реакции при повышении температуры от 20 до 50 0С (g = 3). Решение Согласно правилу Вант-Гоффа
Ответ: в 27 раз. v Задача 3. Рассчитайте, во сколько раз увеличится продолжительность некоторой реакции при понижении температуры на 40 градусов (g = 2). Решение Продолжительность и скорость реакции – обратно пропорциональные величины. Обозначим
Ответ: в 16 раз. 3.2. Вопросы для самоподготовки 1. Запишите кинетическое уравнение элементарной реакции 2NO(г) + О2(г) = 2NO2(г) и поясните смысл величин, входящих в кинетическое уравнение. Рассчитайте, как изменится скорость реакции при уменьшении концентрации NO в 2 раза. 2. Кинетическое уравнение реакции 4H2(г) + 2NO2(г) = 4H2O(г) + N2(г) имеет вид Раздел 1. Термохимия Примеры задач с решениями v Задача 1. Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразного хлороводорода HCl из простых веществ в стандартных условиях выделяется 92 кДж теплоты. Решение Термохимическими уравнениями называют уравнения химических реакций, записанные с указанием значения энтальпии DH (кДж) и агрегатного состояния участвующих в реакции веществ. Энтальпия реакции DH0 = Qp = ‑92 кДж, появление знака (‑) связано с тем, что энтальпии экзотермических реакций принято считать отрицательными. Термохимическое уравнение реакции 1/2H2(г) + 1/2Cl2(г) = HCl(г), ∆Н0 = – 92 кДж. Возможен другой вариант ответа, получаемый удвоением этого уравнения: H2(г) + Cl2(г) = 2HCl(г), ∆Н0 = – 184 кДж. v Задача 2. Рассчитайте стандартную энтальпию образования Al2O3(т), если известно термохимическое уравнение 4Al (т) + 3O2 (г) = 2Al2O3 (т), DH0 = – 3340 кДж. Решение Энтальпией образования вещества называют энтальпию реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях. Уравнение приведенной реакции соответствует образованию 2 моль оксида алюминия из простых веществ – алюминия и кислорода. С термохимическими уравнениями можно проводить простейшие математические процедуры: складывать, вычитать, умножать или делить на какое-либо число. Разделим уравнение реакции на два, чтобы оно соответствовало образованию 1 моль вещества (пропорционально уменьшим и значение энтальпии): 2Al (т) + 3/2O2 (г) = Al2O3 (т), Ответ: стандартная энтальпия образования оксида алюминия v Задача 3. Расположите формулы веществ (см. таблицу) в порядке увеличения устойчивости. Ответ мотивируйте.
Решение Значения энтальпий образования позволяют сравнивать устойчивость однотипных соединений: чем меньше значение энтальпии образования, тем устойчивее соединение. Расположение формул веществ в порядке увеличения устойчивости
H2Te (г) H2Se (г) H2S (г) H2O (г). v Задача 4. Запишите, какое соотношение существует между энтальпиями реакций DH1, DH2 и DH3, если известны термохимические уравнения. 1) С (графит) + O2(г) = CO2(г), DH1; 2) С (графит) + 1/2O2(г) = CO(г), DH2; 3) CO(г) + 1/2O2(г) = CO2 (г), DH3. Решение Термохимические уравнения можно складывать, вычитатьи т. д.Уравнение (1) может быть получено сложением уравнений (2) и (3), т.е.
Ответ: v Задача 5. Определите по справочным данным стандартную энтальпию реакции С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г).
Решение Значение энтальпии реакции находим по первому следствию закона Гесса
v Задача 6. Рассчитайте количество теплоты, выделяющейся (или поглощающейся) при гашении 1 кг извести в стандартных условиях. Значения стандартных энтальпий образования веществ приведены в таблице.
Решение Уравнение реакции гашения извести: CaO(т) + Н2О(ж) = Са(ОН)2(т). Тепловой эффект реакции равен энтальпии реакции, значение которой находим по первому следствию закона Гесса:
Энтальпия реакции отрицательна, т.е. при гашении извести теплота выделяется. Количество теплоты Q = DH0 = ‑66 кДж соответствует гашению 1 моль СаО. Рассчитываем количество вещества, содержащееся в 1 кг оксида кальция:
Количество теплоты, выделяющейся при гашении 1 кг извести,
Ответ: при гашении 1 кг извести в стандартных условиях выделяется 1175 кДж теплоты. 1.2. Вопросы для самоподготовки 1. Укажите, что показывает величина DH0 для реакций (1) и (2): значение энтальпии реакции, значение энтальпии образования CaCO3(т) и FeO(к) соответственно или то и другое. Ответ обоснуйте. 1) CaO(т) + СO2(г) = CaCO3(т), DH0 = ‑180 кДж; 2) Fe(к) + 1/2O2(г) = FeO(к), DH0 = ‑272 кДж. 2. Укажите, какой из оксидов, Hg2О или K2О, разлагается на простые вещества при более высокой температуре, если энтальпии образования оксидов соответственно равны (кДж/моль): ‑91, ‑360. 3. Запишите термохимическое уравнение реакции, если известно, что при образовании 1 моль газообразной воды из простых веществ в стандартных условиях выделяется 242 кДж теплоты. 4. Рассчитайте значение
5. Рассчитайте стандартную энтальпию образования метилового спирта CH3OH(ж), термохимическое уравнение реакции горения которого CH3OH(ж) + 3/2O2(г) = CO2(г) + 2H2O(ж), DH0 = ‑726,5 кДж/моль. Значения стандартных энтальпий образования веществ приведены в таблице.
Раздел 2. Энтропия и энергия Гиббса Примеры задач с решениями v Задача 1. Не производя вычислений, укажите знак DS следующих процессов: а) 2NO(г) + O2(г) = 2NO2(г); б) CO2(к) = CO2(г); в) 2CH3OH(ж) + 3O2(г) = 2CO2(г) + 4H2O(ж). Решение В ходе реакций (а) и (в), сопровождающихся уменьшением количества газообразных веществ, энтропия уменьшается (DS<0).Реакция (б) – процесс сублимации (твердое ® газ), энтропия увеличивается (DS>0).
Ответ: а) DS<0; б) DS>0; в) DS<0. v Задача 2. Оцените термодинамическую возможность прохождения реакции CaO(т) + CO2(г) = CaCO3(т) в стандартных условиях. Справочные данные приведены в таблице.
Решение Способ 1. Стандартная энергия Гиббса химической реакции
Способ 2. Значение стандартной энергии Гиббса реакции рассчитываем по формуле Стандартная энтальпия химической реакции
Стандартная энтропия химической реакции
2.2. Вопросы для самоподготовки 1. Не проводя вычислений, обоснуйте, как изменяется энтропия системы в ходе реакций 4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (г); 2NO (г) + O2 (г) = 2NO2 (г); C (т) + H2O (г) = CO (г) + H2 (г). 2. Рассчитайте по справочным данным значение DS0 реакции С2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г).
3. Рассчитайте значение DG0 по справочным данным и оцените возможность самопроизвольного прохождения в стандартных условиях реакции MgCO3(т) = MgO(т) + CO2(г).
4. Рассчитайте значение CCl4(г) + 4HCl (г) = СH4(г) + 4Cl2(г), если известны значения
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 763; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.102.79 (0.01 с.) |
 .
.

 Ответ:
Ответ: 



 реакции Fe3O4(к) + C(к) = 3FeO(к) + СO(г), используя справочные данные, и укажите, экзо- или эндотермической является данная реакция.
реакции Fe3O4(к) + C(к) = 3FeO(к) + СO(г), используя справочные данные, и укажите, экзо- или эндотермической является данная реакция. кДж/моль
кДж/моль
 , кДж/моль
, кДж/моль
 .
. , подставляя в нее значения
, подставляя в нее значения  ,
,  и
и  с учетом их размерностей.
с учетом их размерностей.
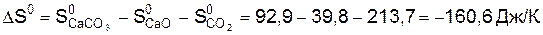
 .
. , в стандартных условиях реакция термодинамически возможна.
, в стандартных условиях реакция термодинамически возможна. , Дж/(моль.К)
, Дж/(моль.К)
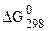 реакции
реакции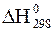 = +434 кДж/моль и D
= +434 кДж/моль и D  = - 117 Дж/(моль.К). Оцените термодинамическую возможность данной реакции в стандартных условиях.
= - 117 Дж/(моль.К). Оцените термодинамическую возможность данной реакции в стандартных условиях.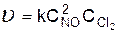 .
. . Скорость реакции при повышении концентрации оксида азота в три раза
. Скорость реакции при повышении концентрации оксида азота в три раза

 и
и  продолжительность реакции при температуре Т2 и Т1 соответственно (Т2 < Т1).
продолжительность реакции при температуре Т2 и Т1 соответственно (Т2 < Т1).
 . Рассчитайте, во сколько раз увеличится скорость реакции при увеличении давления в 2 раза.
. Рассчитайте, во сколько раз увеличится скорость реакции при увеличении давления в 2 раза.


