
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрод. Двойной электрический слой. Стандартные электродные потенциалы. Стандартный водородный электрод.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электрод – электрический проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником – электролитом (ионной жидкостью, ионизированным газом, твердым электролитом). Важнейшей хар-кой является электродный потенциал, устанавливающийся на границе электрод\электролит. Электроды: первого рода, второго рода. К электродам 1го рода относят электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. На металлической пластинке идет процесс перехода катионов из металла в р-р либо из р-ра в металл. Т.о электроды 1го рода обратимы по катиону и их потенциал связан с ур-ем Нернста. Сюда же относят водородный электрод. Электроды 2го рода - электроды, в которых металл покрыт малорастворимой солью этого металла и находится в р-ре, содержащем другую растворимую соль с тем же анионом. Обратимы относительно аниона. Полярные молекулы воды начинают взаимодействовать с ион-атомами, которые находятся на границе раздела металл\растворитель. Результат взаимодействия – переход гидратированных ион-атомов в раствор. В результате перехода в раствор заряженных ионов в металле остаются избыточные свободные электроны, а перешедшие в р-р ион-атомы группируются вблизи металлической поверхности со стороны раствора. Происходит пространственное разделение зарядов. На границе раздела двух фаз (металл/раствор) возникает ДЭС. Строение ДЭС напоминает строение плоского конденсатора. Положительная обкладка образована гидратированными катионами металла, которые скапливаются в приповерхностном слое раствора. Отрицательная обкладка – отрицательно заряженная поверхность металлической пластинки. Возникающая на границе раздела металл\раствор разность потенциалов получила название электродного потенциала. В результате возникновения разности потенциалов переход катионов из металла в раствор затрудняется и замедляется.Одновременно с этим развивается обратный процесс – возвращение катионов из р-ра на металлическую пластинку. Следствие – на границе раздела устанавливается химическое равновесие: Men-+nḗ↔Me0 Установившееся равновесие – равновесие ОВР. Система, состоящая из металла, погруженного в р-р электролита, - электрод. Электроды в электрохимии – это системы из двух токопроводящих тел проводников 1го рода(металл) и 2го рода(р-р электролита). Значение электродного потенциала зависит от: 1)Концентрации электролита. Применим принцип Ле-Шателье для анализа влияния концентрации электролита на установившееся на границе раздела фаз равновесие ОВР: M+solvent↔(Mn-*solvent)+nḗ Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в р-р равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к р-ру. Если малоактивный металл погружен в р-р соли с концентрацией больше равновесной, то происходит переход ионов из р-ра на металл, который заряжается положительно. В любом случае возникает ДЭС и появляется разность электрических потенциалов. Отметим,что металлическая пластинка может заряжаться и положительно – все зависит от соотношения равновесной и действующей в р-ре концентраций потенциалоопределяющих ионов. Уравнение Нернста: E= 3) Температуры. Абсолютную разность потенциалов определить нельзя. Можно измерить разность потенциалов двух различных электродов. Принято для измерения электродных потенциалов собирать гэ, где в качестве анода применять стандартный водородный электрод. При этом СВЭ считать анодом, а его потенциал принимать = 0. Тогда, согласно ф-ле расчета ЭДС, значение измеряемой разности потенциалов принимают равным значению электродного потенциала. Измеряемый электрод всегда считают катодом. СВЭ║измеряемый электрод Измеряемый электрод – катод. Р-я восстановления. Ме – окислитель, сам восстанавливается. ε ˚катода = ε ˚x Всё соответствует принятым договоренностям: электроны идут Н2(восст-ля) к атому металла(ок-лю). ε ˚к- ε ˚а >0; ▲G <0; ε ˚к >0. Природа не согласна: на самом деле окислитель катион водорода (катод), а атом металла(восст-ль) –анод. Электроны идут от атома металла к катиону водорода. В зависимости от величины и знака ε все металлы можно расположить в ряд стандартных электродных потенциалов. Величина СВЭ (а след водородного потенциала) принимается = 0. Электродным потенциалом металлов, которые по отношению к водороду проявляют восстановительные св-ва, приписывают отрицательные знаки, а электродным потенциалам металлов, по отношению к которым водород проявляет восстановительные св-ва – положительные значения. Металлы, обладающие отрицательными значениями электродного потенциала, вытесняют водород р-ров кислот (где водород находится в сост-ии положительно заряженного иона водорода Н(+). Металлы, обладающие меньшим значением электродного потенциала, являются восстановителями по отношению к металлам с большим значением электродного потенциала и способны вытеснять их из водных р-ров их солей. В связи с принятой системой измерения все электродные процессы записываются как катодные процессы. Значения стандартных электродных потенциалов являются табличными значениями. Величина ЭДС определяется как Е = ε˚ катода - ε ˚ анода. При расчете ЭДС не следует менять знаки величин электродных потенциалов, взятые из таблиц. При этом надо четко установить, какой процесс является анодным, а какой катодным.
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1060; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.207.112 (0.006 с.) |

 ДЭС – слой ионов, образующихся на поверхности частиц в результате адсорбции ионов из р-ра, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов – противоионами.
ДЭС – слой ионов, образующихся на поверхности частиц в результате адсорбции ионов из р-ра, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью, называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов – противоионами.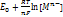 ,
,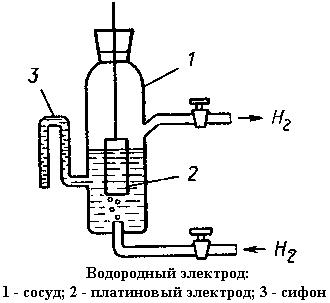 СВЭ – анод. Р-я окисления Н2. Водород восстановитель, отдает электроны, сам окисляется. ε ˚анода =0.
СВЭ – анод. Р-я окисления Н2. Водород восстановитель, отдает электроны, сам окисляется. ε ˚анода =0.


