
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергия межмолекулярного взаимодействия.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия. Силы Ван-дер-Ваальса включают все виды межмолекулярного притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов и жидкостей. При рассмотрении реальных газов - газов, свойства которых зависят от взаимодействия молекул, надо учитывать силы межмолекулярного взаимодействия. Они проявляются на расстояниях < 10–9 м и быстро убывают при увеличении расстояния между молекулами. Такие силы называются короткодействующими. Эти силы определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От них зависят многие структурные, спектральные и другие свойства веществ. Основу ван-дер-ваальсовых сил составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. На определенном расстоянии между молекулами силы притяжения и отталкивания уравновешивают друг друга, и образуется устойчивая система. Ван-дер-ваальсовы силы заметно уступают химическому связыванию. Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого межмолекулярного притяжения нельзя получить жидкий и твердый хлор. Ван-дер-Ваальс, объясняя свойства реальных газов и жидкостей, предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. Межмолекулярные взаимодействия имеют электрическую природу и складываются из сил притяжения (ориентационных, индукционных) и сил отталкивания. Ориентационные силы действуют между полярными молекулами - молекулами, обладающими дипольными или квадрупольными моментами. Сила притяжения между молекулами зависит от их взаимной ориентации, поэтому они и называются ориентационными. Хаотическое тепловое движение непрерывно меняет ориентацию полярных молекул, но среднее по всем ориентациям значение силы не равно нулю Среднее значение потенциальной энергии ориентационного межмолекулярного взаимодействия равно
20. Основные классы неорганических веществ: оксиды, кислоты, основания, соли. Кислотно-основные свойства оксидов и гидроксосоединений s и p-элементов в зависимости от положения элементов в периодической системе Д.И.Менделеева. Схема Косселя. Связь с радиусами и степенями окисления. Амфотерные соединения.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-). Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот. Получение: 1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой: 2Na + 2H2O→2NaOH +H2; Ca+2H2O →Ca(OH)2 + H2; 2.Взаимодействие оксидов активных металлов с водой: BaO + H2O →Ba(OH)2; 3.Электролиз водных растворов солей 2NaCl + 2H2O →2NaOH + H2 + Cl2;
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+). Классификация 1. По составу: бескислородные и кислородсодержащие. Бескислородные: HCl - хлористоводородная (соляная), HBr - бромистоводородная, HI - йодистоводородная, HF - фтористоводородная (плавиковая), H2S - сероводородная. Кислородосодержащие: HNO3 – азотная, H2SO3 - сернистая, H2SO4 – серная, H2CO3 - угольная, H2SiO3 - кремниевая, H3PO4 - ортофосфорная. 2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные. Получение:1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O→H2SO4; P2O5 + 3H2O →2H3PO4 2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот): H2 + Cl2 →2HCl; H2 + S→H2S. 3 Реакциями обмена соли с кислотой Ba(NO3)2 + H2SO4 → BaSO4¯ + 2HNO3; в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами: Na2SiO3 + 2HCl → H2SiO3 + 2NaCl; 2NaCl(тв.) + H2SO4(конц.) →Na2SO4 + 2HCl Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Средние. При диссоциации дают только катионы металла (или NH4+). Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка. Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла. Основные. При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка. Продукты неполного замещения групп OH соответствующего основания на кислотные остатки. Двойные. При диссоциации дают два катиона и один анион. Смешанные. Образованы одним катионом и двумя анионами. Комплексные. Содержат сложные катионы или анионы. Средние соли. Получение: Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами: 1) металла с неметаллом: 2Na + Cl2→2NaCl 2) металла с кислотой: Zn + 2HCl →ZnCl2 + H2 3) металла с раствором соли менее активного металла: Fe + CuSO4 → FeSO4 + Cu 4) основного оксида с кислотным оксидом: MgO + CO2 5) основного оксида с кислотой: CuO + H2SO4 →CuSO4 + H2O 6) основания с кислотным оксидом: Ba(OH)2 + CO2 →BaCO3 + H2O 7) основания с кислотой: Ca(OH)2 + 2HCl→CaCl2 + 2H2O 8) соли с кислотой: MgCO3 + 2HCl → MgCl2 + H2O + CO2 9) раствора основания с раствором соли: Ba(OH)2 + Na2SO4 →2NaOH + BaSO4¯ 10) растворов двух солей3CaCl2 + 2Na3PO4 → Ca3(PO4)2¯ + 6NaCl Кислые соли. Получение: 1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 → KHSO4 + H2O 2. Взаимодействие основания с избытком кислотного оксида Ca(OH)2 + 2CO2 →Ca(HCO3)2 3. Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4→3Ca(H2PO4)2 Основные соли. Получение: 1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + H2O → [Zn(OH)]Cl + HCl 2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH → [Al(OH)2]Cl + 2NaCl 3. Взаимодействие солей слабых кислот со средними солями: 2MgCl2 + 2Na2CO3 + H2O → [Mg(OH)]2CO3¯ + CO2 + 4NaCl Для объяснения характера изменения кислотно-основных свойств соединений элементов Коссель (Германия) предложил использовать простую схему, основанную на предположении о том, что в молекулах существует чисто ионная связь и между ионами имеет место кулоновское взаимодействие. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э-Н и Э-О-Н, в зависимости от заряда ядра и радиуса образующего их элемента. Схема Косселя для двух гидроксидов металлов, например, LiOH и KOH показана на рис. Как видно из представленной схемы, радиус иона Li+ меньше радиуса иона К+ и ОН- –группа связана прочнее с катионом лития, чем с катионом калия. В результате КОН будет легче диссоциировать в растворе и основные свойства гидроксида калия будут выражены сильнее. Аналогичным образом можно проанализировать схему Косселя для двух оснований CuOH и Cu(OH)2. Поскольку радиус иона Cu2+ меньше, а заряд – больше, чем у иона Cu+, ОН- -группу будет прочнее удерживать ион Cu2+. В результате основание Cu(OH)2 будет более слабым, чем CuOH. Таким образом, сила оснований возрастает при увеличении радиуса катиона и уменьшении его положительного заряда. В главных подгруппах сверху вниз сила оснований увеличивается, поскольку в этом направлении возрастают радиусы ионов элементов. В периодах слева направо происходит уменьшение радиусов ионов элементов и увеличение их положительного заряда, поэтому в этом направлении сила оснований уменьшается. Схема Косселя для двух бескислородных кислот, например, HCl и HI. Поскольку радиус хлорид-иона меньше, чем иодид-иона, ион Н+ прочнее связан с анионом в молекуле хлороводородной кислоты, которая будет слабее, чем иодоводородная кислота. Таким образом, сила бескислородных кислот возрастает с увеличением радиуса отрицательного иона. Сила кислородсодержащих кислот изменяется противоположным образом. Она увеличивается с уменьшением радиуса иона и увеличением его положительного заряда. На риспредставлена схема Косселя для двух кислот HClO и HClO4. Ион С17+ прочно связан с ионом кислорода, поэтому протон легче будет отщепляться в молекуле НС1О4. В то же время связь иона С1+ с ионом О2- менее прочная, и в молекуле НС1О протон будет сильнее удерживаться анионом О2-. В результате HClO4 будет более сильной кислотой, чем HClO. Достоинством схемы Косселя является то, что она с использованием простой модели позволяет объяснить характер изменения кислотно-основных свойств соединений в ряду сходных веществ. Вместе с тем эта схема является чисто качественной. Она позволяет лишь сравнивать свойства соединений и не дает возможность определить кислотно-основные свойства произвольно выбранного одного соединения. Недостатком этой модели является то, что в ее основу положены только электростатические представления, в то время как в природе не существует чистой (стопроцентной) ионной связи. Амфоте́рность (от др.-греч. (ἀμφότεροι — «двойственный», «обоюдный») — способность некоторых химических веществ и соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства. Амфотерны гидроксиды таких элементов главных подгрупп, как бериллий, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+), так и по механизму оснований (отщепление гидроксид-ионов, OH–). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами. Элементы лежат на условно проведенной диагонали Be — At: самые часто встречающиеся в школьной программе — это Be и Al Амфотерные гидроксиды и оксиды образуются металлами — d-элементами в средней степени окисления. Al(OH)3 + NaOH(избыток) = NaAlO2 + 2H2O (алюминат натрия и вода) Al(OH)3 + 3HCl = AlCl3 + 3H2O 21.Гальванические элементы. Элементы Даниэля-Якоби. Концентрационные гальванические элементы. Расчет ЭДС и ▲G гальванических элементов. Свинцовый аккумулятор. Система, состоящая из двух электродов соединенных в гальваническую цепь, получила название гальванического элемента.
Гальваническая цепь. Гальванический элемент Даниэля-Якоби:
Под действием разности потенциалов начнется перемещение электронов с одного электрода на другой. Нарушится равновесие в ДЭС. Система стремится восстановить нарушенное равновесие. При этом на одном из электродов будет проходить реакция окисления (анод). На другом электроде – р-я восстановления (катод). В рез-те протекания анодного окисления и катодного восстановления в ГЭ начинает протекать ОВР. В этой ОВР процессы окисления и восстановления разнесены в пространстве. Электроны от восстановителя к окислителю переходят по внешней цепи, т.е. в ГЭ начинает протекать электрический ток. Энергию ОВР можно превратить в электрическую энергию. В р-ре вся энергии я ОВР превращается в тепловую энергию. Электрохимические процессы – частный случай ОВР. ОВР можно осуществлять двумя способами: 1) При прямом контакте окислителя и восстановителя, когда электроны переходят от восстановителя непосредственно к окислителю. 2) При пространственном разделении окислителя и восстановителя, когда электроны переходят по проводнику электрического тока – по внешней цепи. Возникающая разность потенциалов получила название ЭДС (электродвижущей силы). Е = ε˚ катода - ε ˚ анода. При протекании электрического тока совершается работа по переносу заряда от восстановителя к окислителю, которая связана с изменением энергии Гиббса. n- кол-во электронов, F- постоянная Фарадея = 96500 Кл*моль(-1), Е- стандартный электродный потенциал, рассчитывается по формуле Нернста:
Концентрационные гальванические элементы: Особенность в том, что оба электрода из одного и того же металла. Эти электроды отличаются только концентрацией солевых растворов. Недостатки: разрушаемый анод, малая ЭДС. Используются в тех случаях, где необходима малая ЭДС.
Свинцовый аккумулятор:
На катоде – восстановление оксида свинца(IV) PbO2. PbO2 +4H(+) + SO4(2-) +2e →PbSO4+2H2O На аноде – окисление свинца Pb˚. Pb˚+ SO4(2-) – 2e→PbSO4 Суммарный процесс, обеспечивающий генерацию электрического тока в свинцовом аккумуляторе, имеет вид: Pb+PbO2+2H2SO4↔2PbSO4+2H2O При этом расходуется серная кислота и ее концентрация снижается.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1885; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.46.90 (0.012 с.) |

 где p1, p2- дипольные моменты взаимодействующих молекул. Сила ориентационного взаимодействия
где p1, p2- дипольные моменты взаимодействующих молекул. Сила ориентационного взаимодействия  убывает с расстоянием значительно быстрее, чем кулоновская сила взаимодействия заряженных частиц
убывает с расстоянием значительно быстрее, чем кулоновская сила взаимодействия заряженных частиц  .
.


 MgCO3
MgCO3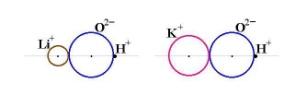 . Схема Косселя для LiOH и KOH
. Схема Косселя для LiOH и KOH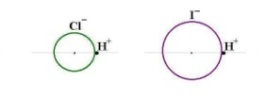
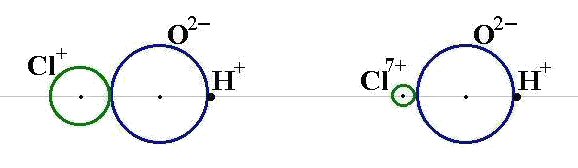
 ГЭ- химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии ОВР.
ГЭ- химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии ОВР. Гальваническая цепь представляет собой замкнутую систему, состоящую из внутренней и внешней цепи. Внутренняя цепь включает в себя два электрода (металлов, погруженных в р-ры электролитов), пространство между которыми разделено пористой перегородкой или солевым мостиком, не позволяющим р-рам электролитов смешиваться между собой. Внешняя цепь представляет собой металлический проводник, обеспечивающий прохождение электрического тока между электродами (во внешнюю цепь, как правило, включают гальванометр).
Гальваническая цепь представляет собой замкнутую систему, состоящую из внутренней и внешней цепи. Внутренняя цепь включает в себя два электрода (металлов, погруженных в р-ры электролитов), пространство между которыми разделено пористой перегородкой или солевым мостиком, не позволяющим р-рам электролитов смешиваться между собой. Внешняя цепь представляет собой металлический проводник, обеспечивающий прохождение электрического тока между электродами (во внешнюю цепь, как правило, включают гальванометр).
 R- газовая постоянная = 8,31 Дж\моль*К При ст.усл 298К
R- газовая постоянная = 8,31 Дж\моль*К При ст.усл 298К ; q=nF;
; q=nF;  ;
; 
 EГЭ>0
EГЭ>0 ;
;  ;
; 
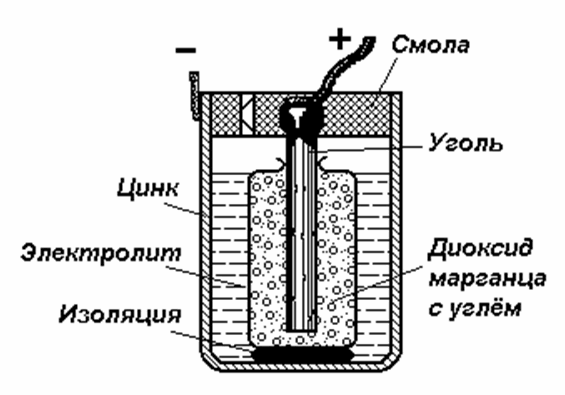
 В настоящее время самый распространенный. Его положительным электродом служит свинцовая решетка с ячейками, заполненными пастообразным пероксидом свинца PbO2. Отрицательный электрод немного тоньше, той же формы, а его ячейки заполнены пастой из губчатого свинца. Каждый элемент содержит множество таких пластин обоих видов. Группы чередующихся электродных пластин разделены изолирующими перегородками из дерева, стекла, пластмассы или резины. Вся сборка, погруженная в электролит (разбавленный раствор серной кислоты), представляет собой один гэ. Из нескольких элементов, соединенных последовательно, составляется батарея. ЭДС одного элемента равна 2В. Соединение свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1.26, а по мере разрядки опускается примерно до 1,0 (это объясняется тем, что серная кислота образует химические соединения с материалом пластин). При работе аккумулятора на его электродах идут процессы:
В настоящее время самый распространенный. Его положительным электродом служит свинцовая решетка с ячейками, заполненными пастообразным пероксидом свинца PbO2. Отрицательный электрод немного тоньше, той же формы, а его ячейки заполнены пастой из губчатого свинца. Каждый элемент содержит множество таких пластин обоих видов. Группы чередующихся электродных пластин разделены изолирующими перегородками из дерева, стекла, пластмассы или резины. Вся сборка, погруженная в электролит (разбавленный раствор серной кислоты), представляет собой один гэ. Из нескольких элементов, соединенных последовательно, составляется батарея. ЭДС одного элемента равна 2В. Соединение свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1.26, а по мере разрядки опускается примерно до 1,0 (это объясняется тем, что серная кислота образует химические соединения с материалом пластин). При работе аккумулятора на его электродах идут процессы:


