
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции. Закон действующих масс для необратимых реакций. Механизм химических процессов. Элементарная реакция. Молекулярность реакции, порядок химической реакции.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Под скоростью химической реакции подразумевают кол-во вещества, вступающего в р-ю или образующегося в процессе р-ии, в единицу времени в единице реакционного пространства. Гомогенные реакции – реакционное пространство – объем Vгомог = ±Dn\VDt = ±Dc\Dt n[моль\ м2*с], [моль\л*с]
Гетерогенные реакции Vгетерог = ± Dn\SDt = ± Dcs\Dt [моль\м2 * с], S – площадь поверхности соприкосновения в-в Скорость: средняя и мгновенная 1)Средняя Dc\Dt 2)Мгновенная dc\dt Vмгнов = lim(Dt®0) Dc\Dt = lim(Dt®0) Vcp = dc\dt Vt = ± (dc\dt)t Графики:
По механизму реакции подразделяются на: простые (протекают в одну стадию, ур-ие хим.р-ии отражает отражает механизм процесса.) и сложные (протекают в несколько стадий. Ур-ие хим.р-ии не отражает механизм процесса. Механизм процесса отражает совокупность элементарных (простых реакций). Лимитирующая стадия – самая медленная стадия в сложном процессе и скорость ее реакции определяет (лимитирует) скорость всего процесса. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью химической реакции. По числу молекул, одновременно участвующих в хим.превращении, простые р-ии делят на: мономолекулярные(H2O4→2NO2), бимолекулярные(NO+H2O→NO2+H2), тримолекулярные(2NO+CL2→2NOCL). Для того, чтобы частицы провзаимодействовали необходимо: встретиться, обладать достаточным кол-вом энергии, иметь благоприятную для взаимодействия ориентацию. Закон действующих масс: скорость простой (элементарной) реакции при постоянно температуре пропорциональна произведению концентраций реагентов, взятых в степенях их стехиометрических коэффициентов. Кинетическое ур-ие, матем.запись: aA+bB=cC+dD; (*1,2) V – скорость реакции, k- константа хим.р-ии. [А], [В] (СА, СВ) – молярные (моль\л) концентрации реагентов; a, b – кинетический порядок реакции по в-вам [А], [В] соответственно. Физический смысл k вытекает из (*1), при концентрациях реагентов Са=Св=1 моль\л- это удельная скорость реакции. Константа при постоянной температуре зависит только от природы веществ и не зависит от концентрации. Размерность константы определяется значением общего порядка химической реакции размерность скорости V (моль\л*с); концентрация С (моль\л). В зависимости от порядка простые реакции делятся на реакции нулевого, первого, второго, третьего, n-го порядков. В сложных реакциях порядок реакции по компонентам может принимать не только положительные и целочисленные, но и дробные, а так же отрицательные значения. Основной постулат кинетики. Кинетическое ур-ие сложной реакции aA+bB=cC+dD; V= 2N2О5=4NO2+O2; N2О5= N2О3+О2(медленная стадия); N2О5+ N2О3=4NO2(быстрая стадия) По суммарному ур-ию – эта р-я 2го порядка. На самом деле эта реакция первого порядка. Медленная стадия, определяющая скорость процесса является химической реакцией первого порядка. Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Энергия активации. Энергетическая схема протекания химической реакции. Эндотермические и экзотермические реакции. Уравнение Аррениуса. Катализ. Ингибирование. Энергия, которую необходимо сообщить частицам реагирующих веществ, чтобы превратить их в активные частицы, получила название энергии активации. На самом деле реакция идет через промежуточное, переходное состояние, получившее название активированный комплекс(АК).
Правило Вант-Гоффа: при увеличении температуры на 10˚ скорость простой реакции возрастает в 2-4 раза. Уравнение Аррениуса: k*A *exp (-Ea\RT) k- константа скорости химической р-ии; Еа – энергия активации; R –газовая постоянная = 8,31 Дж\моль*К; Т- температура в Кельвинах; А- предэкспоненциальный множитель. Расчет температурного коэффициента: VT\VT0 = kT\kT0 = gT-T0\10 lg kT\kT0 = lg gT-T0\10 = (T-T0\10) lg g lg g = (10 * lg kT\kT0)\ T-T0
Определение энергии активации: Tg j = - Ea\R k*A *exp (-Ea\RT) Ln k = ln A - Ea\RT Ea = (RT1 *T2) \ T1-T2 * ln k1\k2 = (2.3 *RT1*T2) \ T2-T1 * lg k2\k1 Еа велика – скорость реакции мала. Еа мала – скорость реакции велика. Влияние катализатора на скорость химической реакции: Катализатор – вещество, которое своим присутствием изменяет скорость химической реакции и остается химически неизмененным в конце процесса.(В.Оствальд, 1905г.) Изменяет механизм хим.р-ии. Реакция проходит через последовательность стадий с меньшими величинами Еа (снижается активационный барьер). Гомогенный катализ (катализатор и реагент образуют одну фазу): окисление SO2 в SO3. NO+1/2 O2 = NO2; SO2+NO2=SO3+NO; SO2(газ)+ 1\2 O2(газ) = SO3(газ) Гетерогенный катализ: SO2 gas +V2O5 tverd = SO3 gas +2 VO2 tverd 2VO2 tverd +1\2 O2 gas = V2O5 tverd SO2 gas +1\2 O2 gas = SO3 gas Ингибитор – вещество, которое замедляет протекание химической реакции. 25.Обратимые химические реакции. Закон действия масс для обратимых реакций. Константа равновесия. Энергетическая схема обратимой реакции. Влияние изменений внешних условий (концентрации, давления, температуры, катализатора) на положение химического равновесия. Принцип Ле-Шателье.
Закон действующих масс для обратимых реакций: aA+bB=cC+dD: v1=k[A]a[B]b, v2= k[C]c[D]d, при достижении равновесия V1=V2, k[A]a[B]b= k[C]c[D]d, Kp= Если участники реакции - газы, то константа равновесия может быть записана через величины равновесных парциальных давлений. Кр- отношение равновесных концентраций продуктов р-й и равновесных концентраций исх.в-в, возведенных в степени, равной их стехеомерических коэффициентов. Константа равновесия не зависит от концентрации реагентов и давления, а зависит только от температуры и природы в-ва. 1) Влияние концентрации: aA+bB=cC+dD; [A],[B],[C],[D] - равновестные концентрации При Т=const, Кр=const Увеличение концентрации ускоряет ту р-ю, которая использует эти в-ва. Увеличение концентрации исходных в-в смещает равновесие вправо. Увеличение концентрации продуктов р-ии смещает равновесие влево, в сторону исходных веществ. Система пытается ослабить внешнее воздействие. Новое равновесие характеризуется новыми значениями равновесных концентраций и величинами скоростей прямой и обратной хим.р-й, но постоянным значением константы равновесия (при Тconst!) При изменении концентрации: (Тconst) Кр остается неизменной, изменяются величины равновесных концентраций, величины скоростей прямой и обратной р-й. 2) Влияние температуры: aA+bB=cC+dD; Реакция экзотермическая Реацция эндотермическая эндотермическая Влияние температуры: при изменении температуры меняются все количественные хар-ки – Кр, величины равновесных концентраций, величины скоростей прямой и обратной р-й. 3) Влияние давления(для газовых): 2NO(г)+O2(г)=2NO2(г) V=k[NO]2[O2], V=k[NO2]2 (векторно V и k); V(пр)=V(обр); повысим давление в m раз: V=k(m[NO]2)(m[O2])=m3V, V=k(m[NO2])2=m2V, пусть m=2, тогда V(пр)=8V(обр), а V(пр)=4V(обр); следовательно, равновесие сместится вправо(в сторону ре-ии, происх с уменьш. числа молей парообр. веществ(уменьшением объемов)) aA+bB=cC+dD; Принцип Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия. На смещение хим равновесия влияет(в тетрадке рукой):
Влияет ли катализатор на положение химического равновесия? aA+bB=cC+dD; Kp= Катализатор не изменяет положения равновесия, но ускоряет его достижение. 26. Первый закон термодинамики. Энтальпия и внутренняя энергия. Стандартные условия. Стандартная энтальпия образования веществ. Первый закон термодинамики (закон сохранения энергии) – в любом процессе изменение внутренней энергии(DU) равно разности кол-ва теплоты Q, полученной системой из окружающей среды, и кол-вом работы А, произведенной над средой. DU = Q-А – макропроцесс; dU = dQ-dА- микропроцесс. а) Vconst (изохорный процесс) А = рDV (расширения) DU = Q-рDV,где рDV=0, поэтому DU = Q б) Pconst(изобарный процесс) DU = Q-рDV, Q = DU + рDV = D(U+pV); Q = DH; U+pV=H – ф-я состояния, энтальпия(Дж) в) Тconst; DH=0; Q=A (изотермический) г) Qconst; DU=-А (адиабатический) Энтальпия (тепловой эффект реакции): термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Не зависит от пути протекания р-ии, определяется только природой и физич-м сост-ем исходных в-в и конечных продуктов. (Р,V const). 1) Тепловой эффект прямой р-ии равен тепловому эффекту обратной с противоположным знаком. 2) Тепловой эффект р-ии равен сумме теплот образ-я продуктов р-ии за вычетом суммы теплот образования исходных в-в с учетом числа молей всех участвующих в р-ии в-в. (стехеометрич коэф) Для простых в-в =0. При 298К значение в таблице.
2) Для того, чтобы можно было рассчитать и сравнить тепловые эф. в основу термохим-х расчетов положены энтальпии образования, отношение к станд. усл-ям. (давление 1 атм или 0,1мПа, 298К, Сm = 1 М, DG<0; Е >0) Внутренняя энергия: это энергия всех видов движения микрочастиц, составляющих систему, а так же энергия их взаимодействия. Внутренняя энергия не включает в себя кинетическую и потенциальную энергию системы в целом. Включает в себя энергию химических связей и энергию межмолекулярных взаимодействий. Внутренняя энергия является ф-ей сост-я системы. (ее изменение не зависит от пути протекания процесса.) DU=U2 – U1 В химических реакциях всегда изменяется запас внутр. энергии и в результате происходит обмен с окруж.средой. Обмен энергией: в форме теплоты и в форме работы. Работа – форма передачи энергии в виде упорядоченного, организованного движения материи. Теплота – форма передачи энергии в форме беспорядочного,неорганизованного движения материи. Теплота и работа не являются видами энергии, это форма обмена энергией тс и окруж.средой, проявляются только в ходе процесса, являются функциями перехода.
Стандартные условия: давление 1 атмосфера(0.1 мПа), температура 298 К, единичные концентрации в-в. Стандартная энтальпия образования веществ(стандартная теплота образования)табл.вел.: тепловой эффект реакции образования одного моль данного сложного вещества из соответствующих простых веществ, устойчивых при стандартных условиях. Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеся выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален. Абсолютные значения энтальпии нельзя определить. 27. Закон Гесса и следствия из него. Тепловой эффект химических реакций и фазовых переходов. Расчет тепловых эффектов физико-химических процессов из стандартных теплот образования. Закон Гесса: тепловой эффект химической реакции, проводимой при Рconst или Vconst не зависит от пути проведения процесса, а определяется только природой и физическим состоянием исходных веществ и продуктов реакции. Следствие закона Гесса: тепловой эффект химической реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции. Тепловой эффект химической реакции равен разности суммы теплот образования (энтальпий образования) продуктов реакции и суммы теплот образования (энтальпий образования) исходных веществ. Теплота образования сложных веществ (энтальпия образования) понимается тепловой эффект химической реакции образования одного моля сложного вещества из простых. Теплота образования простого вещества равна 0. Помним, что Q= -DН. С целью расчета тепловых эффектов реакций, данные о которых отсутствуют в справочниках и не могут быть экспериментально измерены, выстраивают циклы из термохимических уравнений с известными тепловыми эффектами. Термохимические уравнения можно комбинировать, применяя к ним любые арифметические действия. Направление и пределы самопроизвольного протекания физико-химических процессов: Все процессы делятся на самопроизвольные и несамопроизвольные. Самопроизвольные процессы протекают без затрат энергии извне, система способна совершать работу, если в прямом направлении процесс протекает как произвольный, то в обратном направлении самопроизвольно процесс идти не может. События происходят в направлении их большей вероятности, т.е. того состояния, которое может быть реализовано большим числом способов. Энтропия. Термодинамическая вероятность. Уравнение Больцмана. Энтропия, как функция температуры, давления, объема, фазового состояния вещества, строения молекул. Изменение энтропии при химических и фазовых превращениях. По з-ну сохр-я энергии, система может самопроизвольно совершать работу только за счет собств. энергии, т е DU<0. (внутр энергия уменьшается) Энтропия(S) – ф-я состояния системы,физич св-во в-ва, по знаку которой можно определять ход р-ии, мера упорядоченности системы. S = klnW [Дж\К]-ур-ие Больцмана, где k- постоянная Больцмана(газ.пост), k = R\N = 8.31:6.02 *1023 Дж\К W – термодинамическая вероятность сост-я системы. Число не повторяющихся микросостояний, в кот. Реализуется данное макросостояние. Чем больше W,тем сост-е более вероятно. При переходе из более упорядоченной системы в менее упорядоченную энтропия увеличивается. (газ>>жидк.>>тв.) Энтропия имеет абсолютное значение, есть 0. По 2 з-ну т.д, в изолированной системе самопроизвольно идут те процессы, которые ведут к росту энтропии. Самопроизвольные процессы такие, при которых не требуется энергия извне, при этом система способна совершать работу. Если в прямом направлении процесс идет смопроизвольно, то в обратном он таким быть не может. По 3 з-ну, абсолютный 0 недостижим. DS = Sn1S° прод - Sn2S° ис.в-в с учетом стехиометрических коэф., n-число молей соотв. в-в. S° простых в-в не равна 0! DS процесса не зависит от пути протекания процесса, а определяется нач. и кон. сост-ем. По Планку, если Т=0К, то DS идеального газа = 0. Энтропия индивидуального кристаллич.в-ва при абсолютном нуле температур = 0. Если агрегат сост-е не изменяется, то смотрим моли. Энтропия растет в процессах, сопровождающихся увеличением беспорядка, ростом числа частиц, а также в иных процессах, способствующих увеличению термодинамической вероятности системы. Энтропия растет: с ростом температуры, ростом объема системы, в процессах расширения газа, при фазовых переходах плавление – испарение, при растворении, при диссоциации электролита, усложнения в строении частицы. При увеличении давления энтропия уменьшается.
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 3691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.123.41 (0.013 с.) |

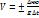 . Химические реакции: гомогенные (исх. В-ва и продукты р-ии находятсяв одинаковом агрегатном сост-ии (в одной фазе) и гетерогенные (исх.в-ва и продукты р-ии находятся в разных агрегатных состояниях(в разных фазах).
. Химические реакции: гомогенные (исх. В-ва и продукты р-ии находятсяв одинаковом агрегатном сост-ии (в одной фазе) и гетерогенные (исх.в-ва и продукты р-ии находятся в разных агрегатных состояниях(в разных фазах).
 ;
;  * [B
* [B 
 m и n – небольшие целые или дробные числа, определяются опытным путем(не совпадают с коэф.в ур-ии). Несовпадение экспериментально полученных порядков химической реакции с величинами стехиометрических коэффициентов является признаком того, что реакция является сложной.
m и n – небольшие целые или дробные числа, определяются опытным путем(не совпадают с коэф.в ур-ии). Несовпадение экспериментально полученных порядков химической реакции с величинами стехиометрических коэффициентов является признаком того, что реакция является сложной.
 АК – некоторое промежуточное состояние, представляющее собой группировку атомов взаимодействующих веществ, в которой старые связи ослабевают, а новые образуются. АК обладает повышенным запасом энергии, неустойчив, время жизни невелико. Энергия активации – эта такая энергия, которую нужно сообщить частицам, чтобы они могли образовать АК. Энергия АК должна быть соизмерима по величине суммарной энергии химический связей реагирующих в-в.
АК – некоторое промежуточное состояние, представляющее собой группировку атомов взаимодействующих веществ, в которой старые связи ослабевают, а новые образуются. АК обладает повышенным запасом энергии, неустойчив, время жизни невелико. Энергия активации – эта такая энергия, которую нужно сообщить частицам, чтобы они могли образовать АК. Энергия АК должна быть соизмерима по величине суммарной энергии химический связей реагирующих в-в.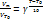 ;
; 
 Предэкспоненциальный множитель (А): пропорционален общему числу соударений, зависит от свойств соударяющихся частиц(от массы, размеров), пропорционален доле частиц, имеющих благоприятную для протекания химической реакции ориентацию. Графич определение Еа: Ea и a находят из графика в арренниусовских координатах (ln k-1\T)
Предэкспоненциальный множитель (А): пропорционален общему числу соударений, зависит от свойств соударяющихся частиц(от массы, размеров), пропорционален доле частиц, имеющих благоприятную для протекания химической реакции ориентацию. Графич определение Еа: Ea и a находят из графика в арренниусовских координатах (ln k-1\T) Химическое равновесие – динамическое равновесие. Это означает, что оно устанавливается при выравнивании скоростей прямого и обратного процсса, а при измен-ии внеш.усл-й будет смещаться и устанавливаться вновь.(Vпрям=Vобр, не равно 0, подвижное, движение с 2х сторон DG=0 мин значение энергии Гиббса). Необратимые реакции – это разновидность обратимых р-й с сильно смещенным равновесием в сторону образования продуктов р-ии.
Химическое равновесие – динамическое равновесие. Это означает, что оно устанавливается при выравнивании скоростей прямого и обратного процсса, а при измен-ии внеш.усл-й будет смещаться и устанавливаться вновь.(Vпрям=Vобр, не равно 0, подвижное, движение с 2х сторон DG=0 мин значение энергии Гиббса). Необратимые реакции – это разновидность обратимых р-й с сильно смещенным равновесием в сторону образования продуктов р-ии.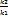 =
=  ;
; , где Кр-константа равновесия.
, где Кр-константа равновесия.
 ; Kp=
; Kp=  ;
; ; Рост температуры означает снижение КР, что означает уменьшение конц. продуктов реакции и одновременный рост конц. исх. веществ, равновесие смещается влево;
; Рост температуры означает снижение КР, что означает уменьшение конц. продуктов реакции и одновременный рост конц. исх. веществ, равновесие смещается влево; ; Рост температуры означает рост Кр, что означает увеличение конц. продуктов и одновременное уменьш. конц.исх. вещ-в, равновесие смещается вправо.
; Рост температуры означает рост Кр, что означает увеличение конц. продуктов и одновременное уменьш. конц.исх. вещ-в, равновесие смещается вправо.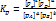 ; pi=xiP;;
; pi=xiP;;  ;
;  c+d-a-b; если Т-const; Кр=const; давление не влияет на положение равновесия, система пытается остабить эффект внешнего воздействия.
c+d-a-b; если Т-const; Кр=const; давление не влияет на положение равновесия, система пытается остабить эффект внешнего воздействия.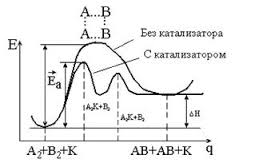

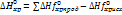




 .
.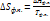 -изменение энтропии при фазовых переходах
-изменение энтропии при фазовых переходах =88+- 4 - правило Трутона
=88+- 4 - правило Трутона


