
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая кинетика и катализСодержание книги
Поиск на нашем сайте Химическая кинетика занимается исследованием механизмов реакций и течения их во времени. Скорости биохимических реакций сбалансированы, за счет чего обеспечивается стационарное состояние организма. С одной стороны, изменение скорости какой-либо реакции, обусловленное воздействием факторов окружающей среды или особенностями развития организма, может быть причиной развития патологии. С другой стороны, при воздействии неблагоприятных факторов изменение скоростей реакций лежит в основе защитной и компенсаторной функций организма. Физиотерапевтические методы лечения основаны на изменении условий протекания реакций (локальное понижение/ повышение температуры), а фармакотерапевтические методы – на введении веществ, влияющих на скорость реакции. Механизм реакции – последовательность и характер стадий химических реакций. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Все биохимические реакции – сложные. Сложные реакции подразделяются на параллельные, последовательные, сопряженные и цепные. Химические реакции многообразны и протекают с разной скоростью. Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени в определённом объёме или на определённой поверхности. (Концентрация - содержание вещества в единице объёма). Если реакция протекает идеально, то для оценки скорости достаточно пользоваться понятием средняя скорость. В этом случае рассматривают изменение концентрации вещества за некоторый промежуток времени и относят это изменение к единице времени V = ±(c2-c1)/(τ2-τ1)=±Δc/Δτ. Важно знать, по какому веществу оценивается скорость реакции. Если это исходное вещество, то концентрация его убывает V= - Δc/Δτ. Если контроль ведут по продукту реакции, то концентрация его возрастает V= + Δc/Δτ. Однако в химической кинетике принят и другой способ оценки скорости химической реакции. Рассматривают характер графика c = f(τ) и скорость определяют по тангенсу угла наклона прямой к оси времени, т.е. Δс/Δτ = tg α (рис1). Если реакция протекает сложно, то для оценки протекания химического процесса пользуются понятием истинная скорость химической реакции. Её можно определить математически и графически. Истинная скорость – это скорость реакции в данный момент времени. Причём в разные моменты она разная. Чем меньше рассматриваемый промежуток времени, тем точнее определяется скорость химической реакции. Размерность скорости, моль/л с. Математическое соотношение между скоростью и концентрацией называется кинетическим уравнением. Математическое выражение скорости представляет собой производную концентрации во времени: Vист=± dc/dτ. В этом случае концентрация контролируемого вещества вполне определённа и её выражают в моль/л.
Рис. 1. Изменение во времени t концентрации Сн реагирующего вещества: а—к понятию о средней скорости реакции; б —к понятию об истинной скорости реакции Скорость реакции зависит от многих факторов: концентрации, природы и дисперсности реагентов, температуры, катализатора, рН среды и др. Рассмотрим влияние этих параметров на скорость реакции. Молекулы могут взаимодействовать лишь при столкновении. Чем чаще эти столкновения, тем быстрее пойдет реакция. Из этого следует, что для увеличения числа вероятных столкновений необходимо в данной системе увеличить количество молей реагирующих веществ, т. е. увеличить их концентрации. Чем больше столкновений произойдет между молекулами в единицу времени, тем больше будет скорость реакции, значит, количество столкновений зависит от числа молекул в единице объема, т. е. от молярной концентрации веществ. Влияние концентрации на скорость химической реакции выражается закономдействующихмасс (К. Гульдберг и П. Вааге): при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Так как скорость реакции А + В → D пропорциональна произведению концентраций веществ CА и CВ, то можно записать v = k CАCВ, где k — коэффициент пропорциональности, позволяющий учитывать различие между единицами измерения скорости и концентрации. В то же время коэффициент k, или константа скорости, указывает долю столкновений, которые приводят к осуществлению реакции. Если принять, что CА = CВ = 1 моль/л, тогда V=k. Поэтому константа скорости — это скорость реакции при концентрациях реагирующих веществ, равных единице. Если в реакцию вступает п молекул вещества А и т молекул вещества В nА + mB=gD, то коэффициенты п и т являются показателем степеней для концентраций соответствующих молекул и тогда закон действующих масс можно записать v=k CА n CВ m. Константа скорости k не зависит от концентраций веществ. Закон действующих масс применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют и твердые вещества, концентрация которых постоянна, то скорость реакции изменяется только в зависимости от концентраций газов или растворенных веществ. Молекулярность и порядок реакций. Число молекул, участвующих в элементарном акте химического взаимодействия, определяет молекулярность реакции. По этому признаку различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Реакции с молекулярностью больше трех практически не встречаются, так как вероятность столкновения даже трех молекул уже очень мала. Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс. Так, реакция СuО(к) + Н2(г) = Сu(к) + Н2О (г)относится к реакциям первого порядка, так как уравнение закона действующих масс запишется следующим образом: v=kC(H2), а реакция H2+ I2 = 2HI относится к реакциям второго порядка, так как уравнение закона действующих масс имеет вид v =kC(H2)C(I2). Молекулярность реакции - этомолекулярно-кинетическая характеристика системы, а порядок реакции определяет зависимость скорости от концентрации. Если при многостадийном процессе уравнение реакции отражает лишь исходное: и конечное состояние системы, не раскрывая механиз м процесса, то порядок реакции не совпадает сеемолекулярностью. Так, разложение N2O5 происходит согласно стехиометрическому уравнению 2N2O5=4NO2+O2, где для соблюдения баланса масс необходимо иметь две молекулы исходного соединения. Но экспериментально подтверждено, что данная реакция имеет первый порядок. На основании этого можно представить следующие стадии реакции: N2O5=N2O3+O2 N2O3 + N2O5=4NO2 При этом скорость реакции в первой стадии значительно меньше, чем во второй. Молекулярность реакции не совпадает с порядком и в тех случаях, когда разница между концентрациями реагирующих веществ весьма велика (например, гидролиз сахарозы в присутствии воды). Встречаются также реакции нулевого порядка (например, разложение аммиака на поверхности вольфрама), когда скорость не зависит от концентрации вещества в объеме, а также реакции дробного порядка (многостадийные процессы, где самые медленные стадии имеют разный порядок, однако их скорости соизмеримы). Поэтому нулевой или дробной молекулярности быть не может, так как эта характеристика относится к механизму реакции, а не к выражающему ее уравнению. Необратимые реакции 1-го порядка (мономолекулярные) К этим реакциям относятся реакции изомеризации, термического разложения веществ, радиоактивного распада атомных ядер. Примеры: СН3OСH3→ СН4 + H2 + СО; СН3N2СН3→ C2H6 + N2. Дифференциальное уравнение скорости необратимой реакции I порядка, которая в общем виде может быть записана АВ, имеет вид:
После интегрирования получается выражение для константы скорости реакции I порядка:
k = 2,3/ lg(Cн / Ск) а – начальное количество моль вещества А, х – прореагировало моль за время. k – константа скорости, 1/с, Сн – начальная концентрация реагента моль/л, Ск – конечная концентрация реагента в момент времени. Время, в течение которого прореагировала половина начального количества вещества, т.е. х = Для реакции первого порядка: τ1/2 = следовательно, для необратимой реакции первого порядка время полураспада не зависит от начальной концентрации вещества. Период превращения не зависит от начальной концентрации вещества. Величина 1/2 используется в радиоизотопных лабораториях для диагностики и лечения различных заболеваний, а также при исследовании действия лекарственных средств и их сохранности. Подавляющее большинство реакций являются сложными. Это реакции, состоящие из ряда последовательных взаимосвязанных простых реакций. Скорость сложной реакции определяется скорость. Самой медленной простой реакции. Зависимость скорости реакции от температуры. Энергия активации. Скорость химических реакций, как правило, при повышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом. При 20 °С скорость реакции практически равна 0 и понадобилось бы 54 млрд. лет, чтобы взаимодействие прошло на 15 %. При 500 °С для образования воды потребуется 50 мин, а при 700 °С реакция протекает мгновенно. Зависимость скорости рекции от температуры выражается в приближенной форме правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается примерно в 2 — 4 раза. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом реакции γ, т. е. выражается отношением константы скорости при температуре t + 100 к константе при температуре t: γ (Δt/10)=kt+10/kt Если кинетическая энергия сталкивающихся молекул достаточна для разрыва связей, то столкновение молекул приводит к перестройке молекул исходных веществ и образованию новых молекул. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число таких молекул возрастает, поэтому скорость реакции тоже должна увеличиваться. Правило вант-Гоффа не применимо для реакций в живом организме. Для этого используют уравнение Аррениуса. ln k = - (Ea/RT) + C (или k = Aexp(-Ea/RT). В этом уравнении константа скорости k связана с экспоненциальным выражением exp(-Ea/RT). Символ еxp означает основание натуральных логарифмов; R- универсальная газовая постоянная; Т — температура по шкале Кельвина; Еа — энергия активации, которая обычно предполагается постоянной величиной, не зависящей от температуры; А — коэффициент пропорциональности, иначе называется частотным множителем. Он указывает долю числа столкновений между молекулами, которая оканчивается реакцией. Из уравнения Аррениуса следует, что правило Вант-Гоффа может выполняться для тех реакций, энергия активации которых лежит в пределах 84—170 кДж/моль. Современные исследования показали, что этот интервал значительно больше и находится в пределах 40 – 400 кДж/моль.
Чтобы понять, как применяется понятие энергии активациик конкретным химическим реакциям, рассмотрим реакцию взаимодействия водорода с йодом. В реакцию могут вступать только те молекулы, которые обладают повышенной энергией, позволяющей преодолеть активационный барьер. В реакции Н2 с I2 должны разорваться связи в Н •• Н и I •• I для образования HI. В определенный момент времени при сближении активных молекул, обладающих достаточной энергией для преодолениявзаимного отталкивания электронных облаков, возникает переходное состояние системы, отвечающее образованию промежуточного соединения, называемого активированным комплексом. Переходное состояние характеризуется тем, что промежуточный продукт имеет сходство как с начальными продуктами реакции, так и с конечными; связи между атомами в молекуле водорода еще не разорвались, а уже начала формироваться связь Н—I:
Координата реакции Рис.2. Диаграмма потенциальной энергии (кДж/моль) Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ΔН: ΔН = Е'А-Е"А. Энергия активированного комплекса обычно выше энергии начального и конечного состояний системы. Можно сказать, что энергия активации — это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. Из рис. 2 видно, что затраченная на активацию молекул энергия выделяется полностью или частично при образовании продуктов реакции. Если при этом энергии выделится больше, чем это необходимо для активации молекул, то реакция экзотермическая, если меньше - то эндотермическая. Катализ Скорость химических реакций может возрастать не только при увеличении концентрации реагирующих веществ или температуры системы, но и под влиянием катализаторов. Вещества, которые увеличивают скорость химической реакции, оставаясь в конечном итоге неизменными по химическому составу и количеству, называют катализаторами. Процесс увеличения скорости реакции с помощью катализатора называется катализом, а реакции, в которых скорость изменяется в результате введения в реакционную смесь катализаторов, называются каталитическими. Особенности катализаторов: · Ускоряют реакцию, присутствуя в очень малых количествах · Избирательность действия, то есть катализатор ускоряет одну реакцию и неэффективен для другой. Особенно это свойство проявляется у биологических катализаторов-ферментов · Неизменность после реакции и возможность многократного использования · Катализатор изменяет механизм реакции и направляет ее по такому пути, который характеризуется понижением энергии активации. В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, различают гомогенный и гетерогенный катализ. Гомогенными катализаторами обычно могут быть растворы кислот, оснований, солей (прежде всего d-элементов— Сr, Mn, Fe, Со, Ni и др.). Примером гомогенного катализа может служить каталитическое разложение пероксида водорода в водном растворе на воду и кислород в присутствии ионов Cr2O72-, WO42-, МоО42-. При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах и разделены между собой поверхностью раздела (в качестве примера можно привести окисление SO2, до SO3 в присутствии катализатора, находящегося в твердой фазе). Катализаторы отличаются избирательностью, что зависит не только от природы катализатора, но условий его применения. Механизм действия катализатора различен. Наиболее часто встречается катализ, при котором катализатор ускоряет скорость взаимодействия за счет образования промежуточных соединений. При взаимодействии этих продуктов высвобождается катализатор, количество которого остается неизменным. Процесс образования промежуточных соединений с участием катализаторов является примером гомогенного катализа. В общем виде процесс выглядит следующим образом: А+В К АВ. Из-за высокой энергии активации скорость реакции вещества А с В без катализатора ничтожно мала. Допустим, что катализатор легче реагирует с веществом А, чем исходные А и В между собой: A + K = AK Возможность такого взаимодействия можно объяснить более низкой энергией активации при образовании АК. Промежуточный продукт АК, в свою очередь, легко реагирует с веществом В из-за иной природы веществ и малой энергии активации: AK + B = AB + K. Таким образом, роль катализатора сводится к снижению энергии активации. Биохимические реакции в растениях и животном организме ускоряются биологическими катализаторами, называемыми ферментами (энзимами). Они представляют собой либо высокомолекулярные белки, либо сочетание белков с соединениями небелковой природы. Каждый фермент характеризуется высокой избирательностью по отношению к каждому конкретному процессу. Если учесть, что в организме человека протекает более 10 000 различных биохимических процессов, то понятно, насколько велика роль ферментов. Например, окисление сахара в организме протекает примерно в 106 раз быстрее, чем при той же температуре в водном растворе под влиянием кислорода. В сложной цепи биохимических процессов окисления сахара в организме участвует несколько ферментов, каждый из которых катализирует отдельную стадию. Катализом называют явления изменения скорости реакции или возбуждение, происходящее под действием некоторых веществ, называемых «катализаторами», которые, участвуя в процессе, сами в конце реакции остаются химически неизменными.
Различают катализ гомогенны й (катализатор находится в той же фазе, что и реагирующие вещества; 2) гетерогенный катализатор и реагирующие молекулы находятся в разных фазах. Реакции, которые каталитически ускоряются продуктами, называются автокаталитическими. Положительный катализ: катализатор ускоряет реакцию. Отрицательный катализ: катализатор замедляет реакцию. Для изменения скорости реакции требуется иногда ничтожное количество катализатора. Пример: для заметного изменения скорости окисления сернокислого натрия в водном растворе достаточно 10-13 моль-экв катализатора (сернокислой меди) на литр раствора. Понятием "катализ" объединяются явления, иногда сильно различающиеся по механизму действия катализаторов. Так, в цепных реакциях положительные катализаторы могут заметно облегчать возникновение цепей, (например, действие паров металлического натрия на смесь хлора с водородом). В других реакциях катализатор образует с реагирующими веществами промежуточные соединения, так называемый активный комплекс, -с меньшей энергией активации. Различные катализаторы могут образовывать с одними и теми жевеществами как однотипно, так и различно построенные активные комплексы. В последнем случае, разница в конфигурациях активного комплекса может привести, к изменению направления процесса, и из одних и тех же исходных веществ могут образоваться различные продукты. Свойство катализаторов изменять направление процесса называется селективностью. Химическое состояние катализатора после реакции и его количество не изменяются. Физическое же состояние может существенно измениться. Крупнокристаллическая двуокись МnO2, катализирующая распад бертолетовой соли, после реакции превращается в мелкий, кристаллический порошок. Известно, что после длительного контактирования существенно изменяетсясостояние поверхностных слоев твердого катализатора. Катализатор лишь ускоряет (или замедляет) процесс, но не способен смещать положение равновесия. Катализатор не может вызвать термодинамически невозможный процесс, так как катализатор входит лишь в состав промежуточного соединения, а термодинамическая возможность процесса определяется разностью уровней свободной энергии конечного и начального состояний. Химический процесс и в присутствии катализатора идет в направлении минимума свободной энергии в системе, только с большой скоростью. Катализатор снижает энергию активации процесса.
К гомогенно-каталитическим реакциям в жидкой фазе относятся ускоряющиеся под действием водородных ионов реакции этерификации и гидролиза сложных эфиров, инверсии сахаров, полимеризации олефинов в жидкой фазе и др. Роль катализатора сводится к снижению энергии активации процесса и, следовательно, к ускорению процесс. Пусть, например, бимолекулярная реакция в отсутствие катализатора протекает по схеме: A+B→AB* (активированный комплекс)→ продукты В присутствии катализатора К, который принимает участие в образовании активного комплекса: А + В + К → АВК*→К + продукты, Е1-Е2= ∆Е - снижение энергии активации Е в присутствии катализатора (рис.1).
Основные положения гомогенного катализа (по Шпитальскому, 1926 г.): 1. Катализатор является таким веществом, которое переводит реагирующее вещество реакционно-способное состояние, представляющее собой неустойчивый активный комплекс. 2.Образование промежуточного соединения является обратим и относительно быстрым процессом. 3. Неустойчивый активный комплекс относительно медленно распадается с образованием продуктов реакции и с регенерацией катализатора. 4. Общая скорость процесса пропорциональна концентрации активного комплекса.
Гетерогенный катализ Два типа гетерогенного катализа: катализатор находится в твердой фазе, а реагирующие вещества:1) в газовой, 2) в жидкости. Реакция, как правило, происходит на границе раздела фаз, т.е. на поверхности катализатора. Гетерогенный процесс можно разделить, на три стадии: I)транспорт реагирующих веществ к поверхности катализатора (диффузия); 2) реакция на поверхности катализатора; 3) десорбция продуктов реакции с освобождением поверхности катализатора. Для сравнительной оценки активности катализаторов определяющей является скорость реакции на поверхности. Поэтому, в тех случаях, когда важно получить сравнение активностей катализатора, стараются процесс вести таким образом, чтобы скорость его определялась второй, так называемой кинетической стадией. Характерные черты гетерогенных каталитических процессов. · Сродство реагирующих веществ к катализатору. Это положение подтверждается на опыте. Например, гидрогенизационные и дегидрогенизационные катализаторы Pt, Ni, Cu. легко образуют с водородом поверхностные соединения хемосорбционного типа: Pt-H, Ni-H, Cu-H. Гидратирующие и дегидратирующие катализаторы, например, А12O3 или Al2(SO4)3, обладают способностью образовывать с водой соединения гидратного типа, их действие в реакции дегидратации спиртов аналогично действию серной кислоты (типичного водоотнимающего средства). Окислительные катализаторы - Pt, Cu, Pd образуют с кислородом сорбционные поверхностные соединения типа. Cu легко восстанавливается до металлической меди и до СuО. Таким образом, сродство катализатора к реагирующим веществам обеспечивает образование промежуточного соединения, которое часто имеет неустойчивый характер и легко распадается на конечные продукты с регенерацией катализатора. 2) Избирательное действие катализатора, т.е. для одних и тех же исходных веществ различные катализаторы способны вызывать разные процессы, - приводящие к образованию различных конечных продуктов
С2Н5ОН С2Н4 + Н20 С2Н5ОН СН3СHO + H2 2С2Н5ОН CH2=CH-CH=CH2 + H2 + 2H2O 2С2Н5ОН C4H9OH + H2O бутиловый спирт · Смешанные катализаторы. Для придания большей избирательности, повышения активности, термической стойкости, механической прочности применяют катализаторы в виде сложных многокомпонентных систем. Их три типа: смешанные, на носителях и промотированные. Смешанные катализаторы, как правило, смесь нескольких оксидов: Al2O3 + ThO2, Al2O3 +Cr2O3, CoO + MgO. Активность их часто является функцией состава. 4) Отравление катализатора. Присутствие, в реагирующей смеси некоторых веществ, часто в ничтожном количестве, способно поймать или полностью подавлять активность катализаторов. Такие вещества, называются каталитическими ядами. Типичными каталитическими ядами некоторых катализаторов гидрирования (Ni, РЬ)являются соединения серы (H2S, CS2, меркаптаны и т.д.), HCN, CO, галогены, Hgи ее соли, соединения Pb, Ag, Sb в количествах (моль/л): HCN (1/107), НgС12 (1/(2·106), Аs2O3 (1/50). Отравление катализатора в большинстве случаев происходит в результате адсорбции яда на поверхности. Различают обратимое отравление и необратимое отравление (соответственно обратимой и необратимой адсорбции). Поэтому катализаторы тщательно предохраняют от отравления и предъявляют специальные требования к аппаратуре: и очистке исходных веществ. 5) Промотирование катализатора. Активность катализатора часто увеличивается при добавлении к нему вещества, не обладающего каталитическими свойствами. Такие вещества называются промоторами. Например, катализатором реакции СО + 3Н2→ СН4 + Н2О является никель. В отсутствие промоторов на одном чистом катализаторе мера скорости реакции 35 единиц: Ni + 1% Cr2O3 – мера скорости реакции 300 ед. Ni + 4% Cr2O3 - ”“ 620 ед. Ni + 10% Cr2O3 - ”“ 600 ед. Есть определённый предел добавки: просмотра, после которого его действие ослабляется и может даже привести к отравлению катализатора. 6. Активация в гетерогенных каталитических реакциях. Образующееся в ходе реакций промежуточное соединение адсорбируется на поверхностикатализатора. При этом происходит ослабление связей, способствующее их перераспределению и образованию конечных продуктов при меньшей суммарной затрате энергии. В большинстве случаев для константы скорости гетерогенной каталитической реакции справедливо уравнение Аррениуса: k = Z exp(-E/RT)
Сравним скорости некаталитической и каталитической реакций, для чего возьмем отношение констант скоростей этих реакций
Опыт показывает, что∆Е>О, в результате чего осуществляется ускорение каталитического процесса по сравнению с некаталитическим. Например: А+В→АВ*→продукты (в отсутствие катализатора). В присутствии катализатора процесс протекает через ряд стадий: 1) адсорбция на поверхности катализатора А + В + К →АВКадс 2) перевод адсорбционного состояния в активный комплекс АВКадс→ АВК* 3) АВК*→ (продукты)адсК 4) (продукты)адсК→ К + продукты
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.33 (0.011 с.) |


 .
.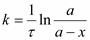 или
или , называется временем полураспада и обозначается τ1/2.
, называется временем полураспада и обозначается τ1/2. ,
,





