
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. Расчет водородного показателя рН растворов сильных и слабых кислот и оснований.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вода-очень слабый амфотерный электролит, при ее диссоциации образуется одинаковое число ионов Н+ и ОН-, согласно уравнению: Н2О⇄Н+ + ОН- Kd = [H+][OH-] / [H2O]~const=1,6*10-16 [H2O]=Сm=m\MV=1000\18*1= 55.6M [H+][OH-] / 55.6=1,6*10-16= > Kw=[H+][OH-]=10-14(при Т=298К) Kd [H2O] = [H+][OH-] = Kw - ионное произведение воды.Kw = const (при T = const) Нейтр. р-р: [H+][OH-] = 10^-14 [H+] = [OH-] = 10^-7 Кислый р-р: [H+] > [OH-] [H+] = 10^-6, 10^-5, Щелочн. р-р: [H+] < [OH-] [H+] = 10^-8, 10^-9, … pH = - Lg [H+] – водородный показатель; pOH= - lg[OH-] - гидроксильный показатель. У сильных электролитов: a=1, [H+]=aСm=1*Cm [OH-]=aСm=1*Cm У слабых электролитов: a¹1, [H+]=aСm = (корень из (Кд\Сm))*Cm= корень из (Кд*Сm) [OH-]=aСm = (корень из (Кд\Сm))*Cm= корень из (Кд*Сm) 36. Зависимость степени диссоциации слабых электролитов от концентрации растворов. Закон разбавления Оствальда(вывод). Рассматривая зависимость степени диссоциации от концентрации слабого электролита (рис. 6), мы обнаруживаем, что повышение концентрации ведет к снижению степени диссоциации, а разбавление раствора, наоборот, к ее повышению.
Рис. 6. Зависимость степени диссоциации α от концентрации слабого электролита в растворе с0.
При бесконечном разбавлении (когда концентрация электролита стремится к 0) степень диссоциации стремится к 1. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.Однако в случае слабых электролитов величина (1 – α) очень мало отличается NCN «H+ + CN- ; [H+]=[CN-]= aCm
Кд = [CN-]*[H+]\ [HCN] = (aCm*aCm)\(Cm-aCm)= (a2* Cm2)\ Cm(1-a)= a2 Cm\1-a К=a2 Cm\1-a; a= (корень из (Кд\Сm) ВОПРОС 37. А) Растворимость веществ. Коэффициент растворимости Б) Ионное равновесие в системе раствор ↔ осадок. Произведение растворимости. В) Молярная растворимость. Связь между молярной растворимостью малорастворимых веществ и произведением растворимости. Г) Влияние посторонних веществ на растворимость. Эффект общего иона. А) Растворимостью вещества называют его способность растворяться в том или ином растворителе. Растворимость определяется концентрацией насыщенного раствора. Коэффициент растворимости равен максимальной массе вещества (в г), которое можно растворить в данных условиях в 100 г растворителя, чтобы получить насыщенный при данных условиях раствор. В случае газов растворимость часто задают в кубических сантиметрах (или граммах) на 1 дм3: см3/дм3 или г/дм3. K= Б)Ионное равновесие в системе раствор ↔ осадок.
Произведение растворимости - произведение конц. ионов малорастворимого электролита в насыщенном растворе, взятых в степенях равных стехиометрическим коэффициентам в уравнение электролитической диссоциации. Обладает свойствами Кр. Табличная величина. Молярная растворимость(S) – это молярная концентрация электролита в насыщенном растворе. Связь м/у ПР и молярной растворимости в насыщ. ра-ре: Ca3(PO4)2↔3Ca2++2PO43-; Sm 3Sm 2Sm ПР(Ca3(PO4)2)=[ Ca2+]3 * [PO43-]2=[3S]3*[2S]2=108S5 В)Молярная растворимость(S) – это молярная концентрация электролита в насыщенном растворе. Sm= Растворимость вещ-ва мб охарактеризована: 1)величиной любой из концентраций насыщенного раствора; 2) массовой долей растворенного вещ-ва 3)молярной конц(моляр. растворимость) 4)Нормальной конц. ра-ра; 5)ПР(для малорастворимых). Г)Эффект общего иона: AgCl↔Ag++Cl-; NaCl→Na++Cl-; Снижение растворимости малорастворимого электролита в присутствии другого электролита, имеющего с первым общий ион, получило названия эффекта общего иона. Механизмом реакции ионного обмена в случае, когда малорастворимый электролит входит в состав исх. веществ и продуктов реакции: AgCl+KBr↔AgBr↓+KCl AgCl↓+Br-↔AgBr↓+Cl- Побеждает "сильнейший", т.е. тот, который образует более прочное соединение с катионом Ag+. ВОПРОС 38. А)Гидролиз солей. Степень гидролиза и константа гидролиза. Б)Расчет водородного показателя(рН) растворов гидролизирующихся солей. Причина диссоциации - взаимодействие с полярной молекулой растворителя. А) Гидролиз солей – это реакция обмена м/у солью и водой. 1) Сопровождается образованием слабого электролита(сл. кис-ты или основания); 2)Изменением рН; 3)Гидролиз – обратимый процесс, т.е. идет до установления хим. равновесия; 4)Реакция гидролиза является обратной реакции нейтрализации; 5) Гидролизу подвергаются только соли, образованные: сл. осн.+ сильн. кис-той; сл. кис. + сил. осн; сл. кис + сл. осн. Количественными оценками способности соли подвергаться гидролизу являются степень гидролиза и константа гидролиза (Кг). Степень гидролиза показывает, какая часть соли, содержащаяся в растворе (СМ), подверглась гидролизу (СМгид). Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кг, тем сильнее соль подвергается гидролизу. Кг не табличная величина. Вывод константы гидролиза: Кр= Кгимеет свое выражение для каждого случая гидролиза а) Слабая кислота + сильное основание=соль KCN+HOH↔KOH+HCN, K++ CN-+H2O↔K++ OH-+HCN, CN-+H2O↔OH-+HCN(CN—-по аниону; рН>7) KГ= Кг= б) сильная кислота + слабое основание=соль NH4Cl+HOH↔NH4OH+HCl, NH4++Cl-+HOH↔NH4OH+H++Cl-, NH4++HOH↔NH4OH+H+, (NH4+-по катиону;рН<7) KГ= Кг= В) Слабое основание + слабая кислота=соль NH4CN+HOH↔NH4OH+HCN, NH4++CN-+HOH↔NH4OH+HCN (NH4+,CN- - и по катиону и по аниону; рН≈7) KГ= Кг= Б) Расчет рН растворов солей: Степень диссоциации(α) доля частиц, подвергшихся электролитической диссоциации. α(степень диссоц.)сильных электролитов =0 Кд= α <<1 → α= рН+рОН=14 рН=-lg[H+] рOН=-lg[OH-] Пример: 1)HCl→H++Cl-(Cm=0,1); [H+]=αCm=0,1моль/л; α=1; рH=-lg 2)KOH→K++OH-(Cm=0,1); [OH-]=αCm=0,1; pOH=-lg10-1=1; pH=14-1=13 3)CH3COOH↔CH3COO-H+(Cm=0,1);[H+]=αCm=0,1;[H+]= 4)NH4OH↔NH4++OH-(Cm=0,1);[OH-]= Для сильных электролитов Кд не существует. ВОПРОС 39. А)Обменные р-и в р-рах электролитов. Б)Направление протекания р обмена для случая, когда одновременно среди исходных в-в и продуктов р-и им малораствор в-ва и слабые эл-ты. А) В обменных реакциях, протекающих в растворах электролитов, наряду с недиссоциированными молекулами слабых электролитов, твердыми веществами и газами участвуют также находящиеся в растворе ионы. Поэтому сущность протекающих процессов наиболее полно выражается при записи их в форме ионно-молекулярных уравнений. Например, уравнения реакций нейтрализации сильных кислот щелочами HClO4 + NaOH →NaClO4 + H2O, 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,выражаются одним и тем же ионно-молекулярным уравнением H+ + OH– → H2O, из которого следует, что сущность этих процессов сводится к образованию из ионов водорода и гидроксид-ионов малодиссоциированного электролита – воды. Б) Реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей CH3COONa + HCl → CH3COOH + NaCl. Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов CH3COO– + Na+ + H+ + Cl– → CH3COOH + Na+ + Cl–, Аналогично протекают реакции между щелочами и солями слабых оснований. Например, FeSO4 + 2 NaOH → Na2SO4 + Fe(OH)2↓ Таким образом, реакции в растворах электролитов идут до конца если в результате взаимодействия веществ происходит образование осадка, выделение газа иобразование слабого электролита. При написании ионно-молекулярных уравнений реакций, слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а находящиеся в растворе сильные электролиты – в виде составляющих их ионов. Все рассмотренные уравнения реакций являются необратимыми т.к. равновесие в них смещено вправо вследствие малой растворимости BaSO4 иFe(OH)2, образовании уксусной кислоты CH3COOH и воды H2O. Однако в обменные реакции могут вступать растворы сильных и слабых электролитов, что может приводить к образованию слабых электролитов. Такие реакции являются обратимыми. Например: FeS + 2HCl = Запишем его в ионно-молекулярной форме, cильные электролиты (HCl и FeCl2) запишем в виде ионов. FeS + 2 H+ + 2Cl- Исключив одинаковые ионы (не участвующие в реакции) в левой и правой частях уравнения, получаем сокращенное ионно-молекулярное уравнение: FeS + 2 H+ Взаимодействие кислой соли и щелочи приводит к образованию средней соли и воды. Например: KHCO3 + KOH HCO3– + OH– При взаимодействии основной соли и кислоты образуется средняя соль и вода. Например: NiOHNO3 + HNO3 Амфотерные гидроксиды [Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3 и др.] растворяются в растворах щелочей с образованием комплексных солей. Например: Zn(OH)2 + 2KOH В сокращенном ионно-молекулярном уравнении сумма электрических зарядов левой части уравнения всегда равна сумме электрических зарядов правой части уравнения. ВОПРОС 40. А) ОВР.Классификация ОВР. Б) Межмолекулярные, внутримолекулярные реакции, реакции диспропорционирования. В)Окислитель, восстановитель. А) Сущность ОВР заключается в переходе ē от одних атомов к другим. Степень окисления (С.О.)– условный заряд атомов в молекуле или в сложном ионе, вычислен исходя из положения, что молекула состоит из монов и сумма всех с.о. в молекуле равно 0, а в слож. ионе заряду иона. При протекании ОВР должен соблюдаться баланс зарядов: число отданных ē = числу принятых; на этом основан подбор коэффициентов в уравнении ОВР. Применяют два метода: 1.Метод эл. баланса(для твердой и газовых фаз). 2. Электронно-ионный метод. Классификация ОВР: межмолекулярные реакции, внутримолекулярные реакции, реакции диспропорционирования. Б) 1)Межмолекулярные реакции – атомы окислителя и восстановителя в молекулах разных веществ. K2S+4O3+H2O2-1→K2S+6O4+H2O-2 2) Внутримолекулярная реакция – атомы окислителя и восстановителя в молекулах одного и того же вещества. (N-3H4)2Cr+62O7→Cr2+3O3+N20+2H2O. К этому типу реакций относятся случаи, когда атомы одного и того же элемента в разных С.О. содержатся в молекулах одного и того же вещества. N-3H4N+3O3→N20+2H2O 3)Реакции диспропорционирования – реакции, в которых атом одного и того же элемента одновременно повышает и понижает свою С.О. 6Cl20+12KOH→10KCl-1+2KCl+5O3+6H2O В) Вещество (атомы, молекулы, ионы), отдающие ē называются восстановителем, процесс – окисление; Вещ-во (атомы, молекулы, ионы), принимающие ē называются окислителем, а процесс – восстановление. ВОПРОС 41. А)Коллигативные свойства растворов неэлектролитов. Б)Закон Рауля. Фазовая диаграмма воды. Изменение температур замерзания и кипения водных растворов. В)Явление осмоса. Уравнение Вант-Гоффа для осмотического давления. Г)Изотонический коэффициент, учитывающий процессы диссоциации в ассоциации частиц в растворах. А)Коллигативными свойствами называются свойства растворов, не зависящие от природы частиц растворенного вещ-ва, а зависящие только от концентрации частиц в растворе. Б)Первый закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. p1=kx1; p1=pi0xi; p1=p10x1=p1(1-x2); x2= Следствия: 1) Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора. 2) Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворенного вещества и прямо пропорционально моляльной концентрации раствора. Фазовая диаграмма воды:
Изменение температур замерзания и кипения водных растворов:
В) Явление осмоса.
Процесс самопроизвольной селективной односторонней диффузии определенного сорта частиц(растворителя) через полупроницаемую мембрану называется осмосом. Сила, обуславливающая эту диффузию, отнесенная к единице площади поверхности мембраны называется осмотическим давлением. π=icRT Примеры осмотических явлений: обеспечение тургора клеток; разрыв оболочек кл. (под действием высокого осмотического давления)- лизис; сморщивание - плазмолиз; высокоорганизованные животные отличаются постоянным осмотическим давлением - изоосмией. Закон Вант-Гоффа Для растворов неэлектролитов невысоких концентраций зависимость осмотического давления от концентрации и температуры раствора выражается Закон Вант-Гоффа: Осмотическое давление и концентрацию раствора позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева: π =C·R·T, C=n/V=m/(M·V) π = т·R·T / M·V или π·V =m·R·T / M Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент: π`=i·C·R·T, где i — изотонический коэффициент раствора Pосм – осмотическое давление раствора, кПа; Cm – его молярная концентрация, моль/л; R – универсальная газовая постоянная, 8,314 Дж/(моль*К); Т – абсолютная температура раствора. Г) Растворы, обладающие одинаковым значением осмотического давления, получил название изотомических(изоосмотических) растворов. Изотонический коэффициент - это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе. Этот коэффициент показывает во сколько раз меняется концентрация растворенного вещества, если происходит его диссоциация в растворе или ассоциация.
Реакции первого порядка:
ВОПРОС 42. А) Эквивалент веществ в кислотно-основных и окислительно-восстановительных процессах.Б) Фактор эквивалентности. Эквивалентная масса. В) Закон эквивалентов. А) 1) Кислота: а) f= 2) Основание: а) f= 3) Оксиды: а) f= 4) Соли: а) f= 5)Хим. элементы: f= 6) ОВР: f= Б) Фактор эквивалентности(f) показывает, какая часть частицы эквивалентна одному атому водорода (иону водорода, ē). f= Эквивалентное число(Z) – это число, показывающее, какому числу ионов водорода в кислотно-основных или ионообменных реакциях или какому числу ē в ОВР, или какому числу атомов водорода эквивалентна данная частица. Эквивалентная масса(Э) – это масса одного моль-эквивалента вещества.(г/моль-эквивалента),(г/моль). Эквивалент не может быть больше молекулярной массы. Основные формулы: m=Z*ню; Э= m=nЭ=ню*M; V=n*Vэ=ню*Vm; Vэ= Cн= Cn(A)*V(A)=Cn(B)*V(B) Пример:
В)Закон эквивалентов: Эквивалентом называется реальная или условная частица вещ-ва, которая может замещать, присоединять, содержать, обменивать, высвобождать или быть каким-либо образом эквивалентна: одному атому водорода (Н); Одному иону водорода (Н+) в кислотно-основных или ионообменных реакциях; Одному ē в ОВР. n(число эквив) N2+3H2=2NH3 2H2+O2=2H2O V0 1≠3≠2 2≠1≠2 Z 2*3 1*2 1*3 2*1 2*2 1*2 n 1*6=3*2=2*3 2*2=1*4=2*2 aA+bB=cC+dD, n(A)=n(D); Сn(A)*V(A)=Cb(B)*V(B) n(A)=n(B)=n(C)=n(D) Массы реагирующих веществ относятся м/у собой, как эквивалентные массы.
ВОПРОС 43. А)Комплексные соединения. Номенклатура комплексных соединений. Б)Строение, химическая связь В)Диссоциация комплексных соединений. Константа нестойкости комплексных соединений. А) Комплексными соединениями называют соединения, в узлах кристаллических решеток которых находятся комплексные ионы, способные к самостоятельному существованию в растворе или расплаве. Классификация: 1) По составу внешней сферы(комплексные кислоты, комплексные основания, соли) 2) По знаку заряда комплексного иона(катионные, анионные, нейтральные, с комплексным кат. и анионом.) 3) По природе лиганда(аммиакаты, аквакомплексы, гидроксокомплексы, карбонилы), Номенклатура:
[Mn(H2O)6]SO4 –сульфат гексааква марганца (││) 2 - ди; 3 –три; 4 – тетра; 5 – пента; 6 –гекса; 7- гепта; 8 – окта; 9 – нона; 10 – дека NO -нитрозо; CN –циано; NO2- нитрито; C2O4-оксалато; CO3-карбонато;Cl- хлоро; OH-гидроксо;SO3-сульфито;H-гидридо; S2O3-тиосульфато. Б) K3[Fe(CN)6] 1) [Fe(CN)6] – внутренняя сфера 2) K3 – ион внешней сферы 3) (CN)6 – лиганд(могут быть +,- и 0; ставятся по уменьшению заряда) 4) Fe – ион комплексообразователь(центральный атом) 5) 6 – координационное число (число лигандов, присоединенных к центральному иону) Связь м/у ионом комплексообразователем и лигандом – ковалентная химическая связь, образованная по донорно-акцепторному мех.; ион-комплексообразователь(АКЦЕПТОР) должен иметь свободные орбитали, а лиганд(ДОНОР) – неподеленные электронные пары. Связь между ионом внешней сферы и комплексным ионом – ионная. В) Диссоциация комплексных соединений. Между ионами внешней и внутренней сфер возникает ионная хим. св., поэтому соединения диссоциируют на ионы необратимо. Первичная диссоциация протекает как циссоциация сильного электролита – нацело. Между комплексообразователем и лигандом – донорно-акцепторная связь, поэтому вторичная диссоциация протекает как диссоциация слабого электролита - до установления химического равновесия. Константа нестойкости (табл. величина) характеризуется прочностью внутренней сферы комплексного соединения: чем меньшеКн, тем прочнее комплексный ион. [Zn(NH3)4]Cl2→2Cl-+ [Zn(NH3)4]2+ [Zn(NH3)4]2+↔ Zn 2+ +4NH30 Kн= ВОПРОС 44. А)Дисперсные системы и их классификация (в зависимости от соотношения агрегатного состояния дисперсная фаза / дисперсионная среда; характер взаимодействия дисперсной фазы с дисперсионной средой, структурно-механические свойства).Б) Дисперсность и гетерофазность. Способы получения дисперсных систем (методы диспергирования и конденсации). А) Дисперсная система - гетерогенная система, в которой одно вещество находится в дисперсном состоянии. Особенность: наличие большой межфазной поверхности. Для количественной характеристики меры дисперсности ДФ применяют: размеры частиц, степень дисперсности(D=1/d),Величину удельной поверхности(S=kD) Фаза-часть системы одного состава, имеющая одинаковые физические и химические свойства, ограниченная от других частей поверхностью раздела. Системы, состоящие из одной фазы, а, следовательно, имеющую одинаковые макроскопические свойства во всех ее точках, называют гомогенной. Гетерогенная система состоит из двух и более фаз. Гетерогенность = многофазность. Дисперсность=раздробленность Классификация: а) по соотношению агрегатного состояния дисперсная фаза(ДФ)/дисперсионная среда(ДС):
б) по агрег. сост ДФ и ДС.
в) размер ДФ: истинные растворы ( г) по структурно-механическим свойствам:
Б) Дисперсность. Гетерофазность. Гетерогенность- определяет наличие между фазами поверхностностей раздела с их специфическими свойствами, которые в свою очередь, обуславливают характерные свойства дисперсных систем. Дисперсность(раздробленность) определяет долю межфазной поверхности, ее количество, и как результат - вклад особых поверхностных свойств в свойства дисперсной системы. Развитая поверхность раздробленных тел придает им особые свойства. (только дисперсность без гетерогенности не может определять принадлежность к коллоидным системам. Например: истинные растворы представляют собой дисперсию молекулярно-растворенной многофазности. Отдельные молекулы или ионы не имеют поверхности и не имеют агрегатного состояния в отличие от частиц в дисперсной системе) Способы получения дисперсных систем: а)метод конденсации - м/д замены растворителя. Вещ-во, находящееся в молекулярно-дисперсном состоянии(истинный раствор), переводят в коллоидный раствор путем замены одного растворителя другим, в котором растворенное вещ-во растворяется хуже. б) дисперсионные методы - процесс механического диспергирования осуществляют механическим размалыванием веществ в шаровых, коллоидных мельницах, электродуговым растворителем, распылением металлов, дроблением веществ при помощи ультразвука. ВОПРОС 45. А) Коллоидные растворы как частный случай дисперсных систем. Особенности свойств коллоидных систем. Б) Строение мицелл в лиофобных коллоидных растворах (агрегат, ядро, гранула, мицелла).В) Правило Панета-Фаянса А) Коллоидные растворы - это ультрамикрогетерогенные дисперсные системы. Размеры частиц дисперсной фазы находятся в интервале величин Для получения коллоидных систем необходимо: достижение коллоидной степени дисперсности, выбор ДС, в которую практически нерастворимо вещество, образующее ДФ; подбор стабилизатора, обеспеч. необходимую степень устойчивости коллоидной системы. Особенности св-в: 1. В отличие от истинных растворов коллоидные ра-ры способны рассеивать свет. При этом визуально наблюдается явление опалесценции(различие окраски в проходящем и рассеянном свете) 2. Эффект рассеивания светом коллоидных растворов получил название эффект Тиндаля. 3. Наблюдаемое рассеивание света в коллоидном растворе в виде светового конуса получило название конуса Тиндаля. 4. Диффузия в КР протекает медленно. 5. Коллигативные свойства выражены в меньшей степени, чес в истинных растворах с той же конц. растворимого вещ-ва. 6.Агрегативная неустойчивость - это укрупнение коллоидных частиц посредством слипания(коагуляции) или слияния(коалесценции). Б) Строение мицелл:
Коллоидные частица представляет собой образование со сложной структурой - мицелла. Мицелла состоит из электронейтрального агрегата, окруженного ДЭС. Агрегатом называется микрокристалл малорастворимого вещества. На поверхности агрегата адсорбированы потенциалопределяющие ионы, сообщающие ему заряд. Агрегат и потенциалоопределяяющий ионы образуют ядро мицеллы. Вблизи заряженной поверхности ядра вследствие электростатического притяжения группируются противоположно заряженные ионы (противоионы). Часть противоионов(n-x) благодаря адсорбционным и электростатическим силам, плотно прилегают к ядру мицеллы и частично компенсирует заряд ядра. Эти противоионы получили название "связных" противоионов. Ядро мицеллы со "связанными" противоионами получило название гранулы. Гранула имеет заряд, знак которого совпадает со знаком потенциалоопределяющих ионов. Остальные ионы, необходимые для компенсации заряда гранулы, располагаются вокруг гранулы рыхло(диффузно), образуя диффузный слой. Гранула вместе с диффузным слоем противоионов образует мицеллу. В) Правило Панета-Фаянса: На поверхности твердой частицы избирательно адсорбируются только те ионы, которые способны достраивать ее кристаллическую решетку(ионы, которые входят в состав кристаллической решетки, либо изоморфны им по строению и могут ее достроить) ВОПРОС 46. А) Электрокинетические свойства коллоидных растворов. Б)Строение ДЭС. Потенциалоопределяющие ионы, противоионы. Электрокинетический (дзето-)потенциал. В) Электрофорез и электроосмос- объяснение механизма с позиции строения мицеллы. А) Скорость электрофореза и электроосмоса определяется а) электрокинетическим потенциалом, или б) дзета-потенциалом (z-потенциал). Этот потенциал возникает на границе скольжения двух слоев дисперсионной среды: адсорбционного и диффузного слоев. а)Электрокинетическим потенциалом называется потенциал на границе скольжения между адсорбционными и диффузными частями ДЭС мицеллы. Действие электростатического фактора снижается при добавлении в систему электролитов, которые вызывают сжатие ДЭС. Факторы устойчивости коллоидных систем: 1. Электростатический фактор. Обусловлен наличием ДЭС на поверхности частиц и электростатическим отталкиванием одноименно заряженных частиц. 2. Сольватные оболочки, возникающие за счет взаимодействия частиц дисперсной фазы и растворителя, ослабляют взаимное притяжение частиц ДФ и создают механические препятствия их сближению. 3. Высокая вязкость среды. Каждому фактору устойчивости соответствует специфический фактор его нейтрализации. Б) Строение ДЭС: {m[AgCl]nAg+(n-x)NO3}x+xNO3- агрегат ядро гранула мицелла Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Поверхность частицы приобретает слой ионов определенного знака, равномерно распределенный по поверхности и создающий на ней поверхностный заряд. Эти ионы называют потенциалопределяющими (ПОИ). К поверхности частицы из жидкой среды притягиваются ионы противоположного знака, их называют противоионами (ПИ). аким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде. Слой противоионов состоит из двух слоев:
Диффузный слой, в котором находятся противоионы. Эти противоионы притягиваются к частице за счет электростатических сил. Толщина диффузного слоя зависит от свойств системы и может достигать больших значений.
б)Важность дзета-потенциала состоит в том, что его значение может быть связано с устойчивостью коллоидных дисперсий. Дзета-потенциал определяет степень и характер взаимодействия между частицами дисперсной систе
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 844; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.239.79 (0.014 с.) |

 от единицы.
от единицы.
 В случае, когда мы имеем дело с малорастворимым химическим соединением, образующим при растворении электролит, в системе быстро устанавливается равновесие между раствором и осадком, причем растворенная часть малорастворимого соединения практически полностью диссоциирует на ионы. Это понятно, если принять во внимание редкость столкновений частиц, образующихся из растворенного соединения в разбавленных растворах. Поэтому малорастворимые электролиты являются сильными. Состояние равновесия в таких системах может быть описано схемой:
В случае, когда мы имеем дело с малорастворимым химическим соединением, образующим при растворении электролит, в системе быстро устанавливается равновесие между раствором и осадком, причем растворенная часть малорастворимого соединения практически полностью диссоциирует на ионы. Это понятно, если принять во внимание редкость столкновений частиц, образующихся из растворенного соединения в разбавленных растворах. Поэтому малорастворимые электролиты являются сильными. Состояние равновесия в таких системах может быть описано схемой: 
 =
=  [моль/л]
[моль/л] ; [H2O]≈const; Kp[H2O]=
; [H2O]≈const; Kp[H2O]=  =Kгидролиза(производная Кр)=│чтобы посчитать надо * на
=Kгидролиза(производная Кр)=│чтобы посчитать надо * на  │=
│= 


 , Kд=Кв;
, Kд=Кв;



 - для слабых электролитов.
- для слабых электролитов.
 =
=  =
=  =
= 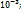 pH=-lg[H+]=-lg[10-3]=3
pH=-lg[H+]=-lg[10-3]=3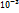 ;pOH=-lg[OH-]=-lg[10-3]=3;pH=14-3=11
;pOH=-lg[OH-]=-lg[10-3]=3;pH=14-3=11 FeCl2 + H2S.
FeCl2 + H2S. ГЭ – устройство для преобразования энергии хим. реакций в электричество.
ГЭ – устройство для преобразования энергии хим. реакций в электричество. ; A(ж)↔A(пар)
; A(ж)↔A(пар)

 ;
;  E=
E=  ; i-учитывает процесс распада на ионы молекул растворенного вещества
; i-учитывает процесс распада на ионы молекул растворенного вещества
 При диссоциации i>1; при ассоциации i<1; при отсутствии диссоц(ассоц) i=1.
При диссоциации i>1; при ассоциации i<1; при отсутствии диссоц(ассоц) i=1. ;HClf=1; H3PO4f=1/3б) С учетом хм.реакции f=
;HClf=1; H3PO4f=1/3б) С учетом хм.реакции f=  ;H2SO4+NaOH=NaHSO4+H2O; Z=2; f=1/2
;H2SO4+NaOH=NaHSO4+H2O; Z=2; f=1/2 ;NaOHf = 1;Cu(OH)2 – f=1/2; б) f=
;NaOHf = 1;Cu(OH)2 – f=1/2; б) f= 
 ;Na2Sf=1/1*2=1/2
;Na2Sf=1/1*2=1/2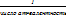 ; б) Na2CO3+HCl=NaHCO3+NaCl 1частица-1 ат. Н→Z=1,f=1; CuCl2+2NaОН=Cu(OH)2+2NaCl, 1частица – 2ОН группы →Z=2; f=1/2
; б) Na2CO3+HCl=NaHCO3+NaCl 1частица-1 ат. Н→Z=1,f=1; CuCl2+2NaОН=Cu(OH)2+2NaCl, 1частица – 2ОН группы →Z=2; f=1/2
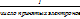

 =f*M; Э≤M;
=f*M; Э≤M; =f*Vm; Vэ≤Vm
=f*Vm; Vэ≤Vm =f*Cm; Cн≥Сm
=f*Cm; Cн≥Сm
 H2SO4]
H2SO4]




 NH3]
NH3]


 ;
;  =Куст.
=Куст. ,коллоидные растворы(
,коллоидные растворы( ; микрогетерогенные системы(
; микрогетерогенные системы(
 .
. Механизм образования и строения коллоидной мицеллы на примере золя иодида серебра, получаемого взаимодействием разбавленных растворов: AgNO3+KI→AgI↓+KNO3; при избытке нитрата серебра. Агрегат - кристалл m[AgI]; достраивают кристаллическую решетку - ионы серебра[Ag+]; противоионы - нитрат ионы [NO3-].
Механизм образования и строения коллоидной мицеллы на примере золя иодида серебра, получаемого взаимодействием разбавленных растворов: AgNO3+KI→AgI↓+KNO3; при избытке нитрата серебра. Агрегат - кристалл m[AgI]; достраивают кристаллическую решетку - ионы серебра[Ag+]; противоионы - нитрат ионы [NO3-].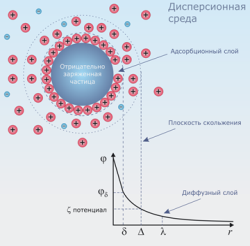 Адсорбционный слой (плотный слой), примыкающий непосредственно к межфазной поверхности. Данный слой формируется в результате электростатического взаимодействия с потенциалопределяющими ионами и специфической адсорбции.
Адсорбционный слой (плотный слой), примыкающий непосредственно к межфазной поверхности. Данный слой формируется в результате электростатического взаимодействия с потенциалопределяющими ионами и специфической адсорбции.


