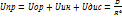Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электроотрицательность и основные типы химической связи. Ионная связь. Основные характеристики ионной связи.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ВОПРОС Состав атома. Элементарные частицы. Характеристика электрона, протона,нейтрона. Химический элемент. Изотопы. Ионы. Основы атомно-молекулярного учения. Масса атомов. Атомная единица массы. Понятие кол-ва вещества. Моль. Атом (от греч неделимый) – частица в-ва микроскопич размеров и массы, наименьшая часть химич элементов, явл носителем его св-в. Атом состоит из атомного ядра и электронов. Ядро несет почти всю массу атома, сост из положит заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Число протонов (z) – соотв порядковому номеру атома ПС Д.И. Менделеева. Число нейтронов(N) = А-Z Ядро состоит из 11р и 01n – эти частицы называются нуклонами. В сумме они определяют массовое число А. Атомы с одинак. Z - изотопы. По массе протоны и нейтроны почти одинаковы (1,673*10-24г и 1, 675*10-24г) Электрон -10e и протон стабильны, равны по величине, разные по знаку, их время жизни неограниченно. Время жизни свободного нейтрона ограничено. Электрон и протон имеют соотв античастицы – позитрон (10e, β+) и антипротон (-11р) с временами жизни менее 10-16с.(в усл Земли) Кроме этих частиц есть другие: фотоны, не имеющие массы покоя и с бесконечным временем жизни. Атомные ядра способны испускать более 25 элементарных частиц. Химический элемент – совокупность атомов с одинак зарядом атомных ядер и одинак числом электронов в атомной оболочке. Каждый хим эл имеет свое атинское название химич символ. Форма сущ-я химич эл – простые в-ва. Изотопы(от греч равный и место) – разновидности атомов хим эл-в, кот имеют одинак атомный (порядковый) номер, но при этом разные массовые числа. Пример: изотопы водорода. 1Н- протий, 2Н- дейтерий, тритий, квадий, пентий, гексий,септий. Ионы(греч. Идущее) – электрически заряженная неэлементарная частица, получающаяся в процессе ионизации.Имеет положительный или отрицательный заряд(катион, анион). В виде самостоятельных частиц ионы встречаются во всех агрегатных состояниях в-ва.Отрыв электрона требует затраты энергии (энергия ионизации). Положительно заряженные образ-ся в рез-те отрыва электрона, отрицательно – присоединения. Основы атомно-молекулярного учения: 1.Сущ в-ва молекулярного и немолекулярного стр-я. 2. У в-в молекулярного стр-я в твердом сост-ии в узлах кристаллич-х решеток находятся молекулы. 3.У в-в немолекулярного стр-я в узлах кристаллич-х решеток находятся ионы или атомы.4. Между молекулами имеются промежутки, размеры которых зависят от агрегатного сост-я в-ва и его температуры. Наибольшие расст-я сущ-т между молекулами газов, поэтому они легко сжимаются. В тв. в-вах промежутки наименьшие, соответственно эти в-ва почти не подвержены сжатию.5. Молекулы находятся в непрерывном движении. Скорость их движения зависит от температуры. Чем Т больше, тем больше скорость.6.При физич явл-х молекулы сохраняются, при химических – разрушаются.7.Молекулы состоят из атомов, кот как и молекулы находятся в непрерывном движ-ии. Одной из ф-м движения атомов явл хим р-я.8.Атомы одного химич эл отличаются от атомов другого химич эл-та размером, массой и св-вами.9.Атомы при хим. Р-ии сохраняются.10.Хим р-я – образ-е новых в-в из тех же атомов, из которых состояли исхоные в-ва. Масса атомов – Для измерения масс атомов и молекул принята единая система измерения. Эти величины измеряются в относительных единицах. Атомная единица массы (а.е.м.)- равна 1\12 массы атома углерода 12С (масса одного атома 12С равна 1,9934*10-26кг) 1 аем = 1\12 m 12С = 1,661*10-24г Относительная атомная масса (Аr) – безразмерная величина, равна относительно средней массы атома элемента и 1\12 массы атома 12С. При расчете учитывается изотопный состав элемента. Аr определяют по табл Менделеева. Абсолютная масса атома (m) – равна относит атомной массе * 1 аем Относительная молекулярная масса соединения (Мr) – безразмерная величина, равна отношению массы m молекулы в-ва к 1\12 массы атома 12С. Относит молек масса m = сумме относит атомных масс. Абсолютная m молекул = относит молек масса m* 1аем. Кол-во вещества – физич величина, хар-щая кол-во однотипных структурных единиц, содержащихся в в-ве.Структ единица – любые частицы, из которых сомт в-во (атомы, молекулы, ионы, электроны и тд) Единица измерения – моль. Моль – такое кол-во в-ва, в кот содержится опред число частиц, равное постоянной Авогадро (Na = 6,024 * 1023 моль-1). Постоянная Авогадро опред как число атомов, содерж-ся в 12г изотопа 12С. Na = 12г\ 12* 1,661 * 10-24г = 6,02 *1023 Т.О 1 моль в-ва содержит 6,02 *1023 частиц этого в-ва. Любое кол-во в-ва можно выразить опред числом молей n. n=n\ Na Молярная масса (М) = масса 1 моля этого в-ва. Она равна по величине Мr (для в-в атомного стр-я Ar). Молярная масса имеет размерность [г\моль] ВОПРОС. А) строение атома. Б) ядерная модель атома В) Квантово-механическое описание строения атома. Г) Корпускулярно-волновой дуализм. Д) Орбиталь А)1905 Томсон(«изюм в кексе»);
В) Квантово-мех. модель атома: 1) в основе теория Луи де Бройля(двойственная природа-дуализм-электрон это и корпускула (электрон с m иq), и волна(интерфер, дифракц) 2) Соотнош. Гейзенберга: в микромире нельзя точно опр. координаты и скорость движ. частиц 3)электрон мб в любой т. пространства с разн. вероятностью; нет понятия орбита, есть – орбиталь. 1926 Шредингер – материальное описание электрона в атоме
Г) Корпуск-волн. Дуализм. Электрон в одних случаях проявляет св-ва частиц вещ-ва, в др. – волновое. Двойствен. Поведения – дуализм- одно из общ. св-в материи(и вещ-ва и поля). Дифракция – огибание препятств., интерференция – наложение. Д) Атомная орбиталь – пространство вокруг ядра, где вероятность нахождения электрона 90-95%. 3 ВОПРОС. А) Электронное строение атома Б) Квантовые числа n, l, ml,ms. В) Значение и физический смысл Г) Электронный слой Д) Электронные подуровни А) Б,В) 1) Гл. квантовое число n. Принимает целые значения. Физический смысл: энергию электрона. Совпадает с номером периода. 2) Орбитальное кв. число L, Физический смысл: характеризует форму орбитали момента кол-ва движ. электр 3) Магнитное квант число; Физический смысл: направление АО в пространстве; ml =АО данного типа: от –l,0;+l Написать с рис. для кажд орбитали:
ml=NAO 4) ms– спиновое кв. число; Физический смысл: направление собственного момента кол-ва движения электрона ↑↓; 1/2– по часовой; -1/2 – против часовой. Г) Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне. Д) Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантовых чисел, но отличаются направлением (ориентацией) в пространстве. ВОПРОС. А) Электронная формула Б) Правило заполнения электронных орбиталей. Принцип Паули. Правило Гунда Д) Первое и второе правило Клечковского. А) Электронная формула. 1) 1S n+1=1+0=1; n+1=2+0=2 2) 2S 2p n+1=3+0=2+1=3; n+1=4+0=3+1=4 3) 3S 3P 3D n+1=5+0=4+1=5; n+1=6+0=5+1=6 4) 4S 4p 4D 4f n+1=7=0=6+1=7 5) 5S 5P 5D 5F 6) 6S 6P 6D 6F 7) 7S 7P 7D 7F Б) Правило заполн. эл. орбит. 1) Принцип Паули: в атоме не может быть двух электронов с одинаковым значением всех 4рех квантовых чисел (Это означает, что на одной орбитали мб расположено только 2 электрона, отличающихся значением ms). N=2n2 2) Правило Хунда: заполнения подуровня происходит так, чтобы суммарный спин был максимальным. 3) Правила Клечковского(принцип наименьшей энергии): первыми заполняются орбитали с наименьшими значениями суммы главного и орбитального квантовых чисел (L+n).При одинаковых значениях (L+n) первой заполняется орбиталь с меньшим значением n. Подур 1S 2S 3S 3D n 1 2 3 3 L 0 0 1 2 n+L 1 2 4 5 Г) Правило Гунда: в пределах энерг. подуровня электроны располагаются так, чтобы их суммарный спин был максимальным Д) Первое правило Клечковского: Первым заполняются орбитали с меньшими значениями суммы главного и орбитального квантовых чисел (n+L) Второе правило: При одинаковых значениях (n+L)первой заполняется орбиталь с меньшими значением n. Все элементы в ПСХЭ Менделеева разделяется на 4 эл. семейства (S-, p-, d-,f-) в зависимости от того, какой подур. в атоме элемента заполн. последним. ВОПРОС. А) Электронное строение атомов и периодическое изменение химических элементов Б) ПСХЭ. S-, p-, d-,f- элементы, их расположение в ПСХЭ. А,Б) Электронное стр. ат Бора - модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра. 1) Причина периодич. повторяемости хим. св-в – повторяемость строения внеш. эл. слоя. 2) Хим. и электрич. аналоги попадают в одну группу ПСХЭ. 3) Номер периода = n, число эн. ур., номером внешур. 4) Номер группы=число эл. на внеш. слое для элементов главных подгрупп. 5) У атомов хим. эл. побочных подгрупп происходит заполнение предвнеш. уровня. 6) На внеш. эл. ур. не мб более 8 электр. 7) Все хим. эл. делятся на S-, p-, d-,f- элементы в зависимости от того, на какой подур. попадает послед.электрон Периодический закон Менделеева (современная формулировка): Строение и свойства хим. элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и определяется периодически повторяющимися однотипными конфигурациями их атомов. Переходн. эл: d- и f- эл; идет заполнение внутр. эл.сл; внеш. обол. 2мя или 1й s- электрон.; хим. св-ва опр. структурой внеш. эл. обол. -> хим. св-ваперех. эл. с увеличением атомного номера меняются не так резко, как св-ваp-элементов. Электрону не выгодно переходить на более высокие орбитали из-за затрат энергии. ВОПРОС. А)Понимание периодического закона с позицией современных представлений о строении атома. Б)Закономерности изменения металлических и неметаллических св-в хим. элементов в периодах и группах периодич. сис. А) Менделеев открыл периодическую повторяемость химических свойств элементов и включил их в соответствующие группы. Эта периодическая повторяемость обусловлена повторяемостью в строении внешнего электронного уровня. Например, все металлы IA - группы имеют один s-электрон, а неметаллы VIIA - группы два s- и пять р-электронов на внешнем уровне. Современная система химических элементов (периодическая таблица) состоит из семи периодов (трех малых, трех больших и одного большого незаконченного). Они располагаются по горизонтали и разложены на ряды. По вертикали в таблице расположены восемь групп, каждая из которых делиться на две подгруппы: главную (А) и побочную (В). Тем самым каждый химический элемент имеет в этой таблице свои конкретные координаты. Например, сера S находится в VIA - группе 3 периода. Б)Закономерности в изменении свойств элементов выглядят следующим образом. Слева направо в каждом периоде ослабевают металлические и усиливаются неметаллические свойства. Последним элементом в каждом периоде стоит атом благородного (инертного) газа (s2р6-элемент). Под неметаллическими свойствами атома химического элемента мы понимаем его стремление к приобретению электронов (т.е. способность выступать окислителем), а под металлическими - способность отдавать электроны, т.е. окисляться и выступать в роли восстановителя.В группах сверху вниз возрастают именно металлические свойства. Таким образом, самым активным металлом является франций, а самым активным неметаллом - фтор.В группах находятся химические элементы со сходными свойствами, т.е. со сходным строением атома (одинаковое количество валентных электронов). Их максимальная валентность в соединениях равна числу этих валентных электронов. В периодах валентность атомов возрастает слева направо на единицу при переходе от предыдущего атома к последующему.Благородные газы образуют самостоятельную VIIIA - группу, которая позже других появилась в таблице (после открытия этих газов в начале ХХ века).Важно знать, что изменение свойств элементов по периоду происходит постепенно, и определяющим является заряд ядра.Умелое пользование таблицей химических элементов позволяет правильно составлять формулы сложных соединений, сравнивать и оценивать свойства элементов, рассчитывать молекулярные массы веществ, устанавливать состав атомов и ядер.Значение периодического закона для развития науки: - дает целостное представление о взаимосвязи строения атомов и их свойств; -объясняет причины схожести и индивидуальности в химическом поведении простых и сложных веществ; -показывает периодическую зависимость свойств простых и сложных соединений от строения атомов. В прошлом этот закон позволил предвидеть открытие многих новых элементов и предсказать их основные физические и химические свойства.Порядковый номер химического элемента показывает численное значение заряда его ядра (т.е. число протонов в ядре), а также общее число электронов, движущихся около ядра.Каждый следующий по порядку атом имеет на один протон больше в своем ядре и на один электрон больше в своей электронной оболочке. При движении по периоду слева направо с ростом заряда ядра атома уменьшается его размер и возрастает энергия связи электронов с ядром. Это проявляется в том, что металличность элемента (способность отдавать свои валентные электроны) снижается, и одновременно возрастает стремление атома к присоединению электронов (т.е. его неметалличность). В 4-м периоде эта закономерность наблюдается от калия до брома. Электронные формулы некоторых элементов из этого периода: +19 К 1s22s22р63s2Зр6Зd04s1(самый активный металл 4-го периода) +32Ge 1s22s22р63s2Зр6Зd104s24p2 (амфотерный элемент) +35Вг 1s22s22р63s2Зр6Зdl04s24р5 (самый активный неметалл 4-го периода) +36Кr 1s22s22р63s2Зр6Зdl04s24р6 (благородный газ);(подчеркнуты валентные электроны) Постепенное заполнение электронами внешнего энергетического уровня закономерно меняет свойства атома от металлических к неметаллическим. Снижается восстановительная и возрастает окислительная способность атомов.В группах сверху вниз с ростом размера атома осла6евает энергия связи его электронов с ядром, т.е. растет восстановительная способность атома (металличность), а снизу вверх усиливается окислительная способность.Например, такая закономерность видна в IV А - группе:от металла свинца (РЬ) к неметаллу углероду (С).В группах объединены элементы, имеющие сходное строение атома "на уровне внешнего электронного слоя. Так, и у атома углерода, и у атома свинца внешняя электронная оболочка содержит четыре электрона (два s- и два р-электрона). +6 C 1s22s22p2 +82Pb …6s26p2 В периоде характер оксидов элементов меняется от основного (К2О, СаО) к кислотному (SеОз), а в группах сверху вниз ослабевает кислотный характер оксидов. ВОПРОС. А) Энергия ионизации, сродство к электрону, электроотрицательность. Б)Закономерности их изменения у элементов в периодах и группах. А)Важнейшие св-ва хим. эл.: 1) Металличность – вп. атомов хим. элементов отдавать электроны. Кол-ой характеристикой металличности является энергия ионизации. Энергия ионизации(I) – это энергия, которая необходима для отрыва ē от атома, иона (чем меньше I, тем легчеатом отдает ē электрон, тем сильнее металл.св-ва) 2) Неметалличность – сп. атомов хим-ого элем. присоединять ē. Кол-ой харак-ой неметалличностиявл. сродство к ē. Энергия сродства к ē (E)- это энергия, которая выделяется при присоединении ē к нейтральному атому, иону. (чем >E, тем >неметал. св-ва) Электроотриц.(ЭО)харак-етсп. атома принимать/отдавать ē.(чем>металлич, тем < ЭО); чем неметалличн., тем>ЭО)ЭО=I+E Б) Если мы движемся по периоду -->: уменьш. R; число эн. ур. – пост; усиливается взаимодействие с внеш электроном, следовательно энергия ионизац. ↑; энергия сродства, ЭО ↑ Если мы движемся по группе ↓: R↑; взаимодейтв. ядра атома с веш. ē ↓; энергия ионизац.↓ , сродство к ē↓; ЭО ↓. Потеря атомами ē приводит к ↓ его эффект.размеров, а присоедин. к ↑. Радиус иона тем сильнее отличается от R атома, чем больше его заряд. При завтрате энергии можно оторвать неск. ē. т.к. отрыв ē от + иона энергетич. более сложен, то второй и последующие потенциалы ионизации увеличиваются с ростом заряда ионов. 8 ВОПРОС.А) Ковал. хим. св, ее хар-ки. Б)Обменный и донорно-акцепторн. мех. образования ковал. связи. А) Ковалентная химическая связь – осуществл. парой ē, принадлежащих различным атомам, за счет образования общей электронной пары. Делится на ковалентную полярную (ат. отлич. величинами ЭО) и ковалентную неполярную(ЭО равны) Чем больше разница ЭО атомов, образующих связь, тем больше полярность хим. связей. КХС характеризуется энергией связи, длиной связи, направленностью связи в пространстве, насыщаемостью, полярностью, кратностью Б) Мех.образования КХС: * мех. образования КХС за счет образования общей эл. пары электронами принадлежащими разным атомам получил названия обменного механизма. А’ +’А=A:A; Мех. образования КХС за счет неподеленной эл. пары одного атома(донора) и свободной орбит. другого атома(акцептора) получил название донорно-акцепторного механизма. (ион аммония, ион гидроксония) Д:+ А=Д:А 9 ВОПРОС. А) Метод валентных связей(осн. положения)Б) Кривая E=f(r) А) М/д валентных связей(осн. полож.): 1) КХС образуется 2мя неспаренными ē с антипараллельными спинами.(насыщенность КХС) 2) Связь располагается в том направлении, в котором возможность перекрывания АО наивысшее.(направленность КХС)
Потенциал Ленарда-Джонса ВОПРОС А)Понятие валентности атомов, валентные электроны, степень окисления атомов. Б)Валентность атомов в основном и возбужденном сост. А) Способность атома к образованию ковал. хим. связей получила название валентности. Мера валентности – число хим. связей. Степень окисления (С.О.)– условный заряд атомов в молекуле или в сложном ионе, вычислен исходя из положения, что молекула состоит из монов и сумма всех с.о. в молекуле равно 0, а в слож. ионе заряду иона. Максимальная С.О. = Nгруппы; минимальна С.О.=Nгруппы- 8(кроме Me,у которых минимальная С.О. 0; пример-N(max c.о. +5; min с.о.-3) Б) Формально в большинстве случаев валентность определяют по числу неспаренных электронов в основном и возбужденном состоянии. Пример: 16S 1S22S2P63S2P43d0;1)В невозбужд. сост.3 2)В возбужденном состоянии(1)3 3)В возбужденном состоянии(2) Валентность серы в осн. состоянии - 2; в возбужденном состоянии в первом случае - 4; во втором - 6. Б) Валентные возможности опр. числом неспар. ē на внеш. эл. слое и числом связей, которые могут образ.по д-а. мех. При возбужд. атома происходит распаривание ē и их переход на свободные орбитали. В результате валентные возможности атома возрастают. 11 ВОПРОС. А) Основные типы хим. св. Б) Электронная природа хим. св. В) Осн. характеристики хим. св.: энергия связи; длина связи; направленность связи: полярность; насыщаемость связи. А) Осн. типы. хим. св: КХС(поляр/неполяр), ионная, Me. КХС: Ковалентная химическая связь – осуществл. парой ē, принадлежащих различным атомам, за счет образования общей электронной пары. Делится на ковалентную полярную (ат. отлич. величинами ЭО) и ковалентную неполярную(ЭО равны); Чем больше разница ЭО атомов, образующих связь, тем больше полярность хим. связей.КХС характеризуется энергией связи, длиной связи, направленностью связи в пространстве, насыщаемостью, полярностью, кратностью Мех.образования КХС: * мех. образования КХС за счет образования общей эл. пары электронами принадлежащими разным атомам получил названия обменного механизма. А’ +’А=A:A; Мех. образования КХС за счет неподеленной эл. пары одного атома(донора) и свободной орбит. другого атома(акцептора) получил название донорно-акцепторного механизма.(ион аммония, ион гидроксония) Д:+ А=Д:А Ионная: образуется м/у атомати с сильно отлич. ЭО за счет электростатических сил. В отличие от КХС для ион.св. не хар-ны такие св-ва, как направленность и насыщаемость. Металлическая: низкая эн. ионизации, избыт.число свободн. орбиталей; при взаимодействии ат. происх. образование из АО общих молекул. обриталей; при ↑ числа взаимод. ат. происх. делокалзация МО и формир. одной непрер. энерг. зоны для всего кристалла в целом; ē вследствие делокал. МО при небольших затратах энергии может перемещаться по всему кристаллу в целом, т.е. ведет себя как свободный электрон. В) 1) Длина связи: это межъядерное расстояние между химически связанными атомами. Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность; 2) Энергия связи: энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль 3) Направленность связи: определяется направленностью в пространстве АО. 4)Полярность: если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной, если электронная плотность смещена в сторону электроотрицательного атома, то ковалентная связь называется полярной a)Дипольный момент связи (M – мю): M=ql(эфф. заряд* длина св) б) Смещение эл. плотности к более ЭО атому -> Возникновение эфф. зарядов( в) Молекула неполярна, если суммарныйM всех связей = 0. г) Полярна: 5) Насыщаемость: свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав. 12 ВОПРОС. А) водородная связь. Б) Энергия водородной связи. В) Изменение физич. св-в вещ-в вследствие образования водор св. Г) Особенность св-в воды. А) Водородная связь – межмолекулярн. взаимодействие. Возникает в случае, кргда атом H оказывается одновременно связанным с двумя электроотриц. атомами. При этом одна связь ат. Н явл. внутримолекул. полярн. ковал.св. Другая – образ. ат. Н с ЭО атомом, принадлежащ. др. молекуле. Связь представляет собой специф. межмол. взаимодействие, получившее название водор. связи. Особенности механизма образования: 1) Внутримолекулярное взаимодействие Н-атома с сильноэлектроотриц. атомом (полярная ковал.связь); следствие этого: оттягивание общей электронной пары от атома водорода к более ЭО атому, связь Н-элемент становится наиболее полярной, у атома водорода возникает высокий эффективный заряд(диполь-дипольное взаимодействие), у атома Н отсутствуют высокие электронные слои, а единственный электрон оттягивается к более ЭО атому – это позволяет атому взаимодействовать с электронными оболочками соседних атомов, сближаться до расстояний равных длинам химических связей(взаимодействие по донорно-акцепторному механизму, где акцептором является атом Н, а донором атом ЭО молекулы). В результате Н-связь начинает обладать признаками к.х.с.: направленностью, насыщаемостью; более высокой, чем у универсальных взаимодействий(сил Ван дер Ваальса) энергией, длина связи становится сопоставимой с длиной хим. связи. Б) Основной критерий – это энергия водородного связывания (R–X–H…B–Y), которая зависит как от природы атомов Х и В, так и общего строения молекул RXH и BY. Энергия Н-связи возрастает с увеличением положительного заряда на атоме водорода связи Х-Н и с повышением его основности.
В) 1) Аномально высокие температуры плавления и кипения 2)Образование ассоциатов, устойчивых даже в газовой форме 3) Особенности свойств белков и нуклеиновых кислот 4) Высокая адсорбционная способность хлопка и шелка в воде 5) Особые св-ва воды и ее особая роль в живой природе Г)1) Необычайно высокие для такой ММ температуры кипения и плавления 2) Высокие энергии фазовых переходов(обуславливают колоссальный круговорот энергии в природе и сильно влияет на климат) 3) Наличие водор. связей обуславливает высокую теплоемкость воды. 4) Наличие водор. св. обусловливает высокую поверхностную энергию воды. 5) Согласно современным воззрением – вода обладает эффектом памяти 6) Аномальное поведение плотности воды при ее замерзании(плотность при замерзании уменьш. вследствие структурообразования) А) Межмолекулярные взаимодействия и агрегатное состояние веществ. (Б)Газообразное и конденсированное состояние веществ. (А) Межмолекулярные взаимодействия и агрегатное состояние веществ. Сила (энергия) межмолекулярных взаимодействий влияет на:температуру кипения, температура замерзания,агрегатное состояние вещества,механические свойства вещества,теплоту испарения,теплоту плавления,теплота сублимации,теплоемкость,поверхностное натяжение Ориентационные взаимодействия Ориентационные силы (силы Кеезома) действует между полярными молекулами, то есть молекулами, обладающими постоянными дипольными электрическими моментами (µ). Это взаимодействие типа диполь-диполь. Uориент = - (2m4Nа)\3RTr6= - а\r6, r-расстояние между диполями. Индукционные взаимодействия Индукционные (или поляризационные) взаимодействия (силы Дебая) возникают между полярной и неполярной молекулами. Полярная молекула создает электрическое поле, которое поляризует неполярную молекулу. В результате у неполярной молекулы индуцируется дипольный момент. Uиндукц= - (2am2)\r6= - b\r6 Дисперсионное межмолекулярное взаимодействие Природа этого взаимодействия была выяснена полностью только после создания квантовой механики. Энергия взаимодействия между неполярными молекулами есть результат взаимодействия мгновенных диполей с дипольными моментами, которые они наводят в соседних молекулах благодаря индукции. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента отлично от нуля. Мгновенный диполь создает электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Uдисперс = - (3hn0a2)\4r6= - с\r6,a-поляризуемость Кривая E=f(r) Кривая зависимости энергии межмолекулярного взаимодействия от расстояние между взаимодействующими частицами.
Потенциал Ленарда-Джонса Выводы: Межмолекулярные взаимодействия это относительно слабые взаимодействия. Энергия этих взаимодействий имеет порядок 10кДж\моль. Имеют электрическую природу. Наиболее важной отличительной чертой Ван-дер-Ваальсовых сил является их универсальность, так как они действуют без исключения между атомами и молекулами. Отсутствует свойство направленности. Действуют на относительно больших(по сравнению с длинами химич. Связей) расстояниях. Ненасыщаемы. Оказывают заметные влияния на физические свойства веществ (температуры плавления, кипения, поверхностное натяжение, теплоемкость и т.д) Водородная связь – это особый вид межмолекулярного взаимодействия. Эта связь возникает в случаях, когда атом Н оказывается одновременно связанным с двумя электроотрицательными атомами. При этом одна связь атома Н является внутримолекулярной полярной ковалентной связью. Другая связь образуется атомом Н с электроотрицательным атомом, принадлежащим другой молекуле. Связь представляет собой специфическое молекулярное взаимодействие, получившее название водородной связи. Особенности образования водородной (Н-) связи: Внутримолекулярные взаимодействия атома H с сильно электроотрицательным атомом (Полярная ковалентная связь). Следствием этого является: Подтягивание общей электронной пары атома водорода к ЭО-атому. Связь H-(элемент) становится Полярной связью (диполь-дипольное взаимодействие). У атома водорода возникает высокий эффективный Ϭ+заряд.* У атома Н отсутствуют внутренние электронные слои, а единственный электрон оттягивается к ЭО-атому. Это позволяет атому Н взаимодействовать с электронными оболочками соседних атомов, сближаться на расстояние близких к длинам химических связей(отсутствует отталкивание электронных оболочек).* * Взаимодействие по донорно-акцепторному типу, где акцептором является атом H одной молекулы, а донором атом элемента другой молекулы. В результате Н-связь начинает обладать признаками, которые присущи ковалентной химической связи: направленностью, насыщаемостью и более высокой, чем универсальных взаимодействий (сил ван-дер-ваальса) энергией; длина связи становится сопоставимой с длиной химической связи.
Влияние водородной связи на свойства веществ: Аномально высокие температуры плавления и кипения. Образование ассоциатов. Особенности свойств белков и нуклеиновых кислот. Высокая адсорбционная способность. Особые свойства воды и ее роль в живой природе(высокая температура кипения, высокие энергии фазовых переходов, высокая поверхностная энергия воды, вода обладает эффектом памяти, плотность при замерзании воды уменьшается вследствие структурообразования.) Свойство и строение вещества определяется: Типом частиц, образующих вещества (атомы, ионы и молекулы) Силами, которыми эти частицы соединены друг с другом (ионная, ковалентная, металлические связи, межмолекулярные взаимодействия) Способом размещения частицы относительно друг друга Соотношения величин энергии взаимодействия между частицами и величина тепловой энергии. Различают газообразное, жидкое, твердое агрегатное состояние вещества. Жидкое и твердое состояние называют также конденсированным состоянием вещества Жидкое состояние вещества характеризуются ближним порядком в расположении частиц В твердом состоянии вещества могут образовывать кристалл или находиться в аморфном (жидкоподобным по структуре) состоянии Кристалл – это тело, элементарные частицы которого расположены в пространстве в правильном порядке, образуя кристаллическую решетку (дальний порядок). Агрегатное состояние вещества: Структура ионного кристалла nacl демонстрирует дальний порядок в расположении частиц. Ионы натрия и хлора (больших частиц) располагаются в чередующихся углах куба. Аморфное (жидкое) состояние вещества демонстрирует ближний порядок. Атомы располагаются в регулярном порядке на расстояниях сравнимых с межатомными. Газообразное состояние вещества. Хаотическое движение молекул газа показывает отсутствие всякого порядка в расположении частиц. (Б)Газообразное и конденсированное состояние веществ. В газообразном состоянии вещества энергия межмолекулярного вза
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 978; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.234.182 (0.012 с.) |

 Б)Ядер. мод.ат 1911 Резерфорд (e- с больш. ск. движутся по круг. орбитам вокруг ядра, подобно планетам вокруг солнца; e- удерж. на орбите благодаря равновесию центробеж. силы отталкив. И кулоновск. силы притяж.) rядра<<rатома; mат≈mядра;me<<mp≈mn0; недостатки ат. модели.резерфорда: время жизни модели оч. Мало, т.кe-, вращ. По орбите испуск. энергию; данная модель не объясняла линейчатые спектры поглощ. Испускания вещ-ва.)
Б)Ядер. мод.ат 1911 Резерфорд (e- с больш. ск. движутся по круг. орбитам вокруг ядра, подобно планетам вокруг солнца; e- удерж. на орбите благодаря равновесию центробеж. силы отталкив. И кулоновск. силы притяж.) rядра<<rатома; mат≈mядра;me<<mp≈mn0; недостатки ат. модели.резерфорда: время жизни модели оч. Мало, т.кe-, вращ. По орбите испуск. энергию; данная модель не объясняла линейчатые спектры поглощ. Испускания вещ-ва.)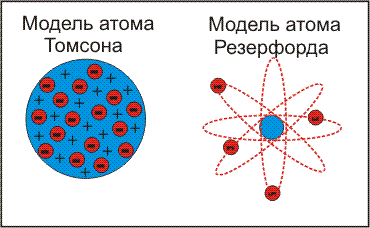 1913 Бор(сохр. ядерн. модели строения Резерфорда, вводит понятие стац. дискретн. орбит, по кот электрон движется безизлучательно; недостатки: описывалась законами классической механики.)
1913 Бор(сохр. ядерн. модели строения Резерфорда, вводит понятие стац. дискретн. орбит, по кот электрон движется безизлучательно; недостатки: описывалась законами классической механики.) Для матем. описания сост. эл в атоме применяют уравнение Шредингера:
Для матем. описания сост. эл в атоме применяют уравнение Шредингера:  , E- полнэнерг. Частиц; U – потенц. Энерг;
, E- полнэнерг. Частиц; U – потенц. Энерг; Электронное стр. ат Бора - модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра.
Электронное стр. ат Бора - модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца. Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений рассчитывается не траектория движения электрона внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра. энергию электрона в пределах данного подуровня, определяет форму атомной орбитали (L= 0 – S, 1–p, 2 – d, 3 – f, 4 –g)Знач. L опр. как n-1; эл. с одинаковым знач. L образуют энерг. подуровни.
энергию электрона в пределах данного подуровня, определяет форму атомной орбитали (L= 0 – S, 1–p, 2 – d, 3 – f, 4 –g)Знач. L опр. как n-1; эл. с одинаковым знач. L образуют энерг. подуровни. Б) Кривая E=f(r) Кривая зависимости энергии межмолекулярного взаимодействия от расстояние между взаимодействующими частицами.
Б) Кривая E=f(r) Кривая зависимости энергии межмолекулярного взаимодействия от расстояние между взаимодействующими частицами.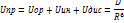


 ) – степень ионности.
) – степень ионности.