
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Острые отравления и коматозные состоянияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ОСТРЫЕ ОТРАВЛЕНИЯ И КОМАТОЗНЫЕ СОСТОЯНИЯ
методические указания для студентов 5 курса
Утверждено ученым советом ХНМУ протокол № ______ от «____» ___________ 2009 г
Харьков
ББК УДК
Михневич К.Г., Хижняк А.А., Курсов С.В. и др. Острые отравления и коматозные состояния: Метод. указания для студентов 5 курса. – Харьков: ХНМУ, 2009. – с.
Составители: ассистент Константин Георгиевич Михневич профессор Анатолий Антонович Хижняк доцент Сергей Владимирович Курсов ассистент Виктор Александрович Науменко ассистент Виталий Григорьевич Редькин ассистент Николай Витальевич Лизогуб
© К.Г. Михневич, А.А. Хижняк, © Харьковский национальный медицинский университет, 2009 СОДЕРЖАНИЕ Список сокращений....................................................................................................... 1. Предмет токсикологии........................................................................................... 2. Классификации ядов.............................................................................................. 3. Классификация отравлений................................................................................. 4. Токсикодинамика..................................................................................................... 5. Токсикокинетика....................................................................................................... 6. Синдромы, развивающиеся при острых отравлениях................................. 7. Методы лечения экзогенных интоксикаций..................................................... 8. Отравления барбитуратами................................................................................ 9. Отравление фенотиазинами............................................................................... 10. Отравление производными бутирофенона и дифенилбутилпиперидина 11. Отравление транквилизаторами........................................................................ 12. Отравление трициклическими антидепрессантами.................................... 13. Отравление клофелином...................................................................................... 14. Отравление опиатами........................................................................................... 15. Отравление атропином и атропиноподобными веществами.................... 16. Отравление димедролом...................................................................................... 17. Отравление стимуляторами ЦНС...................................................................... 18. Отравление ФОС..................................................................................................... 19. Отравление алкоголем и его суррогатами.......................................................
20. Отравление угарным газом.................................................................................. 21. Отравление кислотами и щелочами.................................................................. 22. Отравление ядовитыми грибами........................................................................ 23. Отравление ядами животного происхождения.............................................. 24. Коматозные состояния.......................................................................................... 25. Отек мозга, судорожный и гипертермический синдромы у детей............. СПИСОК СОКРАЩЕНИЙ
Модуль 1. Анестезиология и интенсивная терапия. Содержательный модуль 2. Общие вопросы интенсивной терапии. Тема 6. Острые отравления и коматозные состояния. Актуальность темы. Острые отравления и коматозные состояния различной этиологии — патология, которая встречается в практике любого врача все чаще. Это классические примеры критических состояний. Изучение данной темы дает возможность получить практические навыки и сформировать профессиональные умения в диагностике и проведении интенсивной терапии коматозных состояний разной этиологии, в том числе и токсикогенной. Общая цель: сформировать знание общих принципов и методов диагностики и интенсивной терапии острых отравлений и коматозных состояний. Конкретные цели:
1) дифференцировать клинические проявления коматозных состояний разного генеза; 2) сформулировать основные принципы интенсивной терапии коматозных состояний разной этиологии; 3) трактовать закономерности возникновения нарушений жизненно важных функций организма при остром отравлении; 4) классифицировать разные виды острого отравления; 5) обосновать выбор методов интенсивной терапии разных видов острого отравления. Предмет токсикологии Токсикология (от греч. toxicon — яд) — область медицины, изучающая законы взаимодействия организма и яда. Ядом называется любое вещество, которое, попав в организм в определенном количестве, вступает во взаимодействие с органами и тканями, нарушает их функции, что приводит к развитию химической болезни, которая может перейти в критическое состояние. Токсикология изучает взаимодействие яда и организма в 2 аспектах: 1) влияние яда на организм — токсикодинамика; 2) влияние организма на яд — токсикокинетика. Неотъемлемой частью токсикокинетики являются процессы естественной детоксикации. Токсичность яда тем больше, чем меньшее его количество способно привести к развитию химической болезни (отравления). Измерением токсичности занимается токсикометрия. Основными токсикометрическими параметрами являются:
Зона (широта) острого токсического действия, характеризующая токсичность яда, определяется как
Чем больше эта величина, тем менее токсичен яд. Классификации ядов Существует несколько классификаций ядов, в основу которых положены различные принципы. Рассмотрим наиболее важные с клинической точки зрения. Классификация отравлений В зависимости от причин выделяют случайные (по неосторожности, ошибке, несчастные случаи), преднамеренные (суицидальные, криминальные), производственные, бытовые, сезонные, ятрогенные отравления. По пути поступления яда отравления могут быть ингаляционные, пероральные, инъекционные, перкутанные. По клинической картине выделяют острые, подострые и хронические отравления. По степени тяжести — легкие, средней тяжести, тяжелые, крайне тяжелые и смертельные, а также осложненные и неосложненные. Осложненные отравления бывают, как правило, тяжелыми. Случайные отравления развиваются не по воле пострадавшего, а в результате, например, ошибки при приеме внутрь жидкости, принятой за напиток, в результате самолечения и передозировки лекарства, ошибочного приема другого лекарства, во время промышленных и бытовых аварий. При преднамеренных отравлениях яд применяют с целью самоубийства (суицидальные), симуляции самоубийства (демонстративные), убийства или создания беспомощного состояния потерпевшего (криминальные).
Сезонными называют отравления, которые встречаются чаще в определенное время года (отравления грибами, инсектицидами на собственных огородных участках, укусы змей и насекомых и т. п.). Ятрогенные отравления имеют своей причиной ошибки медицинского персонала (неправильная дозировка, ошибочный путь введения, превышение скорости введения препарата и т. п.) и провизоров (несоответствие содержимого лекарственной формы надписи на ней). Токсикодинамика Фазы химической болезни Выделяют 3 фазы химической болезни: токсикогенную, соматогенную и фазу исхода. Токсикогенная фаза включает в себя периоды резорбции и элиминации яда. Условие, необходимое для того, чтобы назвать фазу химической болезни токсикогенной — наличие яда в организме (в кровотоке, органах, тканях). Клиническая картина отравления в этой фазе определяется главным образом действием конкретного яда, попавшим в организм. Токсикогенная фаза заканчивается после выведения яда из организма. Длительность этой фазы составляет от нескольких часов до 7 суток (в зависимости от яда). В этой фазе чаще всего развиваются синдромы критического состояния: острая недостаточность кровообращения, шок (кардиогенный, гиповолемический, дистрибутивный), острая дыхательная, церебральная, почечная, печеночная недостаточность, ДВС-синдром (диссеминированное внутрисосудистое свертывание) с переходом в коагулопатию потребления и тромбогеморрагический синдром (ТГС) и т. д. В этой же фазе закладываются предпосылки для развития соматогенной фазы. До 2/3 летальных исходов случается в токсикогенной фазе. Соматогенная фаза начинается после выведения яда из организма и является следствием тех повреждений, которые яд вызвал в токсикогенной фазе. Иначе говоря, соматогенная фаза — это фаза последствий отравления. Например, после отравления опиатами вследствие гипорефлексии может произойти регургитация и аспирация желудочного содержимого с последующим развитием синдрома Мендельсона, длительность которого значительно превышает время нахождения опиата в крови. После отравления крепкими кислотами или щелочами возникает ожоговая болезнь ЖКТ, которая также длится значительно дольше, чем в организме обнаруживается кислота или щелочь. В соматогенной фазе может развиваться также токсический гепатит, астенический синдром, токсическая и постгипоксическая энцефалопатия и т. п. Как и любое заболевание, химическая болезнь заканчивается фазой исхода: выздоровлением, инвалидизацией, хронизацией синдромов соматогенной фазы или гибелью организма.
Взаимоотношения яда и организма можно проиллюстрировать рисунком, где C — концентрация яда в крови, а t — время. Токсикокинетика Связывание яда в организме После всасывания яд начинает поступать в различные среды и пространства организма, где и осуществляются токсикокинетические и токсикодинамические механизмы, в том числе и процессы естественной детоксикации. Каким-либо путем попав в кровоток, яд прежде всего связывается с белками крови — альбуминами, a2-глобулинами, иммунными комплексами. Соединение яда с белком уменьшает токсичность яда и дает большой выигрыш во времени для выведения яда или его последующей биотрансформации. Разные яды (как и разные фармакологические препараты) в разной степени связываются с белками, чем, в частности, определяется токсичность (активность) вещества. Некоторые металлы связываются клетками крови, в основном с эритроцитами (более 90 % свинца или мышьяка циркулирует в эритроцитах). Связь яда с белками крови является вторым механизмом естественной детоксикации, поскольку белок препятствует воздействию яда на рецептор токсичности. Биотрансформация ядов Биотрансформация (метаболизм) ядов протекает главным образом в печени. Процесс этот ферментативный и требует энергетического обеспечения. Физиологический смысл биотрансформации заключается в превращении яда в менее токсическое, чем исходное, и водорастворимое вещество, то есть биотрансформация переводит яд в форму, готовую к выведению из организма. На первом этапе биотрансформации, как правило, осуществляются реакции гидроксилирования (они и требуют энергетических затрат), а на втором — реакции конъюгации с глюкуроновой кислотой, сульфатом, ацетилом, метилом, глицином. Если в процессе эволюции популяция постоянно сталкивается с каким-либо веществом (ядом), требующим дезактивации, в генотипе постепенно закрепляется выработка специфического фермента. Такое вещество называется биотиком. Так, например, промежуточным продуктом некоторых метаболических реакций является этанол, и для его обезвреживания в печени имеется специфический фермент алкогольдегидрогеназа. Вещество, с которым популяция в процессе эволюции не встречалась, называют ксенобиотиком. Если ксенобиотик по строению близок к биотику, для его расщепления организм использует фермент, специфичный к биотику, сходному с ксенобиотиком. Так, метанол и этиленгликоль разлагаются алкогольдегидрогеназой, специфичной к этанолу. Однако сродство алкогольдегидрогеназы к метанолу в 8…10 раз ниже, чем к этанолу. Чаще ксенобиотики подвергаются окислению на цитохроме P-450 в печени. К сожалению, иногда биотрансформация протекает с образованием более токсических продуктов, чем исходный яд. Такой вариант биотрансформации называют летальным синтезом. Чаще летальному синтезу подвергаются ксенобиотики.
Примером летального синтеза может служить расщепление метанола под воздействием алкогольдегидрогеназы:
Продукты этого метаболизма (формальдегид и муравьиная кислота) полностью определяют токсичность метанола. Этиленгликоль под действием алкогольдегидрогеназы превращается в щавелевую кислоту, которая также, наряду с другими продуктами распада (глиоксаль и другие), определяет его токсичность. Промежуточным продуктом метаболизма этанола является значительно более токсичный ацетоальдегид. В результате биотрансформации могут образовываться свободные радикалы, запускающие переокисление липидов и повреждающие ферменты. Только этими механизмами удается объяснить чрезвычайно высокую токсичность некоторых ядов (например, четыреххлористого углерода: Нарушения внешнего дыхания Внешнее дыхание осуществляется в легких благодаря трем процессам: вентиляции, диффузии и перфузии. Любой из этих процессов может нарушиться при острых отравлениях, что приведет к развитию острой дыхательной недостаточности (ОДН). Нарушения вентиляции Дыхательный центр угнетается при отравлении снотворными и наркотическими препаратами (опиаты, барбитураты, алкоголь и его суррогаты, дихлорэтан и другие) и при отеке мозга. Как указано выше, причиной отека мозга является его гипоксия. Гипоксия мозга развивается и при угнетении дыхательного центра, а также при отравлении метгемоглобинобразователями (MtHb), карбоксигемоглобинобразователями (COHb), гемолитическими ядами (гемическая гипоксия), при дыхании гипоксической смесью (повышенное содержание в воздухе метана, гелия, азота и т. д.). Функция дыхательных мышц страдает при нарушении их нервной регуляции. Это может быть обусловлено отравлением ФОС и другими антихолинэстеразными ядами, а также никотинокурареподобными веществами. При этом в начале развивается фибрилляция мышц и ригидность грудной клетки, которые затем сменяются глубокой миорелаксацией. Вентиляция нарушается при отравлении так называемыми судорожными ядами (тубазид, стрихнин, этиленгликоль и другие), когда развивается стойкий гипертонус дыхательных мышц. К нарушениям вентиляции приводит обструкция дыхательных путей. Эта причина вентиляционной недостаточности часто встречается при отравлении снотворными и наркотическими веществами, которые вызывают атонию мышц языка и гортани, угнетают кашлевой рефлекс, а будучи, в основном, ваготониками, приводят к гиперсаливации и бронхорее. В этих условиях весьма вероятна регургитация желудочного содержимого с последующей его аспирацией. Особенно выражены ваготонические эффекты при отравлении ФОС, бурная гиперсаливация и бронхорея приводят к “самоутоплению” больных. К обструкции дыхательных путей приводит и пероральное отравление крепкими кислотами и едкими щелочами, так как они вызывают ожог рта, глотки и надгортанника с последующим накоплением вязкого секрета. Ингаляционное отравление парами кислот и щелочей приводит к бронхо- и ларингоспазму. Нарушения диффузии Наиболее частыми причинами нарушения диффузии при острых отравлениях являются острые пневмонии, шоковое легкое и отек легких. Причинами пневмоний являются: перенапряжение недыхательных функций легких при критических состояниях; длительное коматозное состояние; аспирационный синдром; ожог верхних дыхательных путей прижигающими веществами. Отек легких может быть как токсическим, так и следствием острой левожелудочковой недостаточности. Токсический отек легких является следствием поражения альвеолокапиллярной мембраны токсическим веществом. В дальнейшем развивается гиперэргическое воспаление и отек ткани легкого. Чаще всего токсический отек легких наблюдается при ингаляционных отравлениях окислами азота, фосгеном, угарным газом и другими удушающими отравляющими веществами, а также при ингаляции концентрированных паров едких кислот и щелочей (в частности, при пероральных отравлениях). Токсический отек легких протекает в 4 стадии: 1) рефлекторная, 2) скрытая; 3) выраженные клинические проявления; 4) обратное развитие. В рефлекторной стадии отмечается першение в носоглотке, стеснение в груди, брадикардия, учащение дыхания и уменьшение его глубины, инспираторная одышка. Эта стадия обусловлена раздражением окончаний блуждающего нерва в паренхиме легких. В скрытой стадии, или стадии мнимого благополучия, сохраняются нарушения дыхания без субъективных ощущений. Эта стадия длится 4…24 часа. В стадии выраженных клинических проявлений развивается типичная картина отека легких с отделением пенистой мокроты и характерными аускультативными и рентгенологическими симптомами. В этой стадии максимально нарушается диффузия газов через альвеолокапиллярную мембрану. Естественно, нарушается и вентиляция, чему способствует уменьшение растяжимости легких и большое количество мокроты в дыхательных путях и альвеолах. Гемическая гипоксия Этот вид гипоксии развивается при уменьшении количества нормального переносчика кислорода — эритроцитов, содержащих гемоглобин. Гемическую гипоксию вызывают яды, повреждающие гемоглобин (метгемоглобинобразователи, карбоксигемоглобинобразователи) и эритроциты (гемолитические яды). Различного рода анемии тоже обусловливают гемическую гипоксию. Повреждение гемоглобина Метгемоглобин (MtHb) образуется под влиянием производных бензола с амидо- или нитрогруппой и нитритов натрия и калия. MtHb представляет собой гемоглобин, в котором атом железа окислен до 3-валентного состояния и, следовательно, не может соединяться с кислородом. Восстановление железа в 2-валентное состояние происходит очень медленно за счет дегидрирования молочной кислоты в пировиноградную. Нормальное содержание MtHb составляет 2 % от общего количества гемоглобина, при тяжелых отравлениях часть MtHb возрастает до 60…70 %. При этом отмечается серо-синяя окраска видимых слизистых и ногтевых лож, а кровь приобретает характерный "шоколадный" оттенок. Развиваются признаки гипоксической энцефалопатии. Вследствие дегенерации эритроцитов и нарушения их осмотической резистентности на 3…5-е сутки присоединяется гемолиз с гемолитической анемией. Карбоксигемоглобин (COHb) образуется при отравлении оксидом углерода (CO), который содержится в светильном, пороховом, угарном и выхлопных газах. Соединение гемоглобина с CO хотя и обратимое, но весьма стойкое. Реакция образования COHb выглядит следующим образом: HbO2+CO↔HbCO+O2. Количество образующегося COHb прямо пропорционально pCO и обратно пропорционально pO2 во вдыхаемом воздухе. Аффинитет гемоглобина к CO в 250¼300 раз выше, чем к кислороду, поэтому даже при содержании CO во вдыхаемом воздухе 0,1 % половина гемоглобина превращается в COHb. При этом весьма вероятен летальный исход. Кроме того, CO соединяется с железосодержащим тканевым дыхательным ферментом цитохромоксидазой, вследствие чего угнетается тканевое дыхание, то есть присоединяется тканевая гипоксия. Гемолитические анемии Токсикогенные гемолитические анемии развиваются вследствие внутрисосудистого гемолиза. Гемолиз вызывают такие яды, как мышьяковистый водород, фенилгидразин, медный купорос, хинин, фенацетин, сульфаниламиды, некоторые растительные и животные яды. Самой частой причиной является отравление уксусной эссенцией. Выделяют три механизма токсикогенного внутрисосудистого гемолиза. I. Прямое гемолитическое действие ядов. К ядам с этим механизмом действия относятся соединения тяжелых металлов и мышьяка (прямые гемолитики первой группы) и некоторые крепкие органические кислоты (прямые гемолитики второй группы). Типичный представитель первой группы — AsH3. Мышьяковистый водород быстро окисляется до мышьяка за счет кислорода оксигемоглобина. Затем мышьяк соединяется с коллоидами протоплазмы эритроцитов и разрушает их. Кроме того, прямые гемолитики первой группы являются тиоловыми ядами, то есть блокируют SH-группы эритроцитов. Типичный представитель второй группы прямых гемолитиков — уксусная эссенция. Она диссоциирует с образованием водородных ионов, которые вызывают необратимые изменения в состоянии коллоидов. II. Вторичный внутрисосудистый гемолиз, развивающийся при мет- и сульфгемоглобинобразовании (отравление анилином, сульфаниламидами и пр.). В этих случаях гемолиз наступает отсроченно (иногда на 3¼4-е сутки). III. Токсико-аллергический внутрисосудистый гемолиз. При этом типе гемолиза токсины изменяют антигенную структуру эритроцитов, что приводит к образованию антиэритроцитарных антител. Чаще всего этот механизм имеет место при отравлении биологическими ядами (растительные яды, укусы змей и насекомых). Циркуляторная гипоксия Этот вид гипоксии развивается при малом сердечном выбросе, то есть при острой недостаточности кровообращения. Это обусловливает перфузионную дыхательную недостаточность, при которой кровь успевает получить кислорода меньше, чем отдает его тканям. В тканях накапливается CO2, что ускоряет диссоциацию оксигемоглобина. Именно такая ситуация складывается при шоке. Течение шока, как отмечалось выше, может сопровождаться развитием шокового легкого. Это влечет за собой нарушение вентиляции легких (за счет ателектазирования и уменьшения растяжимости ткани легкого) и усугубляет гипоперфузию легких. Поскольку эти процессы в объеме легких протекают неравномерно, говорят о нарушении вентиляционно-перфузионных соотношений. Тканевая гипоксия Тканевая гипоксия при острых отравлениях является результатом действия таких ядов, которые препятствуют утилизации кислорода путем блокады окисления и восстановления цитохромов. Наиболее сильными блокаторами этих процессов являются цианиды, хотя такими свойствами обладают, хотя и в меньшей степени, наркотики, спирты, ацетон и т. д. Цианиды образуют стойкие соединения с дыхательным ферментом цитохромоксидазой. Эти соединения нарушают деятельность дыхательного и сосудодвигательного центров. Блокада цитохромоксидазы миокарда приводит к сердечной недостаточности. Тканевая гипоксия развивается при тяжелом метаболическом ацидозе, поскольку в этих условиях снижается активность дегидрогеназ. Токсическое поражение почек Как и печень, почки при отравлениях могут поражаться как вследствие отравления специфическими (нефротропными) ядами, так и в результате гемодинамических расстройств (почка при шоке и шоковая почка). К нефротропным ядам относят этиленгликоль, щавелевую кислоту, хром, ртуть, свинец, мышьяк. Гемолитические яды (уксусная кислота, мышьяковистый водород, медный купорос) также вызывают нефропатию. Часто нефропатии предшествует поражение печени. В этом случае говорят о гепаторенальном синдроме. Патогенез токсической нефропатии определяется этиологическим фактором. Этиленгликоль и щавелевая кислота вызывают отек нефрона; соли тяжелых металлов связывают белковые сульфгидрильные группы и тем самым нарушают клеточное дыхание нефронов; гемолитические яды освобождают из эритроцитов гемоглобин, который закупоривает нефрон. При гепаторенальном синдроме почки повреждаются свободными аминокислотами (лейцин, тирозин и другие). Конечным результатом этих процессов является ишемия мембран клеток нефронов. Через несколько суток ишемии развиваются необратимые некробиотические изменения в клубочках и канальцах. Клинически выделяют три степени токсической нефропатии. При легкой степени в моче появляется белок, форменные элементы крови, цилиндры. При средней степени присоединяются снижение диуреза и повышение лабораторных показателей функции почек (мочевина, креатинин, калий). О тяжелой нефропатии говорят при развитии острой почечной недостаточности (ОПН). Форсированный диурез Усиление выведения ядов и их метаболитов через почки называют форсированным диурезом. Этот метод эффективен в отношении водорастворимых ядов, слабо связываемых белками крови. Классическая методика форсированного диуреза включает в себя 3 фазы. Первая фаза — водная нагрузка. За 1 час рекомендуют ввести 1…2 л водно-глюкозо-электролитных растворов и, при необходимости, декстранов. Естественно, первой фазе предшествует коррекция нарушений кровообращения, в первую очередь гиповолемии. Вторая фаза — введение диуретиков. Рекомендуются следующие диуретики. Маннитол считается наилучшим осмодиуретиком. Распределяется только во внеклеточной жидкости, не метаболизируется, не реабсорбируется в канальцах почек. Вводится в виде 15…20 % раствора в дозе 1,0…1,5 г/кг. Суточная доза — не более 180 г. Трисамин одновременно является буферным препаратом, повышающим pH плазмы и мочи. При попадании под кожу вызывает некроз, при передозировке — гипогликемию и угнетение дыхательного центра. Вводится в виде 3,66 % раствора в дозе 1,5 г/кг·сут. Мочевина — так называемый условный осмодиуретик. Распределяется во всех водных пространствах организма. Не метаболизируется. Нетоксичен. При высоких концентрациях вводимых растворов раздражает интиму вен. Вводится в виде 30 % раствора в дозе 1,0…1,5 г/кг. При почечной недостаточности введение мочевины не рекомендуется. Фуросемид (лазикс) — сильный салуретик, действующий благодаря угнетению реабсорбции ионов Na+, Cl- и K+. Вводится в дозе 100…150 мг. При длительном применении вызывает серьезные электролитные нарушения, в том числе гипокалиемию. Третья фаза — коррекция развившихся нарушений водно-электролитного баланса под лабораторным контролем. Проводя форсированный диурез, следует стремится к тому, чтобы третья его фаза не потребовалась, то есть поддерживать нормальный электролитный состав плазмы на протяжении всей процедуры. В ряде случаев, когда яд не влияет на функции почек, у исходно здоровых лиц достаточно ограничиться первой фазой (водной нагрузкой), с которой здоровые почки и система кровообращения справятся без диуретиков. С помощью форсированного диуреза достаточно эффективно выводятся водорастворимые яды, такие как барбитураты, морфин, ФОС, хинин, пахикарпин, дихлорэтан, соединения тяжелых металлов. В случаях, когда яд прочно связывается с белками и липидами крови (фенотиазины, лепонекс, либриум и др.), эффективность диуретической терапии значительно снижается.
При нарушении техники проведения форсированного диуреза могут развиваться гипергидратация или гипогидратация, гипокалиемия и гипохлоремия. Во избежание тромбофлебита растворы следует вводить в крупные вены (как правило, в верхнюю полую вену). Введение осмодиуретиков более 3 суток может привести к развитию осмотического нефроза и ОПН.
Форсированный диурез противопоказан при острой недостаточности кровообращения и нарушениях функций почек (олигурия, гиперазотемия — креатинин выше 221 мкмоль/л), поскольку при этих состояниях значительно снижается объем фильтрации. По этой же причине метод должен с осторожностью применяться у лиц старше 50 лет. Диализные методы Диализ — это процесс прохождения растворенного вещества, размеры молекул которого не превышают определенных размеров, через полупроницаемую мембрану. Максимальный размер молекул, проникающих через мембрану, определяется размерами пор этой мембраны. Для удаления низкомолекулярных веществ из раствора его помещают по одну сторону мембраны (диализируемый раствор — кровь или плазма), а по другую сторону — чистый растворитель (диализирующий раствор, который готовят в зависимости от имеющихся задач). При необходимости сохранить в диализируемом растворе некоторые вещества (например, K+), их добавляют в определенной концентрации и в диализирующий раствор. Для полного удаления растворенного вещества требуется периодическая смена диализирующего раствора. В качестве полупроницаемой мембраны используют естественные серозные оболочки (брюшина) и искусственные (целлофан, купрофан, полисульфон и др.). Способность веществ проникать через полупроницаемую мембрану называют диализабельностью. Гемодиализ Гемодиализ, применяемый для выведения ядов, должен проводиться как можно скорее, в первые 6 часов токсикогенной фазы (пока яд циркулирует в крови и не успел связаться тканями), поэтому в данном случае гемодиализ называют ранним. Гемодиализ применяется также в соматогенной фазе отравлений в случае развития ОПН как токсического, так и другого генеза (например, шоковая почка). Устройство для проведения диализа называют диализатором, аппарат для проведения гемодиализа — искусственной почкой.
Ранний гемодиализ эффективен в отношении соединений, удовлетворяющих условиям диализабельности: водорастворимость и молекулярная масса менее 5000 Д. Такими веществами являются барбитураты, соединения мышьяка и тяжелых металлов, дихлорэтан, метанол, этиленгликоль, ФОС, хинин и др.
Например, за 1 час гемодиализа из организма выводится столько же барбитуратов, сколько за 25¼30 часов естественным путем с мочой. Клиренс карбофоса составляет 35 мл/мин, хлорофоса — 48 мл/мин, метафоса — 30 мл/мин. При отравлении фенотиазинами и бензодиазепинами вследствие их низкой диализабельности гемодиализ малоэффективен, больший успех достигается методами гемофильтрации и гемодиафильтрации. Гемодиализ противопоказан при острой недостаточности кровообращения и выраженном геморрагическом синдроме.
Осложнениями гемодиализа являются геморрагический синдром, нарушения кровообращения, отек мозга, ознобы.
Перитонеальный диализ Этот метод применяется при невозможности провести гемодиализ (наличие противопоказаний, отсутствие техники). Суть метода заключается в промывании брюшной полости диализирующим раствором. Существует 2 методики проведения перитонеального диализа: непрерывный диализ и дискретный диализ. В первом случае в брюшную полость вводят 2 катетера, через которые осуществляется непрерывный ток диализирующего раствора. Во втором случае в брюшную полость вводят 1 катетер, через который вливают» 2 л раствора, который через определенный промежуток времени (около 20 минут) удаляют. Метод основан на том, что брюшина является природной полупроницаемой мембраной с площадью поверхности» 2 м2. Гипертонический (350…850 мосмоль/л) диализирующий раствор обеспечивает и ультрафильтрацию, что увеличивает клиренс ядов. Гистологические исследования показали, что такие растворы не вызывают патологических изменений в брюшине. Чтобы увеличить клиренс ядов с кислой реакцией (барбитураты и др.), гипертонический диализирующий раствор ощелачивают до pH 7,5…8,4. Если яд обладает свойствами слабых оснований, pH диализирующего раствора снижают до 7,1…7,25. При отравлении ядами с высоким коэффициентом связывания с белками эффективно добавление в диализирующий раствор альбумина. Введение в брюшную полость масляных растворов ускоряет выведение жирорастворимых ядов. Диализирующие растворы перед использованием подогревают до 37¼37,5 °С, при гипотермии — до 39¼40 °С.
Противопоказанием к перитонеальному диализу является выраженный спаечный процесс в брюшной полости и поздние сроки беременности. При отравлениях, сопровождающихся шоком, когда неприменимы другие экстракорпоральные методы детоксикации и форсированный диурез, перитонеальный диализ является практически единственным методом активного выведения яда из организма. Перитонеальный диализ может сопровождаться перитонизмом и гипокалиемией, что требует соответствующего наблюдения и устранения, не представляющего обычно серьезных трудностей.
Наиболее эффективен перитонеальный диализ при отравлении психотропными препаратами (барбитураты, фенотиазины, бензодиазепины и т. д.), хлорированными углеводородами, соединениями тяжелых металлов, суррогатами алкоголя и т. д. Сорбционные методы Гемосорбция Метод основан на адсорбции чужеродных веществ, циркулирующих в крови, на поверхности угольного или другого сорбента (СКН, СКТ-6а, КАУ, СУГС, ФАС). Операцию осуществляют с помощью специального передвижного аппарата, имеющего перфузионный насос роликового типа. Перед операцией катетеризируют две вены (чаще всего подключичные или бедренные в любом сочетании) или накладывают артериовенозный шунт. Забор крови производят из артерии или вены (при вено-венозном пути) с помощью насоса, скорость работы которого можно регулировать (обычно в пределах 25…250 мл/мин). Далее кровь поступает в колонку с сорбентом, где собственно и проис
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 604; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.159.163 (0.022 с.) |






 C
C

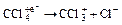 ).
).


