
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення питомої електропровідності електролітів та її залежності від концентрації та температуриСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Прилади: електрохімічний елемент; вольтметр; амперметр; ключ; плитка.
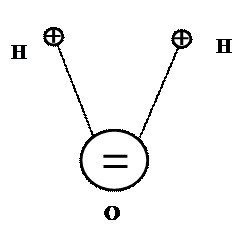
На зорі вивчення електричних явищ дослідники помітили, що електричний струм можуть проводити не тільки метали, але і деякі розчини. Так водний розчин повареної та інших солей, розчини сильних кислот та лугів також проводять струм. При цьому розчини оцтової кислоти, вуглекислого та сірчаного газів – проводять струм гірше. А ось розчини спирту, цукру та більшості інших органічних сполук – зовсім не проводять електричний струм. Англійський вчений Майкл Фарадей ще в 30-ті роки ХІХ сторіччя, вивчаючи закономірності проходження струму через розчини, запровадив в обіг поняття “електроліт”, “електроліз”, “іон”, “катіон” та “аніон”. Електроліт – це речовина, розчин якого проводить електричний струм. Електроліз – виділення на електродах розчинених речовин. Іон – атом речовини, що втратив електрон (позитивний іон), або, навпаки, приєднав додатковий електрон (негативний іон). Катіон – позитивний іон. Аніон – негативний іон Метали називають провідниками першого роду; при проходженні в них струму не відбуваються ніякі хімічні перетворення. В електролітах, які називаються провідниками другого роду, проходження електричного струму супроводжується електролізом – виділенням на електродах розчинених речовин. Процес розпаду молекул на дві або кілька частин називається “дисоціацією”. Процес розпаду речовини на іони при розчиненні її у полярному розчиннику називається “електролітичною дисоціацією”. Спочатку вважалося, що причиною електролітичної дисоціації є електричний струм, який проходить через розчин. Проте пізніше було встановлено, що дисоціюють молекули у розчиннику незалежно від того, проходить, чи не проходить через розчин струм. Згідно з теорією електролітичної дисоціації, (С.Ареніус та В. Оствальд, 1887) кожна молекула солей, кислот, луг, будується з двох іонів з протилежними по знаку та рівними за величиною зарядами. Розглянемо більш детально процес електролітичної дисоціації. Зазвичай, розчинником є вода. Її молекули складаються з атома кисню і двох атомів водню. Заряд атома кисню дорівнює за модулем заряду двох атомів водню, але геометричні розміри в них суттєво різні (рис.5.1). Завдяки цьому молекули води поляризовані, тобто вони є диполями.
Рис.5.1. Молекула води.
При взаємодії води з речовиною відбувається явище гідратації – приєднання молекул води до молекул або іонів. Процес гідратації починається з орієнтації диполів води навколо усіх виступів і граней кристалів солі. Орієнтуючись навколо іонів кристалічної решітки, молекули води утворять із ними або водневі, або донорно-акцепторні зв'язки. При цьому процесі виділяється велика кількість енергії, що називається енергією гідратації. Енергія гідратації, величина якої більша в порівнянні з енергією кристалічної решітки, йде на руйнування останньої. При цьому гідратовані іони речовини шар за шаром переходять у воду і, перемішуючись із її молекулами, утворять розчин.
Процес гідратації легко показати на прикладі полярної речовини (наприклад HCl): навколо кожної полярної молекули речовини певним чином орієнтуються диполі води (рис.5.2).
Рис.5.2. Молекула HCl
У результаті взаємодії з диполями води полярна молекула ще більше поляризується і перетворюється в іонну, далі вже легко утворюються вільні гідратовані іони. Після дисоціації іони знову можуть об’єднатися в нейтральні молекули. Цей процес має назву рекомбінація. Зазвичай процеси дисоціації і рекомбінації відбуваються одночасно. При цьому у розчині встановлюється динамічна рівновага, і число іонів в одиниці об’єму (концентрація) буде залишатися постійним. Важливою характеристикою процесу дисоціації є безрозмірна величина, яка має назву – ступінь дисоціації, і, зазвичай, позначається літерою a. Вона чисельно дорівнює відношенню числа молекул, що розпались на іони, до числа всіх молекул. Ступінь електролітичної дисоціації залежить від температури розчину. Зазвичай, при збільшенні температури ступінь дисоціації зростає. У випадку іонних речовин це пояснюється тим, що при збільшенні температури розчину, збільшується амплітуда коливань атомів у вузлах кристалічної решітки, і середня відстань між ними збільшується. Завдяки цьому зв’язки між ними слабшають і потрібно менше енергії на руйнування решітки. Тобто більша кількість гідратованих іонів перейде у розчин. У випадку полярних речовин, збільшується відстань між іонами у молекулі речовини. При цьому молекули води мають більшу можливість “екранувати” іони один від одного (рис.5.3), тому кількість молекул, які розпались на іони, збільшується.
Рис.5.3. Розрив молекулярних зв’язків молекулами води.
Електричне поле, що виникає в електроліті при прикладенні до електродів різниці потенціалів, викликає спрямований рух іонів (катіонів та аніонів) в електроліті. Таким чином, електричний струм в електролітах зумовлений спрямованим рухом іонів і супроводжується переносом речовини. Величина струму залежить від числа іонів обох знаків в одиниці об’єму та їх швидкостей руху. Тому густина струму (величина струму, що проходить через одиницю площі) дорівнює:
де q - заряд іону; n - концентрація іонів; e - заряд електрона; ƴ e - валентність; u + - дрейфова швидкість позитивних іонів; u - - дрейфова швидкість негативних іонів. Хоча на різні іони в одному й тому ж електричному полі напруженістю Е діє однакова сила F = qE, швидкості їх будуть різні. Ці швидкості будуть залежать від різних факторів, а саме: а) від маси та розміру самого іону; б) від кількості перешкод, що зустрінуться на шляху іона, тобто в’язкості електроліту, тощо. Швидкість іонів пропорційна величині напруженості електричного поля. Коефіцієнт пропорційності між ними має назву рухомість, тобто
Цей коефіцієнт чисельно дорівнює середній швидкості, з якою іони рухаються в полі з напруженістю, що дорівнює У системі одиниць СІ рухомість вимірюється у м2с-1В-1 (у фізиці напівпровідників зазвичай використовують Підсумовуючи вище зазначене, і враховуючи, що
j=n0ƴeea (b++b-)E. (5.3 ) Величина: s = n0ƴeea (b++b-) (5.4)
має назву питома електропровідність електроліту. Вона у багато разів менша ніж у металів. При цьому питома електропровідність значно зростає при зростанні температури розчину, що обумовлено зростанням ступені дисоціації і рухомості іонів. Досягнувши аноду, аніони віддають йому залишковий заряд у вигляді електронів, які переходять у зовнішнє електричне коло. По ньому вони (електрони) рухаються колом до катоду, де приєднуються до катіонів, яким електронів недостає. Внаслідок цих процесів аніони і катіони стають нейтральними молекулами. Завдяки нейтралізації іонів поблизу електродів не виникають великі заряди, які могли би перешкоджати протіканню струму. Внаслідок електролізу (якщо напруга на електродах постійна) на електродах накопичуються продукти хімічного розпаду електроліту, що використовують у промисловості. Схема експериментальної установки приведена на рис. 5.4. Через електрохімічний елемент (склянка з двома електродами) проходить електричний струм І. Сила струму вимірюється амперметром. Знаючи напругу і силу струму, можемо визначити опір електроліту, і його питому електропровідність.
Експериментальна установка.
Рис.5.4. Схема експериментальної установки.
Завдання 1. Зібрати схему згідно рис. 5.4 2. Замкнувши ключ К, записати показання амперметра і вольтметра. Даний пункт виконати не менш трьох разів при різних значеннях сили струму. 3. Виконати вимірювання згідно п. 2 для трьох концентрацій електроліту. 4. Визначити питому електропровідність розчину за формулою
s = X / R,
де X= L / S - стала електрохімічного елементу; L - середня відстань між електродами; S - середня площа електродів, через яку проходить струм; R= U / I - опір розчину. 5. Записати показання амперметра і вольтметра при підвищенні температури від кімнатної до 700. Для цього поставити електрохімічну чарунку на плитку і виміряти температуру термометром. Провести вимірювання та обчислити s через кожні 100. 6. Побудувати графіки s ( n ) і s ( T ) та оцінити помилку вимірювання. Дані вимірювання занести у таблиці:
Контрольні питання
1. Дати визначення коефіцієнта дисоціації. 2. Який механізм дисоціації? 3. Що називається рухомістю іонів? 4. Які величини у виразі для питомої електропровідності (5.4) залежать від концентрації і які від температури та яким чином? 5. Яким чином в даній роботі визначається питома електропровідність розчину? 6. Чому дорівнює стала електрохімічного елементу? В яких одиницях вона виміряється? Література 1. Калашников С.Г. Електрика. -М.: Наука, 1977, с.190-193.
Лабораторна робота № 6
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 647; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.249.119 (0.007 с.) |




 =
=  ++
++  ++
++  -), (5.1)
-), (5.1) . (5.2)
. (5.2) (СІ).
(СІ). ).
). , де n 0 – концентрація розчину, густина струму буде дорівнювати:
, де n 0 – концентрація розчину, густина струму буде дорівнювати:



