Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции электрофильного замещения.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
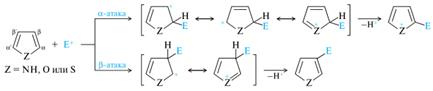
Как π-избыточные соединения, эти гетероциклы легко вступают в реакции с электрофильными реагентами. В незамещенных гетероциклах электрофильная атака осуществляется преимущественно по атому C-2 (α-положение), так как в промежуточно образующемся катионе (σ-комплексе) резонансная стабилизация эффективнее, чем в катионе при атаке β-положения.
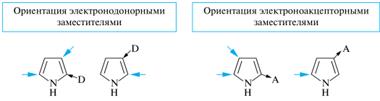
π-Избыточность пятичленных гетероциклов накладывает определенные ограничения на условия проведения реакций с электрофильными реагентами, которые обычно осуществляются в кислой среде. В результате они подвергаются полимеризации, а в водных средах происходит разрыв гетероцикла. (!) Свойство соединений подвергаться глубоким превращениям под действием кислот называют ацидофобностью, а сами гетероциклы — ацидофобными. Тиофен устойчив к действию сильных кислот и не относится к ацидофобным гетероциклам. Многие реакции электрофильного замещения для пиррола и фурана требуют специальных условий, исключающих воздействие сильных кислот. Так, для сульфирования используется пиридинсульфотриоксид, часто обозначаемый С5Н5N•SO3. Бромирование осуществляют действием диоксандибромида С4н8О2•Вг2. В этом случае замещающийся протон связывается диоксаном, что предотвращает разрушающее действие сильных кислот. Для введения нитрогруппы в используют ацетилнитрат — смешанный ангидрид уксусной и азотной кислот. Замещенные пятичленные гетероциклы также вступают в реакции электрофильного замещения, и влияние заместителей на легкость замещения принципиально не отличается от аналогичных реакций карбоциклических соединений, т. е. электронодонорные заместители облегчают реакцию, а электроноакцепторные — замедляют ее.
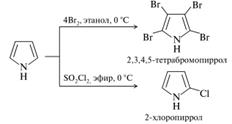
Сульфирование. Пиррол избирательно сульфируется пиридинсульфотриоксидом в α-положение, а если оба α-положения заняты, то атакуется β-атом углерода.
Нитрование. При низких температурах пиррол очень легко нитруется ацетилнитратом.
Галогенирование. Пиррол настолько легко подвергается галогенированию, что без соблюдения специальный условий образуются стабильные тетразамещенные продукты.
Кислотные и основные свойства Пиррол является слабой NH-кислотой и образует соли только со щелочными металлами или с такими сильными основаниями, как гидриды или амиды щелочных металлов, а также при сплавлении с твердым гидроксидом калия (но не натрия). Образующиеся соли легко гидролизуются водой.
Основность пиррола чрезвычайно низка, и значение рКBH+ характеризует основность π-системы гетероцикла, а не атома азота. Представители.
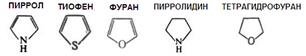
Тиофен. Соединения ряда тиофена — это реагенты для разделения элементов, оптические отбеливатели, физиологически активные соединения. Многие производные — ЛС (антигельминтный препарат комбантрин, модифицированные антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров. Фуран применяют для получения ТГФ, тиофена, пиррола, селенофена и малеинового ангидрида, а также в качестве растворителя и экстрагента масел и жиров. Производные фурана используют как ЛС (фурадонин, фуросемид) и средства защиты растений. Пирролидин обнаружен в табаке и моркови, пирролидиновая структура входит в состав некоторых алкалоидов (никотина) и аминокислот пролина и гидроксипролина. Пирролидиновая структура входит в состав ЛС (пирацетама). Тетрагидрофуран — это растворитель многих соединений; сырье для получения синтетических смол. Это структурный фрагмент некоторых антибиотиков (нактинов, с помощью которых осуществляется транспорт ионов К+ через клеточные мембраны.
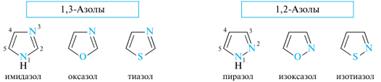
13. Пятичленные гетероциклы с двумя гетероатомами: электронное строение; кислотно–основные свойства, образование ассоциатов; реакции электрофильного замещения в пиразоле и имидазоле. Представители: пиразол, имидазол, тиазол, оксазол. Группу пятичленныгх гетероциклов, которые формально образованы из пиррола, фурана и тиофена путем замены звена —CH= хотя бы одним пиридиновым атомом азота, называют азолами. Частный случай представляют циклы с двумя атомами азота — диазолы. Азолы, содержащие два гетероатома, в зависимости от их взаимного расположения подразделяются на 1,2-азолы и 1,3-азолы. Наиболее значимыми из них являются имидазол, пиразол и тиазол.
Ароматичность. Азолы можно рассматривать как аза-аналоги пиррола, фурана и тиофена, в который звено — CH= (атом C-2 или C-3) заменено фрагментом — N=, т. е. пиридиновым атомом азота. Азолы относятся к 6π-электронным ароматическим соединениям. Так, в пиразоле и имидазоле один из атомов азота (N-1) принадлежит к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один р-электрон (пары электронов гетероатомов, участвующие в сопряжении, показаны цветом). В оксазоле и тиазоле атомы азота принадлежат к пиридиновому типу, а атомы кислорода и серы имеют конфигурацию, подобную пиррольному атому азота. Все четыре гетероцикла изоэлектронны и в сопряжении принимают участие по шесть электронов, т. е. они соответствуют правилу Хюккеля. Кислотные и основные свойства. Азолы обладают основностью благодаря пиридиновому атому азота. Имидазол сильнее пиридина.
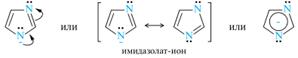
Остальные азолы значительно менее основны имидизола, вследствие сильного электроноакцепторного индуктивного влияния гетероатома в положении 1; особенно это заметно у 1,2-азолов. Кислотные свойства присущи только диазолам — имидазолу и пиразолу, благодаря их NH-кислотному центру. Оба гетероцикла заметно превышают по кислотности пиррол. Причина этого заключается в лучшей делокализации отрицательного заряда в сопряженном основании с участием обоих атомов азота, как показано на примере имидазолат-иона:
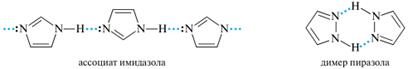
Имидазол и пиразол проявляют амфотерный характер. В кристаллическом состоянии и в неполярных растворителях они образуют межмолекулярные ассоциаты. Ассоциаты имидазола содержат до 20 молекул, а пиразол существует в виде димеров и тримеров:
Неожиданно высокие температуры кипения диазолов по сравнению с оксазолом и тиазолом свидетельствуют о прочных межмолекулярных водородных связях. Диазолы, замещенные по атому N-1 (но не С-производные), не способны образовывать водородные связи и имеют значительно более низкие температуры кипения.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 683; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.195.30 (0.008 с.) |