Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Терпены и терпеноиды: состав, химическое и пространственное строение производных ментана (ментол, терпин), их реакционная способность.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ментол среди спиртов ряда ментана имеет наибольшее значение. Важнейшим источником является эфирное масло мяты перечной. Ментол следует рассматривать как вторичный спирт ряда циклогексана. В устойчивой конформации ментола все три заместителя находятся в экваториальном положении.
Ментол используется в пищевой и парфюмерной промышленности. Медицинское применение ментола весьма разнообразно: он входит в состав мазей, средств для ингаляции. В состав таких известных лекарственных средств, как валокордин, корвалол и валосердин, входит сложный эфир ментола и 2-бромо-3-метилбутановой (α-бромоизовалериановой) кислоты. Валидол является эфиром ментола и изовалериановой кислоты.
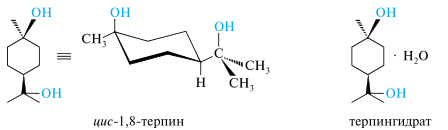
Терпин (ментандиол-1,8) в природных эфирных маслах не содержится, но образуется из других терпеноидов в момент выделения эфирных масел. Терпин существует в виде двух диастереомеров — цис - и транс -форм. Моногидрат цис-1,8-терпина называется терпингидратом и применяется в медицине в качестве отхаркивающего средства. При плавлении терпингидрат теряет кристаллизационную воду и превращается в цис-терпин, из которого на воздухе постепенно снова образуется терпингидрат. Получают терпингидрат синтетически из α-пинена. Терпин получают из α-пинена длительной (10-14 дн.) гидратацией разбавленной серной кислотой при температуре ниже комнатной. Вначале протонируется двойная связь, образующийся бициклический карбокатион перегруппировывается в карбокатион с углеродным скелетом ментана. Затем происходит присоединение воды, отщепление протона и образование α-терпинеола. Далее двойная связь α-терпинеола гидратируется по правилу Марковникова с образованием 1,8-терпина. На последнем этапе образуется гидратная форма терпина — терпингидрат.
41. Терпены и терпеноиды: состав и строение бициклических монотерпенов (a-пинен, борнеол, камфора), их реакционная способность. Бициклические монотерпеноиды также содержатся в эфирных маслах растений, строение их углеродного скелета может быть весьма разнообразным. α-Пинен известен как один из самых распространенных в природе терпеноидов. Пинен входит в состав различных эфирных масел, является главным компонентом скипидаров хвойных растений. В основе пинена лежит бициклический насыщенный углеводород пинан.
В структуре пинена имеется довольно напряженный четырехчленный цикл, поэтому многие реакции пинена по двойной связи сопровождаются перегруппировками углеродного скелета. Пинен, будучи наиболее доступным, используется в качестве исходного соединения для получения других терпеноидов, например терпингидрата и камфоры. Миртеналь — компонент эвкалиптового масла, получается при окислении α-пинена оксидом селена(IV). Это пример региоселективного окисления алкенов по α-атому углерода относительно двойной связи C=C.
Борнеол и камфора — бициклические терпеноиды группы борнана. Борнеол содержится в эфирном масле валерианы, тимьяна, борнейского лавра. В эфирном масле хвои сибирской пихты содержится до 40% левовращающего борнилацетата, который используют для синтеза камфоры. Камфора (борнанон-2) содержится в древесине камфарного лавра. В медицине камфору применяют в основном в качестве антисептического средства.
Камфора — типичный кетон, образует оксим, замещенные гидразоны, но не образует гидросульфитного производного. Образование гидросульфитного производного не происходит из-за пространственных затруднений. В молекуле камфоры кетонная группа соединена со вторичным и четвертичным атомами углерода, и именно последний сильно затрудняет подход к карбонильной группе такого объемного нуклеофила, как гидросульфит-ион. Образование оксима и динитрофенилгидразона используется в фармацевтическом анализе для количественного определения камфоры (качественная реакция).
При бромировании камфоры образуется эндо-3-бромокамфора, которая находит применение в медицине. Реакция протекает регио- и стереоселективно — замещение осуществляется в α-положение относительно кетонной группы и образуется эндо-изомер бромокамфоры. Восстановление камфоры. Камфора может быть восстановлена в борнеол различными методами.
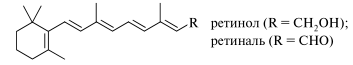
42. Терпены и терпеноиды: классификация по числу изопреновых звеньев; дитерпены и тетратерпены (ретинол, ретиналь, β–каротин) – строение, реакционная способность. Ди- и тетратерпеноиды. Молекулы дитерпеноидов содержат четыре изопреновых звена, молекулы тетратерпеноидов (каротиноидов) — восемь. Ретинол (витамин А) и ретиналь образуются из каротиноидов. Оба соединения принимают участие в зрительном цикле.
β-Каротин является наиболее значимым и распространенным каротиноидом. Он содержится в листьях растений, где совместно с хлорофиллом участвует в фотосинтезе, в большом количестве содержится в моркови, люцерне, гречихе и многих других растениях.
43. Стероиды: родоначальные углеводороды (эстран, андростан, прегнан, холан, холестан); стереоизомерия, цис–транссочленение циклогексановых колец, a–,β–стереохимические ряды. Стероиды представляют собой большую группу природных соединений как животного, так и растительного происхождения, объединяемую общностью углеродного скелета и путями биогенеза. В основе стероидов лежит полициклическая система гонана. Стероиды делятся на следующие группы: • стерины; • желчные кислоты; • кортикостероиды (гормоны коры надпочечников); • женские половые гормоны; • мужские половые гормоны; • агликоны сердечных гликозидов.
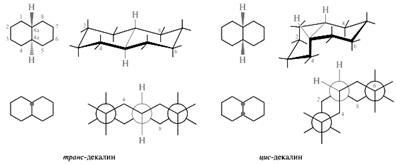
Стереоизомерия. Для обозначения конфигурации асимметрических атомов углерода используется α,β-система. Суть ее состоит в том, что лиганды, расположенные перед условно плоским гонановым скелетом, обозначаются буквой β, а те, которые располагаются за плоскостью, — буквой α. Непременным условием является то, что при написании формулы кольца А и В при этом должны находиться в левом нижнем квадранте, а кольца С и D — в правом верхнем. Связи с β-лигандами обозначаются сплошными линиями, связи с α-лигандами — штриховыми. Необходимо отметить, что α- и β-заместители могут занимать в циклогексановых кольцах как аксиальные, так и экваториальные положения. Конфигурация хиральных центров в боковых цепях стероидов обозначается по R,S-системе. В большинстве стероидов насыщенные циклогексановые кольца в гонановом скелете находятся в форме кресла. Кольца А, В, С и D имеют общие связи и могут быть сочленены двумя способами — по транс- и по цис-типу. Порядок сочленения циклогексановых колец можно рассмотреть на простой модели, в качестве которой обычно используют декалин. Декалин существует в виде двух диастереомеров: транс- и цис-декалинов. В транс-декалине второе кольцо строится при участии двух экваториальных связей первого кольца; при этом атомы водорода у узловых третичных атомов углерода занимают относительно друг друга анти-положение и оказываются по разные стороны условно плоского углеродного скелета.
В цис-декалине построение второго кольца происходит за счет одной аксиальной и одной экваториальной связи первого кольца; при этом атомы водорода у атомов углерода С-4а и С-8а оказываются в синклинальном положении и по одну сторону условной плоскости, что хорошо видно из рассмотрения трехмерных стереохимических и сдвоенных проекционных формул Ньюмена.
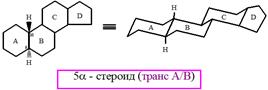
транс-Декалин является конформационно жесткой системой, в цис-декалине синхронно осуществляется инверсия циклогексановых колец. В стероидах встречаются различные комбинации сочленения колец. Кольца А и В могут быть сочленены как по цис-, так и по транс-типу. Оба типа сочленения встречаются в природных стероидах. Кольца В и С почти всегда сочленены по транс-типу. Сочленение колец С и D обычно осуществляется по транс-типу, однако может встретиться и цис-сочленение, например в агликонах сердечных гликозидов. Чаще всего в основе природных стероидов лежат системы 5α- и 5β-гонана.
Как 5α-, так и 5β-гонаны представляют собой жесткие каркасные структуры, в которых не происходят конформационные превращения. Номенклатура. Специфика номенклатуры стероидов состоит в том, что в основе их названий лежат стереородоначальные углеводородные структуры гомологов гонана: холан, холестан, прегнан и др. В полусистематических названиях указанных насыщенных углеводородов заложено не только строение, но и конфигурация асимметрических атомов в конденсированной системе и положение боковых цепей (α или β).
В названиях стероидов необходимо отражать порядок сочленения колец А и В, т. е. конфигурацию атома С-5. Конфигурация хиральных центров в полициклической системе обозначается помещением букв α или β перед соответствующими префиксами или после суффиксов. В остальном построение названий проводится по общим правилам заместительной номенклатуры. 44. Стероиды: производные холестана (стерины) – холестерин, эргостерин, витамин D2: номенклатура, строение, характеристика реакционной способности.
В основе стеринов лежат следующие углеводороды: холестан (С27), эргостан (С28) и стигмастан (С29). Различают зоостерины, микостерины и фитостерины. Структурными особенностями стеринов являются: • наличие разветвленного алкильного радикала С8—С10 в положении 17; • наличие гидроксильной группы у атома С-3. Важнейшим зоостерином является холестерин. Холестерин — основной стерин высших животных — встречается также в растениях и микроорганизмах; в основе его лежит углеводород холестан.
В животных организмах холестерин содержится в свободном виде или в виде сложных эфиров с карбоновыши кислотами, в том числе и с высшими. Холестерин или его сложные эфиры участвуют в построении клеточных мембран. Основное количество холестерина (-80%) человеческий организм синтезирует из ацетилкофермента А и лишь около 20% получает с пищей. Эндогенный и алиментарный холестерин используется организмом для синтеза гормонов и желчнык кислот. Излишек холестерина выводится из организма главным образом через пищеварительный тракт, в небольшом количестве холестерин экскретируется через сальные железы. Нарушение обмена холестерина приводит к отложению его на стенках кровеносных сосудов, что является одной из причин атеросклероза. Получают холестерин из спинного мозга животных и из ланолина (жироподобного вещества, смываемого с овечьей шерсти), используют для синтеза стероидных гормонов и витамина D3. Эргостерин — важнейший представитель микостеринов (стеринов грибов и простейших) — имеет в своей структуре 28 атомов углерода. Эргостерин является предшественником эргокальциферола (витамина D2), последний образуется из эргостерина в результате фотохимической изомеризации. Аналогичным образом из 7-дегидрохолестерина (холестадиен-5,7-ола-3β) синтезируется холекальциферол (витамин D3).
Изомеризация провитаминов D происходит в коже человека под действием солнечных лучей в несколько стадий, причем каждая из них инициируется светом с определенной длиной волны. В результате реакции раскрывается кольцо В и образуется дополнительная двойная связь. Витамины группы D регулируют фосфорно-кальциевый обмен, недостаток витамина D является причиной возникновения рахита у детей. В промышленности эргостерин получают из дрожжей экстракцией органическим растворителем. 7-Дегидрохолестерин получают из холестерина двухстадийным синтезом. Вначале холестерин бромируют в аллильное положение по радикальному механизму, затем полученный бромид подвергают элиминированию.
Кальциферолы получают облучением провитаминов УФ-светом в органическом растворителе.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1954; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.105.152 (0.012 с.) |