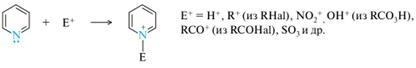Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производные пятичленных азотсодержащих ароматических гетероциклов: пиразолон и его таутомерия, лекарственные средства на основе пиразолона–3; гистидин, гистамин, бензимидазол, дибазол.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пиразолоны. Среди производных пиразола важное место занимают 5-гидроксипиразолы. Они существуют в нескольких таутомерных формах; три наиболее устойчивые ниже. В неполярных растворителях преобладает CH2-таутомер с некоторым количеством NH-формы; эти формы имеют название пиразолоны. В водной среде основным является NH-таутомер (с примесью OH-формы).
В медицине применяется ряд лекарственных средств, в основе которых лежит структура пиразолона-3. Наиболее известные из них — анальгин и диоксоаналог бутадион, обладающие противовоспалительным действием. Одним из первых синтетических анальгетиков, известным с 1884 г., был антипирин.
Имидазол — структурный фрагмент витамина белковой аминокислоты гистидина и ее метаболита — биогенного амина гистамина, а также некоторый лекарственный средств.
Дибазол – лекарственный препарат группы периферических вазодилататоров. Препарат оказывает выраженное сосудорасширяющее действие, способствует снижению давления, обладает спазмолитическим эффектом. Шестичленные гетероциклы: электронное строение; основные и нуклеофильные свойства пиридина и пиримидина, лактим–лактамная таутомерия гидроксипроизводных пиридина. Представители: пиридин, хинолин, изохинолин, пиримидин. Основные свойства пиридина. Неподеленная пара электронов атома азота в пиридине находится на sp2-гибридной орбитали и не участвует в сопряжении, поэтому пиридин проявляет основные свойства и с сильными кислотами образует кристаллические пиридиниевые соли.
Соли пиридиния сохраняют ароматический характер, так как протонирование осуществляется за счет неподеленной пары электронов, не участвующей в образовании ароматического секстета. Для замещенных пиридинов в основном соблюдаются общие закономерности: электронодонорные заместители увеличивают основность, а электроноакцепторные понижают ее. Нуклеофильные свойства пиридина: Пиридиновый атом азота способен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства. Реакции с электрофильными реагентами. В молекуле пиридина имеется два реакционных центра, способных принимать атаку электрофильными реагентами: • атом азота с неподеленной парой электронов; • π-электронная система ароматического кольца. Присоединение к атому азота. Помимо протона, атом азота может присоединять и другие электрофильные частицы, превращаясь в катион пиридиния. Алкилирование. Получаемые при этом N-алкилпиридиниевые соли сохраняют ароматическим характер, так как в результате реакции ароматическим секстет электронов не нарушается.
Ацилирование. Образуются N-ацилпиридиниевые соли (они гидролизуются влагой воздуха).
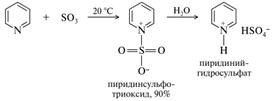
Сульфирование. Образуется пиридиний-1-сульфонат, более известный под названием пиридинсульфотриоксид - весьма реакционноспособное соединение, гидролизующееся горячей водой.
Нитрование. Образующееся при этом N-нитропроизводное применяется в качестве мягкого нитрующего реагента некислотного характера, как показано на примере нитрования бензола:
Замещение по атомам углерода. Хотя электрофильные реагенты атакуют в первую очередь нуклеофильный атом азота, такие реакции часто обратимы и даже в кислых средах присутствует небольшое количество свободного основания. Поэтому реакции электрофильного замещения в ряду пиридина возможны, но протекают в жестких условиях и настолько затруднены, что некоторые из известных реакций этого типа вовсе не идут с пиридинами. Предпочтительная атака электрофилом β-положения объясняется не только распределением электронной плотности в статическом состоянии, но и большей стабильностью образующегося при β-атаке α-комплекса.
Нитрование. Пиридин нитруется в ядро в очень жестких условиях.
Сульфирование. Пиридин очень устойчив к действию концентрированной серной кислоты и олеума. Сульфирование протекает значительно легче в присутствии каталитических количеств солей ртути(П) или хлорида алюминия.
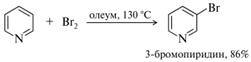
Галогенирование. Бромирование пиридина успешно осуществляется в присутствии олеума.
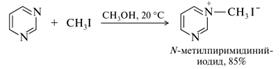
Азины. Ненасыщенные шестичленные гетероциклы, содержащие один или более атомов азота, называются азинами. Представители с двумя атомами азота классифицируются как диазины. Изомерные диазины — пиридазин, пиримидин и пиразин — представляют собой устойчивые соединения, однако в свободном виде они в природе не встречаются. Диазины содержат по два атома азота пиридинового типа и обладают основными свойствами. Однако основность диазинов значительно ниже, чем пиридина, поскольку второй атом азота выступает в роли электроноакцептора по отношению к первому. Протонирование диазинов осуществляется только в очень сильных кислотах, и соли образуются с участием лишь одного атома азота. Нуклеофильный характер диазинов проявляется в реакции с алкилгалогенидами, которая приводит к образованию четвертичных солей (здесь и далее в качестве примеров использован пиримидин — наиболее значимый и изученный из диазинов). Диазины вступают в эту реакцию труднее, чем пиридин.
Вследствие электроноакцепторного характера атомов азота понижена реакционная способность диазинов и в реакциях электрофильного замещения. Незамещенные диазины еще менее активны, чем пиридин, и не подвергаются сульфированию, нитрованию и многим другим реакциям замещения. Известны лишь некоторые реакции галогенирования. Так, бромирование пиримидина приводит к замещению положения 5, которое равноценно β-положению в ядре пиридина и дезактивировано в меньшей степени, чем положения 2, 4 или 6.
Гидроксипиридины. Для всех трех изомерных гидроксипиридинов характерно явление таутомерии. 2- и 4-Гидроксипиридинам таутомерны их оксоформы, которые называются соответственно пиридон-2 и пиридон-4. В полярных растворителях и в кристаллическом состоянии пиридонные формы, исходя из спектральных данных, явно преобладают, что связано с большим сродством к протону атома азота, нежели атома кислорода.
3-Гидроксипиридин в растворе находится в равновесии со своим диполярным ионом. Несмотря на существенные различия в строении рассмотренных изомеров, их часто объединяют одним названием — гидроксипиридины.
Поскольку пиридон-2 является типичным лактамом (циклическим амидом), а его гидроксиформа включает таутомер амидной группы — лактимную группировку —C(=NR)ОH, то такое равновесие называют лактим-лактамной таутомерией. Этот вид таутомерии характерен не только для 2-гидрокси-пиридина, но и для других гетероциклических систем, содержащих гидроксильную группу у атома углерода, соседнего с пиридиновым атомом азота.
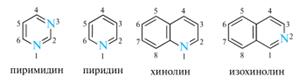
Представители.
Пиридин и его производные — основа пиридиновых алкалоидов, а также многих ЛС. Используют пиридин также в синтезе красителей, инсектицидов, применяют для денатурации спирта. Пиридин — хороший растворитель, в т.ч. для многих неорганических солей. Токсичен, вдыхание его паров приводит к поражению нервной системы. Хинолин — высококипящий слабоосновный растворитель. Производные хинолина - основа производства многих лекарственных препаратов (энтеросептола, аминохинола, трихомонацида, хиноцида), а также цианиновых красителей. Ядро хинолина входит в состав хинолиновых алкалоидов. Изохинолин. Изохинолин — исходный продукт при синтезе сенсибилизирующих красителей (изохинолинового красного) и ЛС. Ядро изохинолина входит в состав изохинолиновых алкалоидов. 16. Шестичленные гетероциклы с одним гетероатомом: реакции электрофильного и нуклеофильного замещения пиридина (муть) и хинолина, условия проведения; 8–гидроксихинолин и его производные, применяемые в медицине. Одно из существенных отличий пиридина от бензола состоит в проявлении основных свойств с образованием устойчивых солей. Пиридиновый атом азота способен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства.
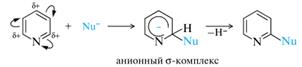
Другое отличие заключается в пониженной активности пиридина и его производных в реакциях электрофильного замещения и одновременно в большей активности в реакциях нуклеофильного замещения, что не свойственно бензолу. Направление атаки обусловлено неравномерным распределением электронной плотности в кольце. Электрофильные реагенты атакуют β-положения (атомы С-3 и С-5), нуклеофильные реагенты — α- и γ-положения (С-2, С-4, С-6).
Электрофильное замещение в пиридине осуществляется с трудом и с невысокими выходами продуктов. Реакции с электрофильными реагентами. В молекуле пиридина имеется два реакционных центра, способных принимать атаку электрофильными реагентами: • атом азота с неподеленной парой электронов; • π-электронная система ароматического кольца. Реакции с нуклеофильными реагентами. В общем виде:
К реакциям нуклеофильного замещения относятся реакции аминирования, гидроксилирования и алкилирования (арилирования), т. е. непосредственного введения нуклеофильных групп в кольцо пиридина или его гомологов. Аминирование. Прямое введение аминогруппы в пиридиновое ядро, называемое реакцией Чичибабина, представляет собой наиболее типичный пример нуклеофильного замещения. Реакцию обычно проводят при нагревании пиридина и амида натрия или калия в безводных апротонных растворителях. В обоих случаях с высокой избирательностью атакуется α-положение, а когда оба α-положения заняты, то образуется γ-изомер, но с меньшим выходом.
Реакция аминирования находит широкое применение, поскольку из аминопиридинов могут быть легко получены разнообразные производные пиридина. Гидроксилирование. Реакция протекает в очень жестких условиях и с низким выходом продукта, поскольку нуклеофильность гидроксид-иона ниже, чем амид-иона. Практическое значение этой реакции невелико.
Алкилирование и арилирование. Такие сильные нуклеофильные реагенты, как литийорганические соединения, легко присоединяются к пиридину, образуя соли 1,2-дигидропиридина, которые иногда даже могут быть выделены в индивидуальном состоянии. Возврат к ароматической системе путем отщепления гидрид-иона достигается термически или действием окислителя.
Как и в реакции Чичибабина, замещение происходит преимущественно в положения 2 или 2,6 (с избытком реагента). Хинолин и представляют собой изомерные конденсированные системы пиридина и бензола, различающиеся способом сочленения колец. Будучи изоэлектронными нафталину, оба гетероцикла сочетают в себе химические свойства пиридина и нафталина. Основные и нуклеофильные свойства. Основность и нуклеофильные свойства хинолина и изохинолина, как и пиридина, обусловлены неподеленной парой электронов атома азота, не участвующей в сопряжении. С сильными кислотами хинолин образует соли, а с алкилгалогенидами — четвертичные соли N-алкилхинолиния:
Реакции электрофильного замещения. Из двух ароматических колец хинолина гетероциклическое кольцо является π-недостаточным, следовательно, электрофильной атаке, особенно в сильнокислых средах, подвергается бензольное ядро. По тем же причинам, что и для нафталина, преимущественно атакуются атомы С-5 и С-8, т. е. соседние с местами сочленения циклов.
В целом реакции электрофильного замещения для хинолина протекают значительно легче, чем для пиридина, но гораздо труднее, чем для нафталина. При действии на хинолин нитрующей смеси с высоким выходом образуются изомерные нитропроизводные:
Галогенирование хинолина представляет собой достаточно сложный процесс, результат которого во многом зависит от условий. Так, при действии брома в концентрированной серной кислоте при нагревании получается смесь 5-бромо- и 8-бромохинолинов в соотношении ~1:1. Неожиданный продукт замещения в пиридиновое кольцо образуется при кипячении хинолина с бромом в отсутствие сильных кислот:
При сульфировании хинолина концентрированной серной кислотой (при температуре 220 °С) или олеумом (при 90 °С) образуется главным образом 8-сульфоновая кислота.
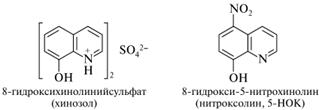
Из последней щелочным плавлением получают 8-гидроксихинолин (оксин). Оксин широко применяется в аналитической химии как реагент, связывающий ионы многих металлов в виде плохо растворимых в воде хелатных соединений. Сам оксин (в виде сульфата — препарат хинозол) и его производное нитроксолин используют в медицине как противомикробные средства. Полагают, что их действие основано на связывании ионов Со2+, необходимых для жизнедеятельности бактерий.
Реакции нуклеофильного замещения. Прямое введение аминогруппы действием амида натрия приводит к продукту замещения преимущественно в положение 2, подобно тому, как это отмечено для пиридина.
Гидроксилирование хинолина достигается нагреванием с расплавленным гидроксидом калия и протекает как 1,2-присоединение. Конечный продукт представляет собой более устойчивую лактамную форму 2-гидроксихинолина.
17. Шестичленные гетероциклы с одним гетероатомом: гомологи пиридина; a–,β–,g–пиколины и их окисление; никотиновая и изоникотиновая кислоты; амид никотиновой кислоты (витамин РР), гидразид изоникотиновой кислоты (изониазид). По химическому поведению многие производные пиридина принципиально не отличаются от аналогичных производных бензольного ряда. Алкилпиридины. Низшие гомологи пиридина имеют тривиальные названия: метилпиридины называются пиколинами (соответственно α-, β- и γ-пиколины).
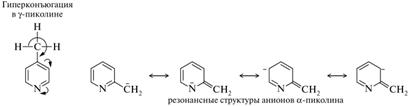
Характерным свойством алкилпиридинов является подвижность атомов водорода при атоме углерода, непосредственно связанном с циклом, или, иными словами, CH-кислотность в месте присоединения алкильной группы к кольцу. Способность отщеплять протон в ряду изомерных пиколинов падает в ряду: γ > α >> β. При действии сильных оснований 2- и 4-алкилпиридины превращаются в анионы, способные выступать в качестве нуклеофильных реагентов. Реакция с алкилгалогенидами приводит к удлинению боковой цепи пиридина, причем вместе с алкильной группой могут быть введены и некоторые функциональные группы
Окислительное расщепление. Пиридиновое кольцо, подобно бензольному, устойчиво к действию окислителей при обычных температурах. Было показано, что окисление перманганатом в щелочной среде приводит к разрыву пиридинового кольца, а в кислой среде легче разрывается бензольное кольцо. Боковые цепи алкилпиридинов окисляются легче самого цикла с образованием соответствующих карбоновых кислот, аналогично тому, как это происходит с гомологами бензола. Этим способом в промышленном масштабе из β-пиколина получают никотиновую кислоту, которая, как и ее амид, является Vit PP. Ряд других производных никотиновой кислоты также применяют в медицине, например стимулятор ЦНС кордиамин (N,N-диэтиламид) и желчегонное средство никодин (N-гидроксиметиламид).
Окисление γ-пиколина приводит к образованию изоникотиновой кислоты — промежуточного продукта синтеза противотуберкулезных препаратов изониазида и фтивазида, антидепрессанта ниаламида, представляющих собой гидразид или замещенные гидразиды изоникотиновой кислоты.
18. Шестичленные кислородсодержащие гетероциклы с одним гетероатомом: неустойчивость a– и g–пир а нов; a– и g–пир о ны, соли пирилия, их ароматичность. Бензопироны: хромон, кумарин, флавон, флавоноиды (лютеолин, кверцетин). Производные кислородсодержащих гетероциклов — пиранов. К ненасыщенным шестичленным гетероциклам с одним атомом кислорода относятся 2Н-пиран и 4Н-пиран, называемые также α-пираном и γ-пираном соответственно:
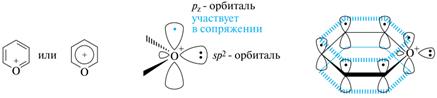
Пираны по структурным критериям не относятся к ароматическим соединениям, хотя в их молекулах можно вычленить р,π-сопряженные участки и число электронов, принимающих участие в сопряжении, равно шести (число Хюккеля). В целом же единое сопряжение в молекуле отсутствует, так как один из атомов углерода находится в sp3-гибридном состоянии. Поэтому оба гетероцикла неароматичны, а напротив, являются термодинамически нестабильными и чрезвычайно реакционноспособными ненасыщенными соединениями. В то же время известны и встречаются в природе устойчивые соединения пиранового ряда, обладающие в некоторой степени ароматическими свойствами. К ним относятся соли пирилия и оксопроизводные пиранов — пироны. По структурным признакам пирилий-катион отвечает критериям ароматичности. Неподеленная пара электронов атома кислорода занимает sр2-гибридную орбиталь, лежащую в плоскости кольца. Негибридизованная р-орбиталь располагается параллельно р-орбиталям атомов углерода и образует с ними единое делокализованное облако. Можно сказать, что пирилий-катион изоэлектронен пиридину и бензолу.
Среди оксопроизводных пиранов различают α-пирон (2H-пиранон-2) и γ-пирон (4H-пиранон-4). В обеих молекулах все атомы находятся в sp2-гибридном состоянии и, следовательно, можно говорить о сопряжении электронов π-связей цикла с неподеленной парой электронов кислорода кольца и с карбонильной группой. Такой вид делокализации электронного облака системы придает ей частично ароматический характер, поэтому пироны относят иногда к псевдоароматическим соединениям.
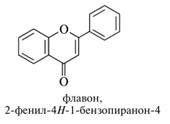
Производные бензопирана. Конденсированная система бензольного и пиранового колец широко представлена в природных соединениях. В настоящее время для таких соединений все чаще используются систематические названия — бензопираны. Это хромены (2Н- и 4Н-изомеры) — ненасыщенные и хроманы —соединения с насыщенным гетероциклом. Оксопроизводное бензопиранов — хромон. Особую группу бензопиранов составляют флавоноиды. Это производные флавана — 2-фенил-замещенного хромана. Оксопроизводными флавана являются флаванон и его ненасыщенный аналог флавон.
Производные флавона и флаванона составляют основную группу флавоноидов. К их числу относятся кверцетин и лютеолин:
Хромены являются неустойчивыми соединениями, тогда как их многочисленные оксопроизводные и бензопирилиевые соли играют важную роль в жизнедеятельности растений. Среди производных много веществ, обладающих различными видами биологической активности. Кумарины. Гетероциклический фрагмент молекулы кумарина скорее напоминает ненасыщенное соединение, чем псевдоароматическую систему. В некоторых реакциях кумарины ведут себя как ароматические соединения. Кумарин и его производные, в том числе конденсированные с другими циклами, встречаются во многих растениях, как в свободном виде, так и в связанном — с остатками углеводов. Кумарины входят во многие виды лекарственного растительного сырья.
Синтетические лекарственные средства на основе кумарина немногочисленны. Упомянем два из них — неодикумарин и фепромарон, используемые как антикоагулянты крови.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 984; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.87.145 (0.016 с.) |