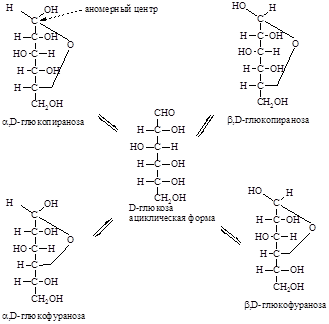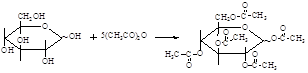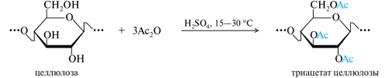Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моносахариды: окисление в гликоновые, гликаровые и гликуроновые кислоты; представители – D–глюконовая, D–глюкуроновая, D–галактуроновая кислоты; аскорбиновая кислота (витамин С).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
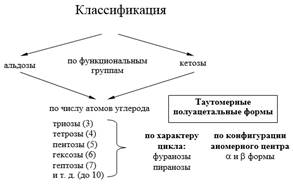
Специальные разделы курса 1. Моносахариды: классификация; стереоизомерия, D– и L–ряды; открытая и циклические формы на примере D–глюкозы и 2–дезокси–D–рибозы, цикло–оксотаутомерия; мутаротация. Представители: D–ксилоза, D–рибоза, D–глюкоза, 2–дезокси–D–рибоза, D–глюкозамин. Углеводы — гетерофункциональные соединения, являющиеся альдегидо- или кетономногоатомными спиртами или их производными. Класс углеводов включает разнообразные соединения — от низкомолекулярных, содержащих от 3 до 10 атомов углерода до полимеров с молекулярной массой в несколько миллионов. По отношению к кислотному гидролизу и по физико-химическим свойствам они подразделяются на три большие группы: моносахариды, олигосахариды и полисахариды.
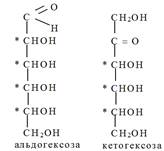
Моносахариды (монозы) — углеводы, неспособные подвергаться кислотному гидролизу с образованием более простых сахаров. Монозы классифицируют по числу углеродных атомов, характеру функциональных групп, стереоизомерным рядам и аномерным формам. По функциональным группам моносахариды подразделяются на альдозы (содержат альдегидную группу) и кетозы (содержат карбонильную группу).
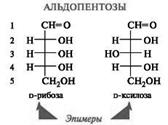
По числу углеродных атомов в цепи: триозы (3), тетрозы (4), пентозы (5), гексозы (6), гептозы (7) и т. д. до 10. Наиболее важное значение имеют пентозы и гексозы. По конфигурации последнего хирального атома углерода моносахариды делятся на стереоизомеры D- и L-ряда. В обменных реакциях в организме принимают участие, как правило, стереоизомеры D-ряда (D-глюкоза, D-фруктоза, D-рибоза, D-дезоксирибоза и др.) В целом название индивидуального моносахарида включает: • префикс, описывающий конфигурацию всех асимметрических атомов углерода; • цифровой слог, определяющий число атомов углерода в цепи; • суффикс - оза — для альдоз и - улоза — для кетоз, причем локант оксо- группы указывают только в том случае, если она находится не при атоме С-2. Строение и стереоизомерия моносахаридов. Молекулы моносахаридов содержат несколько центров хиральности, поэтому существует большое число стереоизомеров, соответствующих одной и той же структурной формуле. Так, число стереоизомеров альдопентоз равно восьми (2n, где n = 3), среди которых 4 пары энантиомеров. У альдогексоз будет уже 16 стереоизомеров, т. е. 8 пар энантиомеров, так как в их углеродной цепи содержится 4 асимметрических атома углерода. Это аллоза, альтроза, галактоза, глюкоза, гулоза, идоза, манноза, талоза. Кетогексозы содержат по сравнению с соответствующими альдозами на один хиральный атом углерода меньше, поэтому число стереоизомеров (23) уменьшается до 8 (4 пары энантиомеров). Относительная конфигурация моносахаридов определяется по конфигурации наиболее удаленного от карбонильной группы хирального атома углерода путем сравнения с конфигурационным стандартом — глицериновым альдегидом. При совпадении конфигурации этого атома углерода с конфигурацией D-глицеринового альдегида моносахарид в целом относят к D-ряду. И, наоборот, при совпадении с конфигурацией L-глицеринового альдегида, считают, что моносахарид принадлежит к L-ряду. Каждой альдозе D-ряда соответствует энантиомер L-ряда с противоположной конфигурацией всех центров хиральности. (!) Положение гидроксильной группы у последнего центра хиральности справа свидетельствует о принадлежности моносахарида к D-ряду, слева — к L-ряду, т. е. так же, как и в стереохимическом стандарте — глицериновом альдегиде.
Природная глюкоза является стереоизомером D-ряда. В равновесном состоянии растворы глюкозы обладают правым вращением (+52,5º), поэтому глюкозу иногда называют декстрозой. Название виноградный сахар глюкоза получила в связи с тем, что ее больше всего содержится в соке винограда. Эпимерами называются диастереомеры моносахаридов, различающиеся конфигурацией только одного асимметрического атома углерода. Эпимером D-глюкозы по С4 является D-галактоза, а по С2 — манноза. Эпимеры в щелочной среде могут переходить друг в друга через ендиольную форму, и этот процесс называется эпимеризацией.
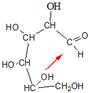
Таутомерия моносахаридов. Изучение свойств глюкозы показало: 1) спектрах поглощения растворов глюкозы отсутствует полоса, соответствующая альдегидной группе; 2) растворы глюкозы дают не все реакции на альдегидную группу (не взаимодействуют с NaHSО3 и фуксинсернистой кислотой); 3) при взаимодействии со спиртами в присутствии «сухого» НСl глюкоза присоединяет, в отличие от альдегидов, только один эквивалент спирта; 4) свежеприготовленные растворы глюкозы мутаротируют в течение 1,5–2 часов меняют угол вращения плоскости поляризованного света.
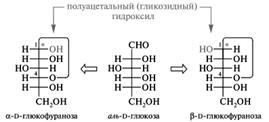
Циклические формы моносахаридов по химической природе являются циклическими полуацеталями, которые образуются при взаимодействии альдегидной (или кетонной) группы со спиртовой группой моносахарида. В результате внутримолекулярного взаимодействия (АN механизм) электрофильный атом углерода карбонильной группы атакуется нуклеофильным атомом кислорода гидроксильной группы. Образуются термодинамически более устойчивые пятичленные (фуранозные) и шестичленные (пиранозные) циклы. Образование этих циклов связано со способностью углеродных цепей моносахаридов принимать клешневидную конформацию.
Представленные ниже графические изображения циклических форм называются формулами Фишера (можно встретить и название «формулы Колли—Толленса»).
В этих реакциях С1 атом из прохирального, в результате циклизации, становится хиральным (аномерный центр). Стереоизомеры, отличающиеся конфигурацией атома С-1 альдоз или С-2 кетоз в их циклической форме, называются аномерами, а сами атомы углерода называются аномерным центром. Группа ОН, появившаяся в результате циклизации, является полуацетальной. Она называется еще гликозидной гидроксильной группой. По свойствам она значительно отличается от остальных спиртовых групп моносахарида. Образование дополнительного хирального центра приводит к возникновению новых стереоизомерных (аномерных) α- и β-форм. α-Аномерной формой называется такая, у которой полуацетальный гидроксил находится с той же стороны, что и гидроксил у последнего хирального центра, а β-формой — когда полуацетальный гидроксил находится по другую сторону, чем гидроксил у последнего хирального центра. Образуется 5 взаимно друг в друга переходящих таутомерных форм глюкозы. Такой вид таутомерии называется цикло-оксо-таутомерией. Таутомерные формы глюкозы находятся в растворе в состоянии равновесия. В растворах моносахаридов преобладает циклическая полуацетальная форма (99,99 %) как более термодинамически выгодная. На долю ациклической формы, содержащей альдегидную группу, приходится менее 0,01 %, в связи с этим не идет реакция с NaHSO3, реакция с фуксинсернистой кислотой, а спектры поглощения растворов глюкозы не показывают наличия полосы, характерной для альдегидной группы. Таким образом, моносахариды — циклические полуацетали альдегидо- или кетоно- многоатомных спиртов, существующие в растворе в равновесии со своими таутомерными ациклическими формами. У свежеприготовленных растворов моносахаридов наблюдается явление мутаротации — изменения во времени угла вращения плоскости поляризации света. Аномерные α- и β-формы имеют различный угол вращения плоскости поляризованного света. Так, кристаллическая α,D-глюкопираноза при растворении ее в воде имеет начальный угол вращения +112,5º, а затем он постепенно уменьшается до +52,5º. Если растворить β,D-глюкопиранозу, ее начальный угол вращения + 19,3º, а затем он увеличивается до +52,5º. Это объясняется тем, что в течение некоторого времени устанавливается равновесие между α- и β-формами: 2/3 β-формы → 1/3 α-формы. Предпочтительность образования того или другого аномера во многом определяется их конформационным строением. Наиболее выгодной для пиранозного цикла является конформация кресла, а для фуранозного цикла — конверта или твист -конформация. Наиболее важные гексозы — D-глюкоза, D-галактоза и D-манноза — существуют исключительно в конформации 4С1. Более того, D-глюкоза из всех гексоз содержит максимальное число экваториальных заместителей в пиранозном цикле (а ее β-аномер — все).
У β-конформера все заместители находятся в наиболее выгодном экваториальном положении, поэтому этой формы в растворе 64 %, а α-конформер имеет аксиальное расположение полуацетального гидроксила. Именно α-конформер глюкозы содержится в организме человека и участвует в процессах метаболизма. Из β-конформера глюкозы построен полисахарид — клетчатка. Формулы Хеуорса. Циклические формулы Фишера удачно описывают конфигурацию моносахаридов, однако они далеки от реальной геометрии молекул. В перспективных формулах Хеуорса пиранозный и фуранозный циклы изображают в виде плоских правильных многоугольников (соответственно шести- или пятиугольника), лежащих горизонтально. Атом кислорода в цикле располагается в удалении от наблюдателя, причем для пираноз — в правом углу.
Атомы водорода и заместители (главным образом, группы СH2OH, если таковая имеется, и он) располагают над и под плоскостью цикла. Символы атомов углерода, как это принято при написании формул циклических соединений, не показывают. Как правило, опускают и атомы водорода со связями к ним. Связи С—С, находящиеся ближе к наблюдателю, для наглядности иногда показывают жирной линий, хотя это не обязательно. Для перехода к формулам Хеуорса от циклических формул Фишера последнюю необходимо преобразовать так, чтобы атом кислорода цикла располагался на одной прямой с атомами углерода, входящими в цикл. Если преобразованную формулу Фишера расположить горизонтально, как требует написание формул Хеуорса, то заместители, находившиеся справа от вертикальной линии углеродной цепи, окажутся под плоскостью цикла, а те, что были слева, — над этой плоскостью.
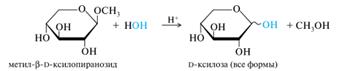
Описанные выше преобразования показывают также, что полуацетальный гидроксил у α-аномеров D-ряда находится под плоскостью цикла, у β-аномеров — над плоскостью. Кроме того, боковая цепь (при С-5 в пиранозах и при С-4 в фуранозах) располагается над плоскостью цикла, если она связана с атомом углерода D-конфигурации, и снизу, если этот атом имеет L-конфигурацию. Представители. D-Ксилоза — «древесный сахар», моносахарид из группы пентоз с эмпирической формулой C5H10O5, принадлежит к альдозам. Содержится в эмбрионах растений в качестве эргастического вещества, а также является одним из мономеров полисахарида клеточных стенок гемицелюллозы. D–Рибоза представляет собой вид простых сахаров, образующих углеводный остов РНК, управляя, таким образом, всеми жизненными процессами. Рибоза также участвует в производстве аденозинтрифосфорной кислоты (АТФ) и является одним из ее структурных компонентов.
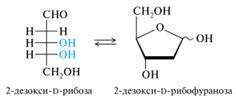
2–Дезокси–D–рибоза - компонент дезоксирибонуклеиновых кислот (ДНК). Это исторически сложившееся название не является строго номенклатурным, так как в молекуле содержатся только два центра хиральности (без учета атома С-1 в циклической форме), поэтому это соединение с равным правом может быть названо 2-дезокси-D-арабинозой. Более правильное название для открытой формы: 2-дезокси-D-эритро-пентоза (D-эритро-конфигурация выделена цветом). D–глюкозамин– вещество, вырабатываемое хрящевой тканью суставов, является компонентом хондроитина и входит в состав синовиальной жидкости.
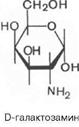
2. Моносахариды: открытая и циклические формы на примере D–галактозы и D–фруктозы, фуранозы и пиранозы; a– и β–аномеры; наиболее устойчивые конформации важнейших D–гексопираноз. Представители: D–галактоза, D–манноза, D–фруктоза, D–галактозамин (вопр. 1). Таутомерные формы фруктозы образуются так же, как и таутомерные формы глюкозы, по реакции внутримолекулярного взаимодействия (АN). Электрофильным центром является атом углерода карбонильной группы у С2, а нуклеофилом — кислород ОН-группы у 5 или 6 атома углерода.
Представители.
D–галактоза – в животных и растительных организмах, в том числе в некоторыхмикроорганизмах. Входит в состав дисахаридов - лактозы и лактулозы. При окислении образует галактоновую, галактуроновуюи слизевую кислоты. D–манноза – компонент многих полисахаридов и смешанных биополимеров растительного, животного и бактериального происхождения. D–фруктоза — моносахарид, кетогексоза, в живых организмах присутствует исключительно D-изомер, в свободном виде — почти во всех сладких ягодах и плодах — в качестве моносахаридного звена входит в состав сахарозы и лактулозы. 3. Моносахариды: образование простых и сложных эфиров, отношение эфиров к гидролизу; гликозидов (на примере D–маннозы); строение гликозидов, O–,N–,S–гликозиды, отношение гликозидов к гидролизу. Поскольку циклические формы моносахаридов — это внутренние полуацетали, то при взаимодействии со спиртами, в присутствии безводного хлороводорода, они будут взаимодействовать с одним эквивалентом спирта, образуя полный ацеталь или гликозид. В гликозидах различают сахарную часть (остаток глюкозы) и несахарную часть, остаток спирта, называемую агликоном. Для названия гликозидов характерно окончание - озид.
Гликозиды могут образовываться при взаимодействии со спиртами, фенолами, другими моносахаридами (О-гликозиды); при взаимодействии с аминами, азотистыми основаниями образуются N-гликозиды; существуют и S-гликозиды. Как и все ацетали, гликозиды гидролизуются разбавленными кислотами, проявляют устойчивость к гидролизу в щелочной среде. Гликозидная связь присутствует в полисахаридах, сердечных гликозидах, нуклеотидах, нуклеиновых кислотах.
N-Гликозиды в зависимости от природы азотсодержащего агликона N-гликозиды подразделяются на три типа: • гликозиламины — соединения, содержащие у аномерного центра аминогруппу или остаток алифатического или ароматического амина; • гликозиламиды — соединения, в которых гликозильный остаток связан с амидным атомом азота, т. е. фрагментом —NНСОR; • нуклеозиды — гликозильные производные гетероциклов. В отличие от О- и N-гликозидов, S-гликозиды не получают прямой конденсацией моносахаридов с тиолами, так как в этом случае образуются преимущественно ациклические дитиоацетали. Простые эфиры получаются при взаимодействии спиртовых ОН-групп моноз с алкилгалогенидами (метилиодид и др.) Одновременно в реакцию вступает и гликозидный гидроксил, образуя гликозид. Простые эфиры не гидролизуются, а гликозидная связь расщепляется в кислой среде.
Сложные эфиры моносахаридов. Сложные эфиры образуются при взаимодействии моносахаридов с ацилирующими агентами, например, уксусным ангидридом.
В метаболизме моносахаридов важную роль играют сложные эфиры фосфорной кислоты.
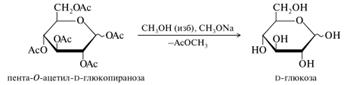
В синтетической практике применение находят ацетаты и в меньшей степени бензоаты сахаров. Они используются для временной защиты гидроксильных групп и для выделения и идентификации сахаридов. Сложные эфиры моносахаридов, подобно всем сложным эфирам, способны гидролизоваться как в кислой, так и в щелочной среде, высвобождая гидроксильные группы. Однако для удаления ацильных групп гидролиз никогда не используется. Более удобной в препаративном отношении является переэтерификация с низшим спиртом (обычно — метанолом), который служит и растворителем. Реакция протекает количественно при комнатной температуре в присутствии каталитических количеств алкоголята или триэтиламина.
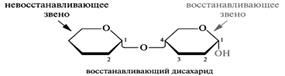
Олигосахариды: принцип строения восстанавливающих дисахаридов, их цикло–оксотаутомерия; номенклатура; представители: мальтоза, лактоза, целлобиоза; их отношение к гидролизу, окислению катионами серебра (I) и меди (II). Полисахаридами называются сложные углеводы (полигликозиды), способные подвергаться кислотному гидролизу с образованием моносахаридов или их производных. В отличие от моносахаридов они, как правило, не имеют сладкого вкуса, аморфны, нерастворимы в воде (образуют коллоидные растворы). Полисахариды подразделяется на олигосахариды и высшие гомо- и гетерополисахариды. При гидролизе олигосахаридов образуется от 2 до 10 остатков моносахаридов. В зависимости от числа моносахаридов, образующихся при кислотном гидролизе олигосахаридов, они подразделяются на ди-, три-, тетра-, пента - и т. д. (до 10) сахариды. Природные полисахариды выполняют в основном такие важнейшие функции как: 1) функцию резервного энергетического депо, например, гликоген в тканях человека и животных, крахмал — в растительных организмах; 2) структурную, например, гетерополисахариды соединительной ткани, хрящей, кожи и т. д. Кроме того, углеводные остатки, особенно, олигосахаридные, связанные с белками клеточных мембран, выполняют функции специфических маркеров поверхностей клеток и биополимеров, обуславливающих их узнавание другими клетками. Олиго- и полисахариды представляют собой родственные по принципу строения соединения, молекулы которых состоят из моносахаридных звеньев, связанных между собой гликозидной связью. В образовании гликозидной связи между двумя моносахаридами всегда участвует полуацетальный гидроксил одной молекулы моносахарида в любой из форм — пиранозной или фуранозной, с α- или β-конфигурацией. В зависимости от того, какая гидроксильная группа второго моносахаридного звена принимает участие в образовании гликозидной связи, дисахариды делятся на два типа: • Восстанавливающие дисахариды, в построение которых вовлечена любая спиртовая группа ОН (в примере ниже это гидроксил при С-4). В этом случае один из полуацетальных гидроксилов сохраняется, и дисахарид способен проявлять восстановительные свойства. • Невосстанавливающие дисахариды.
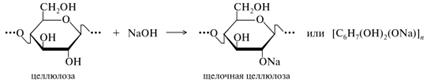
Простые эфиры. Широкое применение находят также производные целлюлозы. Химическая модификация целлюлозы сводится главным образом к ее превращению в простые и сложные эфиры. Получение простых эфиров напоминает синтез Вильямсона, в котором алкилированию подвергается так называемая «щелочная целлюлоза» — кристаллический комплекс целлюлозы, щелочи и воды. Этот комплекс образуется при действии концентрированных водных растворов щелочей на целлюлозу и записывается условно как алкоголят. Стехиометрический состав комплекса зависит от температуры и концентрации щелочи.
В реакциях алкилирования, проводимых в щелочной среде (т. е. фактически со щелочной целлюлозой), наиболее активен гидроксил при С-2, наименее — при С-3. В кислой среде самым реакционноспособным является гидроксил при С-6 как стерически более доступный. Метилцеллюлоза. Этот простой эфир может быть записан в виде [СбH7(OH)3-х(OCHз)х]n, где x — степень замещения, т. е. число метильных групп, приходящихся на одно звено. Наибольшее применение находят эфиры со степенью замещения 1,5-2 и молекулярной массой до 250-300 тыс., которые могут быть изображены следующей усредненной структурой (для степени замещения 1,5):
Метилцеллюлоза — бесцветное аморфное вещество, растворимое в холодной воде, глицерине и нерастворимое в большинстве органических растворителей. При температуре выше 55 °С водный раствор превращается в гель, который при охлаждении разрушается. Растворы метилцеллюлозы обладают поверхностно-активными свойствами. При высыхании растворов образуются прочные пленки. Метилцеллюлоза находит широкое применение как загуститель, эмульгатор и стабилизатор различных материалов, включая фармацевтические составы. Ее используют при изготовлении суспензий, эмульсий и гидрофобных основ мазей и линиментов. Карбоксиметилцеллюлоза. От метилцеллюлозы этот простой эфир, сокращенно обозначаемый КМЦ, отличается наличием карбоксильной группы в метильном заместителе: [С6Н7(OН)3-х(OСН2СOOН)х]n, где x = 0,1-1,5. Получается он действием хлороуксусной кислоты или ее натриевой соли на щелочную целлюлозу, например:
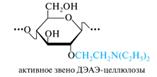
КМЦ не растворяется в воде, а ее натриевая соль (по карбоксильной группе) хорошо растворима с образованием прозрачных вязких растворов. Натрий-КМЦ применяется в аналогичных целях, что и метилцеллюлоза. КМЦ с низкой степенью замещения (x = 0,1-0,2) нашла применение в качестве катионита благодаря способности обменивать протон карбоксильной группы на другие катионы. Как ионит, обменивающий анионы, используется другой простой эфир — диэтиламиноэтилцеллюлоза (сокращенно — ДЭАЭ-целлюлоза). Сложные эфиры целлюлозы. Среди сложных эфиров целлюлозы наиболее значимыми являются ацетаты [С6Н7(ОН)3-х(OAc)х]n и нитраты [С6Н7(ОН)3-х(ONО2)х]n. Ацетаты целлюлозы были одним из первых синтетических материалов, используемых для получения искусственных волокон, например ацетатного шелка. Для этого пригодны высокозамещенные полимеры — триацетат (реальная степень замещения 2,8—2,9) и продукт его частичного гидролиза (x = 2,4—2,5), называемый вторичным ацетатом. Триацетат целлюлозы получают действием избытка ацилирующего агента (обычно уксусного ангидрида в присутствии кислотного катализатора):
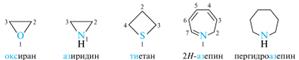
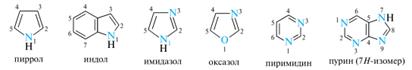
Ацетаты целлюлозы применяются в производстве текстильных материалов, кино- и фотопленок, лаков, сигаретных фильтров, различных мембран. Они находят применение и в изготовлении готовых лекарственных форм. Нитраты целлюлозы получают действием избытка смеси концентрированных азотной и серной кислот на хлопковую целлюлозу. Степень замещения х в общей формуле зависит в основном от соотношения кислот и остаточного количества воды в нитрующей смеси. Продукт частичного замещения (х = 1,8-2,1), известный как коллоксилин, используется в производстве пластмасс, целлулоида, нитроэмалей и нитролаков. Почти полностью замещенная целлюлоза (х = 2,8), называемая пироксилином, относится к взрывчатым веществам и применяется при изготовлении бездымного пороха. Гетероциклы: классификация; основы систематической номенклатуры; электронное строение ароматических пяти–, шестичленных и конденсированных гетероциклов. Представители: пиррол, индол, имидазол, оксазол, пиримидин, пурин. Для их классификации используют следующие признаки: [1]. По размеру цикла гетероциклические соединения чаще всего трех-, четырех-, пяти-, шести- и семичленные. [2]. По типу элемента, входящего в состав цикла, это соединения с атомами азота, кислорода или серы. [3]. По числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с одним и двумя гетероатомами, но известны соединения и с четырьмя атомами в одном цикле. [4]. По природе и взаимному расположению нескольких гетероатомов возможны разнообразные комбинации (N и S, N и О и т. д.), причем гетероатомы могут занимать различные положения относительно друг друга. [5]. По степени насыщенности гетероциклы могут быть ароматическими, ненасыщенными и насыщенными: Химия ароматических гетероциклов изучена наиболее подробно. Полностью или частично насыщенные гетероциклы в силу особенностей их химических свойств рассматриваются, как правило, не как гетероциклические соединения, а как циклические аналоги тех или иных алифатических соединений (простые эфиры, сульфиды, вторичные амины). [6]. По числу циклов различают моноциклические, полициклические (главным образом, конденсированные) системы. Число циклов и их типы могут быть самыми различными. Главную сложность в номенклатуре гетероциклических соединений представляет огромное разнообразие гетероциклических структурных типов. Для многих гетероциклов в номенклатуре ИЮПАК разрешается применять тривиальные и полутривиальные названия.
Правила ИЮПАК не регламентируют положение гетероатома при написании формул гетероциклов, но традиционно гетероатом (или гетероатомы) располагают в нижней части цикла. Нумерация атомов в моноциклических соединениях всегда начинается от гетероатома. Если гетероцикл содержит различные гетероатомы (чаще всего это — азот, кислород и сера), то соблюдают следующий порядок падения старшинства атомов: О > S > N. Затем нумерацию продолжают так, чтобы другой гетероатом получил наименьший локант. При наличии в молекуле неравноценных атомов азота (=N— и —NH—) нумерация начинается от более насыщенного. В систематической номенклатуре моноциклических соединений, содержащих один или несколько гетероатомов в цикле, используется метод Ганча-Видмана. Согласно этому методу, название гетероцикла образуют путем сочетания соответствующего префикса: окса - для атома кислорода, тиа - для атома серы, аза - для атома азота — с корнями, отражающими размер цикла (число атомов в цикле) и степень его насыщенности. Для удобства произношения буква «а» в префиксах часто опускается, поскольку корень начинается обычно с гласной буквы.
В приведенном выше названии азепина символ «Н» («обозначенный водород») применяется для уточнения положения двойных связей в системах с максимальным числом некумулированных двойных связей. Локант «обозначенного водорода» показывает, что «лишний» атом водорода находится в положении 2. Наличие нескольких одинаковый гетероатомов обозначается префиксами ди-, три- и т. д. Локанты гетероатомов указываются перед префиксом через дефис. Названия одновалентный радикалов гетероциклических соединений обыгано получают путем добавления суффикса - ил к тривиалыному или систематическому названию исходного соединения. Номенклатура конденсированных гетероциклических систем. Тривиальные названия. В номенклатуре ИЮПАК разрешено использование тривиальных названий многих конденсированных гетероциклических систем.
Представители. Пиррол -наибольшее распространение в растительном и животном мире имеют производные пиррола, являющиеся структурными фрагментами гема и хлорофиллов, пигментов желчи, ряда антибиотиков и алкалоидов. Пиррол умеренно токсичен, его пары вызывают стойкое и упорное повышение температуры тела. Индол служит исходным сырьём для синтеза гетероауксина, триптофана, используется в парфюмерной и фармацевтической промышленности. Многие алкалоиды содержат ядро индола. Имидазол — структурный фрагмент витамина В12, некоторый алкалоидов, белковой аминокислоты гистидина и ее метаболита — биогенного амина гистамина, а также некоторый лекарственный средств. Вместе с шестичленным гетероциклом пиримидином он образует конденсированную гетероциклическую систему пурина. Оксазол используется в фотографии, как флуоресцентный отбеливатель, антиоксидант. Многие оксазолы входят в состав ЛС, обладающих анальгезирующим, жаропонижающим, антибиотическим действием. Пиримидин. Ядро пиримидина входит в состав нуклеиновых кислот, витаминов (B1), антибиотиков (амицетин, блеомицин), ЛС (барбитураты, пиримидиновые сульфамиды), сильных ядов, коэнзимов и др. Пурин. Производные, содержащие систему пурина, широко распространены в природе и играют большую роль во многих биологических. биол. процессах. Важнейшие производные пурина - аденин, гуанин (пуриновые основания), гипоксантин, кофеин (пуриновые алкалоиды), мочевая кислота. Ядро пурина входит в состав некоторых антибиотиков и нуклеотидов, являющихся структурными фрагментами нуклеиновых кислот. Пурин и ряд его производных обладают противоопухолевой, противовирусной и противоаллергической активностью.
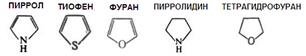
Пятичленные гетероциклы с одним гетероатомом: электронное строение, ацидофобность; кислотно–основные свойства пиррола; реакции электрофильного замещения, ориентация замещения, особенности нитрования, сульфирования, бромирования ацидофобных гетероциклов. Представители: пиррол, тиофен, фуран, пирролидин, тетрагидрофуран.
Поскольку пиррол, фуран и тиофен имеют сходное электронное строение, в их химическом поведении имеется много общего. Представители.
Тиофен. Соединения ряда тиофена — это реагенты для разделения элементов, оптические отбеливатели, физиологически активные соединения. Многие производные — ЛС (антигельминтный препарат комбантрин, модифицированные антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров. Фуран применяют для получения ТГФ, тиофена, пиррола, селенофена и малеинового ангидрида, а также в качестве растворителя и экстрагента масел и жиров. Производные фурана используют как ЛС (фурадонин, фуросемид) и средства защиты растений. Пирролидин обнаружен в табаке и моркови, пирролидиновая структура входит в состав некоторых алкалоидов (никотина) и аминокислот пролина и гидроксипролина. Пирролидиновая структура входит в состав ЛС (пирацетама). Тетрагидрофуран — это растворитель многих соединений; сырье для получения синтетических смол. Это структурный фрагмент некоторых антибиотиков (нактинов, с помощью которых осуществляется транспорт ионов К+ через клеточные мембраны.
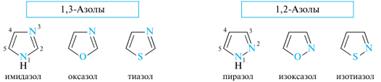
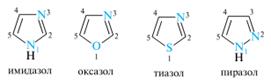
13. Пятичленные гетероциклы с двумя гетероатомами: электронное строение; кислотно–основные свойства, образование ассоциатов; реакции электрофильного замещения в пиразоле и имидазоле. Представители: пиразол, имидазол, тиазол, оксазол. Группу пятичленныгх гетероциклов, которые формально образованы из пиррола, фурана и тиофена путем замены звена —CH= хотя бы одним пиридиновым атомом азота, называют азолами. Частный случай представляют циклы с двумя атомами азота — диазолы. Азолы, содержащие два гетероатома, в зависимости от их взаимного расположения подразделяются на 1,2-азолы и 1,3-азолы. Наиболее значимыми из них являются имидазол, пиразол и тиазол.
Ароматичность. Азолы можно рассматривать как аза-аналоги пиррола, фурана и тиофена, в который звено — CH= (атом C-2 или C-3) заменено фрагментом — N=, т. е. пиридиновым атомом азота. Азолы относятся к 6π-электронным ароматическим соединениям. Так, в пиразоле и имидазоле один из атомов азота (N-1) принадлежит к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один р-электрон (пары электронов гетероатомов, участвующие в сопряжении, показаны цветом). В оксазоле и тиазоле атомы азота принадлежат к пиридиновому типу, а атомы кислорода и серы имеют конфигурацию, подобную пиррольному атому азота. Все четыре гетероцикла изоэлектронны и в сопряжении принимают участие по шесть электронов, т. е. они соответствуют правилу Хюккеля. Кислотные и основные свойства. Азолы обладают основностью благодаря пиридиновому атому азота. Имидазол сильнее пиридина.
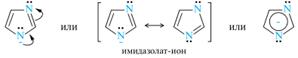
Остальные азолы значительно менее основны имидизола, вследствие сильного электроноакцепторного индуктивного влияния гетероатома в положении 1; особенно это заметно у 1,2-азолов. Кислотные свойства присущи только диазолам — имидазолу и пиразолу, благодаря их NH-кислотному центру. Оба гетероцикла заметно превышают по кислотности пиррол. Причина этого заключается в лучшей делокализации отрицательного заряда в сопряженном основании с участием обоих атомов азота, как показано на примере имидазолат-иона:
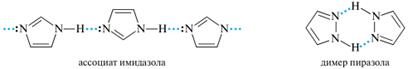
Имидазол и пиразол проявляют амфотерный характер. В кристаллическом состоянии и в неполярных растворителях они образуют межмолекулярные ассоциаты. Ассоциаты имидазола содержат до 20 молекул, а пиразол существует в виде димеров и тримеров:
Неожиданно высокие температуры кипения диазолов по сравнению с оксазолом и тиазолом свидетельствуют о прочных межмолекулярных водородных связях. Диазолы, замещенные по атому N-1 (но не С-производные), не способны образовывать водородные связи и имеют значительно более низкие температуры кипения. Пиразол. Имеет много общего с имидазолом. Это касается как алкилирования и ацилирования по пиридиновому атому азота, так и электрофильного замещения. Отличие в реакциях электрофильного замещения заключается в направлении электрофильной атаки: в пиразоле она идет, как правило, по атому C-4, где π-электронная плотность максимальна. Если атом C-4 замещен, то электрофильная атака часто становится невозможной. Подобно имидазолу, пиразол не алкилируется и не ацилируется по Фриделю-Крафтсу, но в отличие от имидазола он не вступает и в реакцию азосочетания. Представители.
Пиразол и его
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 1962; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.13.15 (0.029 с.) |