Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Другие медиаторы-непептиды: гистамин, аспарагиновая кислота, глицин, пуриныСодержание книги
Поиск на нашем сайте
Завершая разговор о медиаторах-моноаминах и медиаторах-аминокислотах, дадим краткую характеристику тем из них, которые относительно мало представлены в нервной системе человека. Из этого, конечно, не следует, что подобные соединения выполняют незначимые и второстепенные функции; скорее можно говорить о том, что им «поручены» некоторые особо ответственные задания, потребовавшие иной по сравнению с большинством зон ЦНС нейрохимической базы. Химическое строение некоторых медиаторов-непептидов см. ниже.
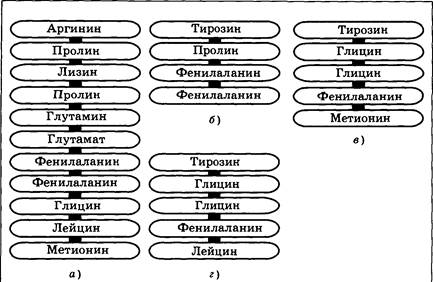
Гистамин — еще один представитель моноаминов. Это соединение образуется из пищевой аминокислоты гистидина. Нейроны, использующие гистамин в качестве медиатора, локализованы в очень небольшой зоне — заднем гипоталамусе, но их проекции широко представлены во всей ЦНС. Под действием гистамина происходит облегчение пробуждения, стимулируется двигательная и половая активность, ослабляется болевая чувствительность и пищевое поведение. Выявлено два типа постсинаптических (H1 и Н2) и один тип пресинаптических (Н3) рецепторов к гистамину. H1-рецепторы встречаются в большом количестве и на периферии, вызывая, например, спазм бронхов. Для периферических Н2-рецепторов наиболее характерна стимуляция выделения желудочного сока. H1- и Н2-рецепторы играют также важную роль в развитии аллергических и иммунных реакций. Клиническое применение (как антиаллергических препаратов) имеют в основном блокаторы H1-рецепторов: димедрол, фенкарол, диазолин, тавегил, супрастин и др. Побочным эффектом их употребления может быть снижение активности нервной системы, сонливость. Блокаторы Н2-рецепторов (например, циметидин, зонтак) являются противоязвенными препаратами. Аспарагиновая кислота (пищевая, заменимая) похожа на глутаминовую и действует на те же рецепторы. Встречается этот медиатор относительно редко. Так, в спинном мозге аспартат содержится в возбуждающих интернейронах, регулирующих различные врождённые рефлексы. Много аспарагиновой кислоты в нижней оливе — особом ядре на передней (вентральной) поверхности продолговатого мозга. Именно он является медиатором лазающих волокон, направляющихся из нижней оливы к мозжечку. Входя в кору мозжечка, лазающие волокна образуют синапсы на клетках Пуркинье. Срабатывание таких синапсов воздействует на системы вторичных посредников и вызывает различные метаболические изменения, в результате чего на несколько часов снижается эффективность синапсов между параллельными волокнами и дендритами клеток Пуркинье. Это явление названо долговременной депрессией. Оно играет важную роль в процессах моторного обучения. При повреждении нижней оливы выработка новых двигательных навыков резко затрудняется. Глицин — заменимая пищевая аминокислота. Одновременно это и тормозной медиатор, хотя значительно менее распространенный, чем ГАМК. Большая часть глицинергических клеток выполняет весьма специфическую функцию. Они получают возбуждение от коллатералей аксонов мотонейронов. Далее их собственные аксоны направляются назад к мотонейронам и осуществляют их торможение. Его назначение — предохранение мотонейронов от перевозбуждения. Глицин выполняет свою медиаторную функцию в интернейронах вентральных рогов серого вещества спинного мозга, а также двигательных ядер черепных нервов (особенно подъязычного и тройничного). Некоторое количество глицинергических нейронов обнаруживается также в промежуточном мозге и ретикулярных ядрах продолговатого мозга. Известен только один тип глицинового рецептора. Он является ионотропным и содержит Cl−-канал. Специфическим блокатором канала является стрихнин — алкалоид тропического дерева чилибухи. В больших дозах он приводит к перевозбуждению мотонейронов, сильнейшим судорогам и удушью. В малых дозах (до 0,01 г) его иногда применяют как тонизирующее средство при быстрой утомляемости, гипотонии, мышечной атонии, параличах. Интересно также, что три наиболее изученных ионотропных белка-рецептора — глициновый, никотиновый и ГАМКА имеют частично совпадающую первичную структуру. Это говорит об известной общности их эволюционного происхождения и родстве соответствующих генов. Глицин в чистом виде назначают как успокаивающий (седативный) препарат, уменьшающий возбуждение в стволе головного мозга и, в частности, снижающий риск инфаркта. Глицин ослабляет также проявления абстинентного синдрома — депрессию, повышенную раздражительность, нарушения сна и двигательные нарушения (мелкие подергивания, тремор). Это позволяет применять его для лечения больных хроническим алкоголизмом. Пурины (в первую очередь аденозин), а также АМФ, АДФ и АТФ — агонисты особых пуриновых рецепторов. Последние подразделяются на несколько типов, из которых особую значимость имеют А1-рецепторы. Последние являются метаботропными, в основном пресинаптическими; они подавляют аденилатциклазу, что приводит к падению выброса медиаторов. Физиологическая роль пуриновой системы связана с реакцией на АМФ, образующуюся при длительной интенсивной нагрузке мозга; АМФ (продукт распада АТФ) тормозит деятельность синапсов, работая как «защитник» ЦНС в экстремальных ситуациях. Блокаторы А1-рецепторов могут активировать многие медиаторные системы и весь мозг. К веществам с таким механизмом действия относят кофеин, теофилин и теобромин. Они содержатся в кофе, чае, какао, шоколаде, орехах кола (и напитках «кола»). Кофеин как фармакологический препарат принадлежит к группе психомоторных стимуляторов. У большинства людей он повышает умственную и физическую работоспособность, уменьшает усталость и сонливость, усиливает сердечную деятельность. При постоянном введении в организм кофеина происходит нарастание количества пуриновых рецепторов, в результате отказ от кофе способен вызвать значительное снижение активности аденилатциклазы, что в свою очередь может привести к развитию депрессии, сонливости. Кофеин в сочетании с анальгетиками входит в состав таких препаратов, как аскофен и цитрамон. Медиаторы-пептиды Пептидные медиаторы — вещества, состоящие из цепочек аминокислот. Первым из них было открыто вещество Р (от powder — порошок), выделенное из сухого порошка спинного мозга. Этот пептид состоит из 11 аминокислот (рис. 3.39). Его введение в кровь в очень малых дозах вызывает расширение кровеносных сосудов и спазм кишечника (рецепторы находятся на гладких мышечных клетках). Вещество Р вырабатывается нейронами спинномозговых ганглиев, связанными с восприятием болевой чувствительности. Пептид обнаруживается как в пресинаптических окончаниях их аксонов (задние рога спинного мозга), так и в чувствительных нервных окончаниях кожи. В задних рогах вещество Р работает (совместно с глутаминовой кислотой) как истинный медиатор, передающий сигнал на нейроны серого вещества. В коже оно выполняет гормоноподобную функцию, вызывая воспалительный процесс. Вырабатывается вещество Р и некоторыми интернейронами ЦНС. В таком случае оно содержится в пресинаптических окончаниях совместно с другими медиаторами (например, ГАМК).
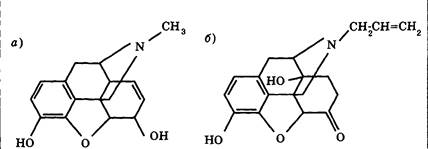
Наиболее изученной группой пептидных медиаторов считаются опиоидные пептиды. Их название происходит от опиума — субстанции, выделенной из мака Papaver somniferum и обладающего анальгетическим и эйфорическим действием (рис. 3.40). Под влиянием опиума по мере увеличения дозы наблюдается обезболивание, успокоение и засыпание. В 1803 г. было выделено основное действующее начало опиума, названное морфином. Показано, что обезболивающие эффекты морфина осуществляются через задние рога спинного мозга, эйфорические влияния (безмятежность, отрешенность, «плавание в теплых облаках») — через гипоталамус, где расположен центр положительных эмоций. Засыпание связано с общим торможением стволовых структур. Сверхбольшие дозы морфина могут вызвать остановку дыхания. В 70-е годы были найдены рецепторы к морфину — опиоидные рецепторы. Затем в течение нескольких лет шел поиск присоединяющихся к ним эндогенных медиаторов. В итоге оказалось, что последние являются веществами пептидной природы (опиоидные пептиды). В настоящее время среди них выделяют в зависимости от первичной структуры эндоморфины (4 аминокислоты), энкефалины (5 аминокислот), эндорфины (10 и более аминокислот), динорфины (8 и более аминокислот). Все опиоидные пептиды имеют две общие черты: они начинаются с тирозина, и недалеко от тирозина (через одну или две аминокислоты) находится фенилаланин.
Ситуация усложнилась, когда было показано, что опиоидные пептиды влияют по крайней мере на три типа рецепторов (мю-, дельта- и каппа-), причем морфин является агонистом лишь первого из них. Наиболее избирательными по отношению к мю-рецепторам являются эндоморфины; по отношению к дельта-рецепторам — энкефалины; по отношению к каппа-рецепторам — динорфины. Первичная структура этих рецепторов совпадает на 50—70%; все они (хотя и в разной мере) обладают обезболивающим, эйфорическим и тормозящим действием. Синтез медиаторов-пептидов (в том числе опиоидных) протекает значительно сложнее по сравнению с синтезом медиаторов других групп. В ходе этого процесса рибосомы вначале строят белок-предшественник, а затем особые ферменты вырезают из него необходимые фрагменты, причем один белок может содержать внутри себя несколько медиаторов-пептидов. Основной механизм действия опиоидов в ЦНС — пресинаптическое торможение выделения медиаторов. Рассмотрим его на примере задних рогов спинного мозга, передающих болевую чувствительность (рис. 3.41). Из схемы видно, что, соединяясь с пресинаптическими рецепторами, энкефалины способны ослабить работу основного синапса двумя путями. Во-первых, они понижают активность аденилатциклазы (АЦ) и синтез цАМФ; во-вторых, действуя через фосфолипазу, способствуют открыванию хемочувствительных К+-каналов; в результате активность Ca2+-каналов снижается, поскольку она зависит и от количества цАМФ, и от потенциала на мембране. Количество входящего кальция падает, это уменьшает выброс везикул с глутаматом и веществом Р, и передача боли ослабляется. Опиоиды способны по тому же механизму блокировать выделение и других медиаторов — моноаминов и аминокислот. В ядрах шва они ослабляют активность ГАМК-ергической передачи, тормозящей серотониновые нейроны, поэтому под влиянием энкефалинов эти нейроны активируются, ослабляя проведение боли в спинном мозге. Морфин и сходные с ним соединения — агонисты опиоидных рецепторов. Эти вещества вызывают очень сильное пресинаптическое торможение и могут привести к полному обезболиванию. Однако анальгетический эффект носит временный характер, поскольку проводящий боль нейрон быстро «нарабатывает» дополнительное количество аденилатциклазы. В этом и состоит механизм привыкания к морфину, когда для достижения эффекта нужно вводить все большее количество препарата (рис. 3.42). С каждым разом активность аденилатциклазы растет, что требует увеличения вводимой дозы для достижения анальгезии (привыкание).
При попытке отказа от морфина количество цАМФ в пресинаптическом окончании может оказаться гораздо выше нормы. Это приведет к более интенсивной передаче болевых и прочих сигналов. В таком случае можно говорить о возникновении зависимости, которая проявляется в абстинентном синдроме (глубокая депрессия, боли). Чтобы снять синдром, нужно вновь ввести морфин, и возникает замкнутый круг. Важно, что для опиоидов зависимость вырабатывается очень быстро — после 3—5 применений (в дофаминергической и ГАМК-ергических системах — после десятков и сотен применений). Зависимость от морфина была обнаружена в XIX веке при применении его в госпиталях для обезболивания. Тогда возникла идея найти аналоги морфина, снимающие боль, но не приводящие к привыканию. В результате в конце века был синтезирован героин («героическое обезболивающее») — препарат, в 10 раз более активный, чем морфин. Однако через несколько лет оказалось, что скорость привыкания к героину еще больше, — и в 20-е годы он был запрещен, перейдя из разряда лекарственных препаратов в разряд наркотиков.
В настоящее время опиум и героин производят в основном на Ближнем Востоке (Афганистан, Пакистан, Иран), в Юго-Восточной Азии (Лаос, Бирма, Таиланд) и Мексике. Его распространение контролируется организованными криминальными структурами, ряды которых пополняются наркоманами, попавшими в зависимость от героина. Кроме того, употребление этого препарата сопряжено с риском заражения СПИДом, гепатитом и другими заболеваниями, передающимися в том числе и через использованный шприц. Только в США количество героиновых наркоманов оценивается в 500 тыс. человек, и ежегодно регистрируется более 1 тыс. смертей от передозировки. Тем не менее в клинике опиоиды остаются самыми мощными из известных анальгетиков и незаменимы для снятия наиболее тяжелой боли (травмы, злокачественные опухоли). При этом наряду с морфином используется кодеин — другой опиоид, содержащийся в маке. Он обладает более слабым анальгетическим и эйфорическим действием и входит в состав таблеток «Пенталгин» и «Седалгин». Кроме того, кодеин избирательно тормозит активность кашлевого центра и применяется как противокашлевый препарат. Разработано также значительное количество синтетических аналогов морфина. Некоторые из них сравнимы с прототипом по активности (метадон), некоторые — слабее (пентазоцин; вызывает меньшее привыкание) или сильнее (фентанил; используется для анестезии). Все эти вещества относятся к группе наркотических анальгетиков. Их не следует смешивать с ненаркотическими анальгетиками, которые действуют не на ЦНС, а на возбудимость болевого рецептора (анальгин, ацетилсалициловая кислота — аспирин). Используется в клинике и антагонист опиоидных рецепторов налоксон. Его применяют при передозировке наркотических анальгетиков и приеме сверхдоз морфина и героина. Применяется налоксон также для диагностики наркомании. Его введение вызывает (при наличии зависимости от опиатов) развитие проявлений абстинентного синдрома. Вещество Р, энкефалины и эндорфины — это только отдельные представители регуляторных нейропептидов. Разнообразие этого класса медиаторов и модуляторов деятельности нервной системы чрезвычайно велико. В него входят сотни соединений, составляющие несколько десятков семейств. Далеко не для всех из них к настоящему времени найдены в ЦНС специфические рецепторы, и далеко не все они присутствуют в нервной ткани в заметном количестве. Дело в том, что многие нейропептиды являются фрагментами пептидных гормонов и гормонов-белков, выполняющих специфические функции в периферических органах. В этом случае их появление в мозге может быть следствием распада гормона в плазме крови или лимфе. Однако многие нейропептиды вырабатываются нервными клетками в дополнение к основным медиаторам и, накапливаясь в везикулах, выбрасываются из пресинаптического окончания. В этом случае они обычно вызывают не открывание ионных каналов, а медленные метаболические изменения в постсинаптической клетке (что и подразумевает термин «модуляторы деятельности нервной системы»). Приведем несколько примеров. Тиролиберин (один из либеринов гипоталамуса) одновременно способен активировать эмоциональное поведение и бодрствование, а также дыхательный центр. Холецистокинин — стимулятор сокращений желчного пузыря; его короткий участок вызывает тревожность и страх. Вазопрессин управляет деятельностью почек; его фрагменты активируют процессы запоминания. Адренокортикотропный гормон «включает» надпочечники; его участки стимулируют внимание и классифицируются как ноотропы. Представителем последнего семейства является используемый в клинике препарат «Семакс» — пептид, состоящий из семи аминокислот. Его интраназальное (закапывание в нос) применение позволяет улучшить состояние поврежденных или незрелых нервных клеток, в связи с чем семакс используется после инсультов, травм, при дегенерациях сетчатки и периферических нервов. Существуют нейропептиды, избирательно управляющие половым поведением, пищевой мотивацией, терморегуляцией. В целом соединения этой группы образуют сложную иерархическую систему, в которой одни нейропептиды активируют или подавляют высвобождение других нейропептидов. Последние способны воздействовать как на метаболизм нейронов, так и на функционирование «классических» медиаторных систем; при этом сфера влияний конкретного нейропептида часто ограничивается узким кругом эффектов, связанных, например, только с какой-либо одной биологически значимой потребностью или с определенным типом памяти.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.247.24 (0.013 с.) |