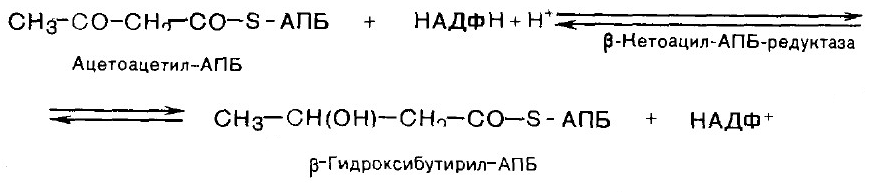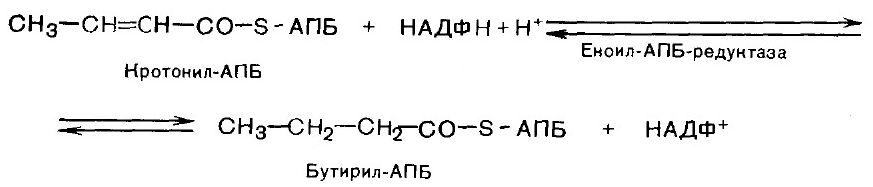Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление ненасыщенных жирных кислотСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Около половины жирных кислот в организме человека ненасыщенные. β-Окисление этих кислот идет обычным путем до тех пор, пока двойная связь не окажется между третьим и четвертым атомами углерода. Затем фермент еноил-КоА-изомераза перемещает двойную связь из положения 3-4 в положение 2-3 и изменяет цис-конформацию двойной связи на транс-, которая требуется для β-окисления. В этом цикле β-окисления первая реакция дегидрирования не происходит, так как двойная связь в радикале жирной кислоты уже имеется. Далее циклы β-окисления продолжаются по обычному пути.
Нарушения окисления жирных кислот У людей с наследственными дефектами карнитинацилтрансферазы I или ферментов синтеза карнитина в скелетных мышцах снижается скорость поступления жирных кислот в матрикс митохондрий и, соответственно, скорость β-окисления. В этих случаях жирные кислоты с длинной цепью не используются как источники энергии. У таких людей снижена способность к физической активности; в клетках могут накапливаться жиры, образуя вакуоли. Встречается генетический дефект дегидрогеназы жирных кислот со средней длиной углеводородной цепи. У грудных детей жиры молока служат основным источником энергии, а в триацилглицеринах молока преобладают жирные кислоты со средней длиной цепи. Невозможность использовать жирные кислоты как источники энергии приводит к увеличению скорости окисления глюкозы. В результате у детей развивается гипогликемия - причина внезапной детской смертности (10% от общего числа умерших новорожденных). Если такие дети выживают, то после голодания в течение Во всех случаях, когда нарушается β-окисление, жирные кислоты накапливаются в клетках и распадаются по пути ω-окисления. В результате образуются дикарбоновые кислоты, выделяющиеся с мочой. Определение этих кислот в моче может служить диагностическим признаком нарушения Обмен ацетил-КоА Ацетил-КоА является универсальным донором ацетильных групп для реакций ацетилирования, а такжевключается в цикл трикарбоновых кислот при помощи глиоксилевого цикла. Этот процесс важен для синтеза углеводов. Включение ацетил-КоА в цикл Кребса зависит от доступности оксалоацетата. При голодании или диабете оксалоацетат расходуется на образование глюкозы. В таких условиях путь метаболизма ацетил-КоА отклоняется в сторону образования кетоновых тел. Основным местом образования кетоновых тел служит печень. Кетоновые тела -ацетоуксусная кислота (ацетоацетат) СН3СОСН2СООН, β-оксимасляная кислота (β-оксибутират) СН3СНОНСН2СООН и ацетон СН3СОСН3. В крови здорового человека кетоновые тела содержатся в очень небольших концентрациях (в сыворотке крови 0,03-0,2 ммоль/л) При патологических состояниях (у лиц с тяжелой формой сахарного диабета, при голодании) концентрация кетоновых тел в крови может достигать 16-20 ммоль/л. Кетонемия обычно сопровождается кетонурией. Сердечная мышца и корковый слой почек предпочтительно используют в качестве «топлива» ацетоацетат, а не глюкозу. В противоположность этому глюкоза является главным «топливом» для мозга у лиц, получающих сбалансированную пищу. При голодании и диабете мозг адаптируется к использованию ацетоацетата. Печень не использует кетоновые тела как источник энергии. В периферических тканях кетоновые тела окисляюся до ацетил-КоА.
ЛИПОГЕНЕЗ Липогенез - биосинтез de novo жирных кислот. Липогенез протекает в цитозоле клеток печени, почек, мозга, легких, молочной железы, жировой ткани. Субстратом для синтеза служит ацетил-КоА. Внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом. Образовавшийся цитрат переносится в цитозоль при помощи специальной транспортной системы. 1. Карбоксилирование ацетил-КоА и образование малонил-КоА. Фермент - ацетил-КоА-карбоксилаза, содержит биотин. СО2 + АТФ + биотин-фермент ® карбоксибиотин-фермент + АДФ + ФН карбоксибиотин-фермент + СН3-СО-SКоА ® ® НООС-СН2-СО-S-КоА + биотин-фермент Малонил-КоА Данная стадия является лимитирующей. Последующие стадии протекают при участии мультиферментного комплекса - синтетазы (синтазы) жирных кислот. Он состоит из 6 ферментов, связанных с ацилпереносящим белком (АПБ), и имеет две свободные HS-группы. 2. Соединение ацетил-КоА и малонил-КоА с АПБ.
3. Конденсация двух ацетильных остатков.
4. Восстановление карбонильной группы.
5. Дегидратация.
6. Гидрирование. В результате образуется бутирил-АПБ.
Далее цикл реакций повторяется. На последней стадии происходит гидролиз и освобождение АПБ.
Донором водорода в синтезе жирных кислот является НАДФ. НАДФН поставляет пентозофосфатный путь окисления глюкозы и НАДФ-зависимая малатдегидрогеназа. Пальмитиновая кислота служит предшественником других жирных кислот организма. Удлинение углеродной цепи происходит при участии фермента элонгазы. Ненасыщенные жирные кислоты образуются из насыщенных при участии ферментов десатураз (рис. 4).
Рис. 4. Регуляция синтеза и распада жирных кислот Переключение процессов синтеза жирных кислот на их окисление происходит при смене периода пищеварения на постабсорбтивное состояние и осуществляется с помощью регуляторных механизмов. Важнейшее звено регуляции синтеза жирных кислот - ацетил-КоА-карбоксилаза. В период пищеварения в цитозоле увеличивается концентрация цитрата, который является переносчиком ацетильных остатков из митохондрий. Цитрат - аллостерический активатор ацетил-КоА-карбоксилазы. Ускоряется синтез малонил-КоА и, следовательно, синтез жирных кислот. Конечный продукт – пальмитил-КоА – ингибитор ацетил-КоА-карбоксилазы. Активность ацетил-КоА-карбоксилазы регулируется глюкагоном и адреналином посредством аденилатциклазной системы. Фосфорилированная форма фермента неактивна, дефосфорилированная – активна. Эти гормоны также путем фосфорилирования переводят липазу в жировой ткани в активное состояние. Следовательно, синтез жирных кислот прекращается, а начинается мобилизация ТАГ, окисление жирных кислот и синтез кетоновых тел. Регуляторный фермент β-окисления – ацилкарнитинтрансфераза. Его аллостерический ингибитор – малонил-КоА. В постабсорбтивный период, когда поступление ацетильных остатков из митохондрий в цитозоль прекращается, синтез малонил-КоА тоже прекращается, и активируется Скорость биосинтеза жирных кислот во многом определяется скоростью образования триглицеридов и фосфолипидов, компонентом которых они являются.
МЕТАБОЛИЗМ ФОСФОЛИПИДОВ Фосфолипиды не являются существенным энергетическим материалом. Они играют важную роль в организации клеточных мембран, в формировании липопротеиновых комплексов, свертывании крови, иммунологических реакциях, в переносе электронов в дыхательной цепи. Фосфолипиды распадаются на высшие жирные кислоты, фосфорную кислоту, азотистые основания и глицерин гидролитическим путем. Фосфолипазы относятся к подклассу эстераз (класс гидролаз). Фосфолипаза А1 расщепляет сложноэфирную связь в положении 1 и высвобождает молекулу жирной кислоты. Фосфолипаза А2 катализирует гидролиз сложноэфирной связи в положении 2, образуются свободная жирная кислота и лизофосфолипид. Фосфолипаза A1 локализована в ЭПС, а А2 - в митохондриях. Фосфолипаза С расщепляет сложноэфирную связь в положении 3, образуются 1,2-диацилглицерин и фосфорильное основание. Фосфолипаза D катализирует отщепление от фосфолипида азотистого основания.
Наиболее детально изучены фосфолипазы А2. Действие фосфолипаз на мембраны приводит к существенным изменениям в их функциональной активности. Фосфолипаза А2 является компонентом инозитолфосфатной мессенджерной системы. Фосфолипазы А2 содержатся в яде некоторых змей, что вызывает массированный гемолиз при укусе. Дальнейший обмен ВЖК и глицерина изложен ранее. Азотистые основания, входящие в состав фосфолипидов, метаболизируются по специфическим путям. Например, холин ацетилируется с образованием ацетилхолина.
Ацетилхолин участвует в передаче нервных импульсов. Биосинтез фосфолипидов происходит в ЭПС клеток печени, стенки кишечника, семенников, яичников, молочной железы. При синтезе холин- и этаноламинсодержащих фосфолипидов при участии ЦТФ образуются ЦДФ-холин или ЦДФ-этаноламин - реакционноспособные азотистые основания. Затем они реагируют с Холин + АТФ ® Фософохолин + АДФ Фосфохолин + ЦТФ ® ЦДФ-холин + Н2Р2О7 ЦДФ-холин + 1,2-дигацилглицерин ® фосфатидилхолин + ЦМФ Фосфатидилхолин (лецитин) может образоваться также из фосфатидилэтаноламина. Донор метильных групп - S-аденозилметионин. При синтезе инозитсодержащих фосфолипидов при участии ЦТФ образуется ЦДФ-диглицерид - реакционноспособная форма диглицерида, которая затем реагирует с азотистым основанием.
|
||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 502; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.195.8 (0.008 с.) |