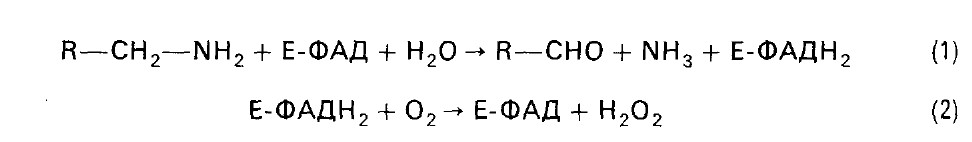Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции по карбоксильной группеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Декарбоксилирование аминокислот. Простетической группой декарбоксилаз L-аминокислот служит пиридоксальфосфат (активная форма витамина В6). Продуктами декарбоксилирования аминокислот являются амины. Так как они образуются в качестве продуктов жизнедеятельности и обладают высокой физиологической активностью, их называют биогенными аминами. Открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно α-декарбоксилирование.
При декарбоксилировании гистидина возникает гистамин. Он вызывает расширение сосудов в очаге воспаления, участвует в секреции соляной кислоты в желудке, что используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). При повышенной чувствительности к гистамину используют антигистаминные препараты.
При декарбоксилировании глутаминовой кислоты образуется НООСCH(NH2)CH2CH2COOH глутаминовая кислота g-аминомасляная кислота Она накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС. Декарбоксилаза ароматических аминокислот катализирует декарбоксилирование 3,4-диоксифенилаланина (ДОФА), образуется дофамин. Он является предшественником норадреналина и адреналина. Накопление биогенных аминов может вызывать нарушения ряда функций в организме. Существуют специальные механизмы обезвреживания биогенных аминов. Происходит их окислительное дезаминирование с образованием альдегидов и освобождением аммиака. Ферменты - моноамино-и диаминоксидазы. Локализованы преимущественно в митохондриях. Коферментом является ФАД. Процесс является необратимым и протекает в две стадии:
Пероксид водорода далее распадается на воду и кислород. 2. Образование аминоациладенилатов. Эта реакция взаимодействия аминокислоты с АТФ, катализируется ферментами класса лигаз. С аминоациладенилатов аминокислоты передаются на тРНК. Углеродные скелеты аминокислот могут включаться в ЦТК. Пять аминокислот (фен, лиз, лей, трп, тир) считаются кетогенными, поскольку являются предшественниками кетоновых тел. Большинство других аминокислот называют гликогенными. Они служат в организме источником углеводов. Глюконеогенез усиливается при сахарном диабете, при гиперфункции коркового вещества надпочечников, введении глюкокортикоидов.
ОБЕЗВРЕЖИВАНИЕ АММИАКА В ОРГАНИЗМЕ Главным источником аммиака в организме служит дезаминирование аминокислот и нуклеотидов. Распадается около 70 г аминокислот в сутки. Аммиак является высокотоксичным соединением. Уровень аммиака в крови в норме не превышает 60 мкмоль/л. В опытах на животных показано, что превышение концентрации аммиака в 5 раз является летальным. Пути связывания аммиака 1. Аспарагиновая и глутаминовая кислоты осуществляют первичное связывание NH3 в момент его образования в клетке.Ферменты - аспарагинсинтетаза и глутаминсинтетаза - лигазы. Необходимым условием является участие АТФ.
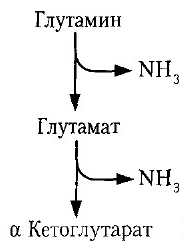
Синтез глутамина происходит особенно активно в мышцах, мозге, печени. Часть аммиака связывается с a-кетоглутаровой кислотой.
Глутамин и аспарагин выделяются с мочой в небольшом количестве. Предполагают, что они выполняют функцию переноса аммиака в нетоксичной форме. Значительная часть аммиака переносится в печень в виде аланина. Последний образуется из пирувата. Амидирование аспарагиновой и глутаминовой кислот может происходить и в том случае, если они находятся в составе белковой молекулы. Тем самым обеспечивается немедленное связывание аммиака везде, где он возникает в результате обмена веществ. 2. Мочевина - основной конечный продукт белкового обмена у человека и многих животных. Азот мочевины составляет около 90% всего выводимого азота. Синтез мочевины происходит исключительно в печени, т.к. полный набор ферментов орнитинового цикла есть только в гепатоцитах. Этот процесс протекает в несколько стадий, образующих орнитиновый цикл мочевинообразования Кребса. 1. Образование карбамоилфосфата из NH3, CO2 и АТФ при действии карбамоилфосфатсинтетазы. Макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака: NH3+ CO2 + 2 АТФ + Н2О ® H2N-СО-ОРО3Н2 + 2АДФ + Н3РО4 В организме человека открыты два пути синтеза карбамоилфосфата: а) реакция под действием фермента аммиакзависимой карбамоилфосфатсинтетазы. Протекает в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины; б) реакция, катализируемая глутаминзависимой карбамоилфосфатсинтетазой. Донором аминогруппы является глутамин. Открыта в цитозоле, используется преимущественно для синтеза пиримидиновых нуклеотидов. 2. Конденсация орнитина и карбамоилфосфата, фермент - орнитинкарбамоилтрансфераза.
1 и 2 реакции протекают в митохондриях. 3. Цитруллин переходит в цитозоль и там реагирует с аспарагиновой кислотой, образуется аргининосукцинат. Фермент - аргининосукцинатсинтетаза.
4. Аргининсукцинат распадается на аргинин и фумарат. Фермент – аргининосукцинатлиаза.
5. Гидролиз аргинина с образованием мочевины. Фермент - аргиназа.
Образовавшийся орнитин вновь вовлекается в цикл образования мочевины. Фумарат превращается в аспартат: фумарат ® пируват ® аспартат На 1 моль синтезирующейся мочевины расходуется 3 моль АТФ. Суммарное уравнение синтеза мочевины:
Концентрация мочевины в сыворотке крови здоровых взрослых людей составляет 2,5-8,3 ммоль/л (660 мг/л). 3. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. Образование аммиака происходит в почках, главным образом из глутамина:
Аммиак акцептирует протон, образуя аммонийную соль. Образование и экскреция аммиака почками представляют собой механизм экскреции протонов (в составе NH4+). Экскреция аммиака с мочой в норме составляет около 0,5 г в сутки. Она повышается при ацидозе (до 20 раз больше нормы). При алкалозе экскреция аммиака отсутствует. 4. Азот выводится в форме креатинина, который образуется из креатина и креатинфосфата, а креатин, в свою очередь – из аминокислот аргинина, глицина и метионина. 5. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования a-кетокислот. Это главный путь новообразования аминокислот в организме человека. Даная реакция обратна окислительному дезаминированию аминокислот. Возможно восстановительное аминирование любой кетокислоты. Но активно участвуют в данной реакции a-кетоглутаровая, щавелевоуксусная и пировиноградная кислота:
Остальные аминокислоты образуются в результате реакций трансаминирования аспарагиновой и глутаминовой кислот и аланина с соответствующими кетокислотами. Поэтому аланин, аспарагиновую и глутаминовую кислоты называют первичными аминокислотами, а все остальные - вторичными.
НАРУШЕНИЯ АЗОТИСТОГО ОБМЕНА Белковая недостаточность - следствие дефицита белка, а также тяжелых заболеваний при достаточном поступлении белка с пищей. Развивается также при однообразном питании белками растительного происхождения. Характеризутся отрицательным азотистым балансом, гипопротеинемией, нарушениями коллоидно-осмотического и водно-солевого обмена. В развивающихся странах среди детей распространено заболевание квашиоркор. Оно возникает при тяжелых формах пищевых дистрофий. Наблюдаются тяжелые поражения печени, остановка роста, резкое снижение сопротивляемости организма инфекциям, отечность, атония мышц. Болезнь часто заканчивается летальным исходом. Гипераммониемия – повышение содержания аммиака в крови. Гипераммониемиясопровождается появлением следующих симптомов: тошнота, повторяющаяся рвота; головокружение, судороги; потеря сознания, отек мозга (в тяжёлых случаях); отставание умственного развития (при хронической врождённой форме). Причинами гипераммониемии могут быть генетические дефекты ферментов орнитинового цикла в печени. Известны пять наследственных заболеваний, обусловленных дефектом пяти ферментов орнитинового цикла (таблица 2). Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Например, недостаточность первого фермента цикла - карбамоилфосфатсинтетазы I - привводит к накоплению аммиака и его предшественников - аминокислот; главным образом глутамина и аланина. Концентрация аммиака может превышать нормальную в 10-20 раз, концентрация глутамина - в 2-3 раза. При циррозе и других заболеваниях печени также часто наблюдают гипераммониемию, т.к. мощность орнитнового цикла снижена. Точный диагноз типа гипераммониемии устанавливают путем определения метаболитов орнитинового цикла в крови или моче, а также путем измерения активности ферментов цикла в биоптате печени. Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов аминокислот в рацион и стимуляцию выведения аммиака в обход нарушенных реакций: Гипераминоацидурия – увеличение выделения аминокислот с мочой. Выделяют почечную гипераминоацидурию, связанную с дефектами реабсорбции аминокислот в почках, и внепочечную, обусловленную увеличением концентрации аминокислот в крови. Часто встречаются наследственные дефекты всасывания аминокислот в почках. Например,причиной цистинурии - выделения с мочой цистина (до 50 раз больше нормы) – является врожденный дефект переносчиков, участвующих в реабсорбции в почках. Уровень цистина в крови при этом обычно не выше нормальных величин. Примером внепочечной гипераминоацидурии может быть аргининосукцинурия. Повышение уровня мочевины в крови происходит при нарушениях выведения мочевины, связанного с заболеваниями почек и мочевыводящих путей; чрезмерном катаболизме белков либо употреблениии в пищу чрезмерного количества белка (в результате усиленного синтеза мочевины); обезвоживание организма. Снижение уровня мочевины в крови наблюдается при врожденной недостаточности или отсутствии ферментов, участвующих в орнитиновом цикле мочевинообразования; при тяжелых поражениях печени; при диете с низким содержанием белка, голодании и др.
Таблица 2 Наследственные нарушения орнитинового цикла
2.5. СПЕЦИФИЧЕСКИЕ ПУТИ ОБМЕНА 1. Обмен глицина, серина и треонина происходит при участии ферментов - производных фолиевой кислоты. Основной путь катаболизма глицина - его распад на СО2, NH3 и
Биологический смысл данного пути катаболизма - в образовании активного одноуглеродного фрагмента (N5,N10—СН2—ТГФК), который используется в реакциях синтеза. Глицин играет важную роль в образовании пуриновых нуклеотидов, гема, желчных кислот, креатина, глутатиона и др. В реакции взаимопревращения глицина и серина участвует метилентетрагидрофолиевая кислота:
Обмен одноуглеродных групп нарушается при недостаточности фолиевой кислоты и витамина В12. Клиническим проявлением является мегалобластная (макроцитарная) анемия. Характерно увеличение размеров эритроцитов, снижение количества эритроцитов, снижение концентрации гемоглобина в крови. Причины дефицита фолиевой кислоты - неправильное питание, заболевания кишечника, нарушающие всасывание. Глицинурия – редкое заболевание, связанное с дефектом почечной реабсорбции глицина. Характеризуется повышенным выделением глицина с мочой. Один из симптомов заболевания – образование оксалатных камней в почках.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 492; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.78.203 (0.011 с.) |



 NH2CH2CH2CH2COOH + СО2
NH2CH2CH2CH2COOH + СО2