Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты панкреатического сокаСодержание книги
Поиск на нашем сайте
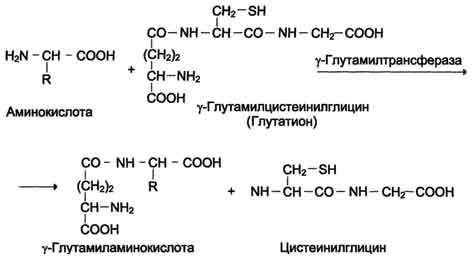
Трипсин вырабатывается в виде профермента трипсиногена. Активация трипсиногена происходит при участии фермента энтеропептидазы, выделяемого клетками кишечника. Она отщепляет N-концевой гексапептид трипсиногена, в результате образуется активный трипсин. Основное количество трипсиногена активируется трипсином, т. е. путем аутоактивации. Остальные проферменты поджелудочной железы – химотрипсиноген, проэластаза и прокарбокспептидаза - активируются трипсином и тоже путем частичного протеолиза; в результате образуются функционально активные ферменты – эндопептидазы химотрипсин, эластаза иэ кзопептидазы карбоксипептидазы А и В. Они наиболее активны в слабощелочной среде (рН Действие ферментов панкреатического сока также относительно избирательно: трипсин гидролизует связи, образованные СООН-группами арг, лиз; химотрипсин – тир, фен, три, лей, илей, вал. Эластаза поджелудочной железы гидролизует эластин. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные С-концевыми ароматическими аминокислотами или аминокислотами с гидрофобными радикалами, а карбоксипептидаза В - С-концевыми лизином и аргинином. Последний этап переваривания - гидролиз небольших пептидов. Он происходит под действием ферментов экзопептидаз, которые синтезируются клетками тонкого кишечника в активной форме. Аминопептидазы гидролизуют пептидные связи, образованные любой N-концевой аминокислотой. Дипептидазы гидролизуют пептидные связи в образовавшихся дипептидах. Последовательное действие пептидгидролаз лишает белки видовой специфичности и обеспечивает практически полное расщепление белков до аминокислот. Продукты гидролиза белков всасываются в пищеварительном тракте в основном в виде свободных аминокислот при участии белков-переносчиков. Аминокислоты, подобно глюкозе, всасываются с ионами Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану энтероцита в кровь. Майстер предложил гипотезу переноса аминокислот через мембраны при посредстве γ-глутамилтрансферазного цикла. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы.
Доказано всасывание небольших пептидов. Олигопептиды после всасывания подвергаются гидролизу. В отдельных случаях всасываются большие пептиды, например, токсины ботулизма, холеры и дифтерии. Транспорт этих пептидов до настоящего времени не нашел удовлетворительного объяснения. Всосавшиеся аминокислоты поступают через воротную вену в печень. В печени аминокислоты участвуют в синтезе белков, нуклеотидов, креатина и других веществ; используются как источник энергии. Значительная часть аминокислот разносится кровью по всему организму и используется для физиологических целей. Парентеральное белковое питание Введение белков парентерально приводит к развитию сенсибилизации, а повторное введение белков может вызвать анафилаксию. Для белкового питания используют гидролизаты белков (смесь аминокислот). Это не вызывает аллергической реакции. Однако возможны побочные реакции, например, нарушение нормальной психической деятельности. ПРЕВРАЩЕНИЯ АМИНОКИСЛОТ Превращения аминокислот под действием микрофлоры кишечника Все превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». В кишечнике образуются ядовитые продукты обмена - сероводород H2S, метилмеркаптан CH3SH, амины, крезол, фенол, скатол и индол. В печени они подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой и выделяются с мочой.
Количество индикана, выделившегося с мочой, характеризует, с одной стороны, скорость гниения белков в кишечнике; с другой стороны, может отражать функциональную активность печени. Реакции по аминогруппе 1. Дезаминирование аминокислот. Во всех случаях NH2-rpyппa аминокислоты освобождается в виде аммиака. Восстановительное дезаминирование:
Гидролитическое дезаминирование (серин, треонин, цистеин):
Гистидин подвергается внутримолекулярному дезаминированию:
Преобладающим является окислительное дезаминирование.
С наибольшей скоростью дезаминируется глутаминовая кислота под действием фермента глутаматдегидрогеназы. Коферментами глутаматдегидрогеназы являются НАД+ или НАДФ+. Сначала глутамат ферментативно окисляется в иминоглутарат, а затем иминокислота без участия фермента гидролизуется с образованием α-кетоглутарата и аммиака.
В печени и почках имеется оксидаза L-аминокислот. Коферментом оксидазы L-аминокислот является ФМН или ФАД. Они выполняют роль переносчика водорода с аминокислоты непосредственно на кислород. 2. Трансаминирование аминокислот -реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту. БольшинствоL-аминокислот дезаминируется в организме путем трансаминирования (переаминирования) с α-кетоглутаровой кислотой:
Ферменты - аминоферазы, или трансаминазы. Они содержатся практически во всех органах (таблица 1), но наиболее активно реакции трансаминирования протекают в печени. Их кофермент - пиридоксальфосфат (производное витамина В6). Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию. А. Е. Браунштейн для подобного непрямого пути дезаминирования аминокислот предложил термин трансдезаминирование. Для клинических целей наибольшее значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие перенос аминогруппы с аспартата и аланина на a-кетоглутарат: аспартат + α-кетоглутарат ® оксалоацетат + глутамат аланин + α-кетоглутарат ® пируват + глутамат В сыворотке крови здоровых людей активность этих аминотрансфераз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу аминотрансфераз из очага поражения в кровь. Уже через 3-5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Уровень АлАТ в крови в большей степени повышается при заболеваниях печени. Таблица 1 Активность аминотрансфераз в тканях человека (Ед/г белка)
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 470; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.158.10 (0.006 с.) |


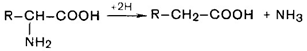 .
.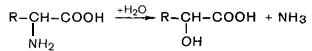 .
. ®
®  .
.