Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции в безводной среде и инертной атмосфереСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Многие органические реагенты, промежуточные соединения и растворители легко взаимодействуют с водой и (или) кислородом воздуха или углекислым газом. Это часто требует проведения синтезов в абсолютно безводных условиях и без доступа кислорода воздуха. Растворители для таких синтезов подвергают специальной дополнительной очистке («абсолютирование»), методики очистки можно легко найти в химической литературе (например [1]). Примеры приборов для проведения синтезов в безводных условиях и в атмосфере азота приведены на рис. 2.6 и 2.7.
ВЫДЕЛЕНИЕ И ОЧИСТКА ПРОДУКТОВ РЕАКЦИИ
Препаративные органические реакции редко приводят к полному превращению исходных соединений в конечный продукт. В хорошей синтетической методике можно ожидать выход продукта 70 – 80% от теоретически возможного. Кроме целевого органического продукта, неорганических продуктов, катализатора, растворителя, в реакционной смеси всегда присутствуют другие органические вещества, представляющие собой побочные продукты реакции. В некоторых случаях образуются полимерные примеси, которые часто окрашены в желтый или коричневый цвет. Таким образом, смесь, полученная в результате реакции, является достаточно сложной, и, кроме целевого продукта, неорганических веществ и растворителя, может содержать следующее: - остатки исходных веществ, - примеси побочных продуктов реакции, - примеси полимерных (смолистых) веществ. Целью завершающей стадии химического эксперимента является выделение основного продукта с максимально возможным выходом и как можно в более чистом состоянии. В большинстве случаев для выделения продукта требуется применение сложных операций. Первичную очистку, заключающуюся в удалении неорганических веществ и растворителя, обычно называют «обработкой» реакционной смеси, в результате чего получают «сырой» («технический») органический продукт. Растворитель удаляют методом перегонки, неорганические вещества отфильтровывают или отделяют в виде водного раствора, при этом часто применяют экстракцию. Далее сырой продукт окончательно очищают с использованием следующий методов: - кристаллизация, - перегонка, - хроматография.
Экстракция
Чаще всего простую экстракцию выполняют в делительной воронке (рис. 3.1). Сам процесс экстракции включает в себя смешивание органического раствора (в растворителе, не смешивающимся с водой) с водой (или с водным раствором кислоты, щелочи, хлористого натрия) в делительной воронке, встряхивание воронки для перемешивания слоев, отстаивание смеси для полного разделения слоев и слив нижнего слоя в какой-либо другой сосуд. Смешивание позволяет веществу перейти из одного слоя в другой в зависимости от его относительной растворимости в каждом из них (коэффициента распределения). Существует несколько видов экстракции: 1) экстракция продукта реакции органическим растворителем из водного раствора; 2) экстракция водой для удаления из смеси водорастворимого вещества (обычно неорганического); 3) экстракция водным раствором кислоты или щелочи для удаления из органического слоя соответственно органического основания или кислоты. Если продукт реакции мало растворим в воде, то при экстракции водой часть его будет переходить в воду, что уменьшит выход продукта. В таких случаях органический слой промывают водным раствором хлорида натрия (для нейтральных или основных продуктов) или сульфатом аммония (для кислых веществ). Неорганическая соль, растворенная в воде, снижает растворимость в ней органического вещества (явление высаливания), что существенно уменьшает его потери при экстракции.
МЕТОДИКА ЭКСТРАКЦИИ. Выберите делительную воронку нужного размера, которую можно было бы заполнить не более чем на 2/3 объема. Проверьте кран и убедитесь, что он свободно вращается (нанесите немного смазки на стеклянный кран, если он не смазан и вращается с трудом). Закройте кран, закрепите воронку в штатив (не пользуйтесь для этого когтистой лапкой!) или вставьте в кольцо, залейте через коническую воронку органический раствор. Добавьте воды (или водного раствора кислоты или основания) и закройте пробкой. Возьмите воронку в руки и, придерживая пробку одной рукой, а зарытый кран – другой, переверните воронку и плавными круговыми движениями вращайте ее в течение нескольких секунд, чтобы образовался водоворот (но не трясите!). При перевернутой воронке откройте кран, чтобы стравить давление (рис. 3.1, б) (давление внутри воронки может быть значительным при использовании легко летучих растворителей). Закройте кран, повращайте более энергично и стравите давление снова. Проделайте это несколько раз до прекращения увеличения давления. После этого делительную воронку можно потрясти, чтобы перемешать ее содержимое. Не нужно трясти слишком энергично или долго, так как может образоваться эмульсия, которую будет трудно разрушить. Опять закрепите воронку в штатив (с помощью лапки или кольца) и дайте постоять, чтобы произошло разделение фаз, и между ними образовалась четкая граница. После разделения слоев вынимают пробку, и нижний слой сливают в отдельный сосуд (плоскодонная или коническая колба или стакан). Нижний слой может быть органическим или водным, в зависимости от плотности органического растворителя. Процесс экстракции обычно повторяют несколько раз, объединяя органические слои для дальнейшей обработки. Выливать водный слой в слив можно только после окончательного выделения продукта и определения его выхода, иначе можно потерять часть продукта с водным слоем.
Экстракция с использованием делительной воронки дает удовлетворительные результаты только тогда, когда выделяемое вещество имеет высокий коэффициент распределения (отношение концентраций соединения в двух несмешивающихся фазах) и почти полностью переходит в один из слоев. Однако некоторые органические вещества легко растворяются как в органических растворителях, так и в воде. Такие вещества выделяют из водных растворов непрерывной экстракцией. Непрерывная экстракция используется также для экстракции из твердой фазы, например, при отделении продукта от значительного количества полимерных и смолистых примесей. Конструкция аппаратов для непрерывной экстракции приведена во многих практических пособиях по органическому синтезу (например [1 - 7]). После окончания водной экстракции органический слой содержит некоторое количество воды, как в виде небольших капель, так и в растворенном виде. Воду удаляют добавлением небольшого количества порошкообразного неорганического осушителя, который затем удаляют фильтрованием. В качестве осушителей применяются соли, образующие устойчивые кристаллогидраты и не вступающие в реакцию с большинством органических соединений, например сульфат натрия, сульфат магния, хлористый кальций. Из отфильтрованного от осушителя раствора отгоняют растворитель на приборе для простой перегонки, а остаток далее очищают кристаллизацией (если продукт твердый), перегонкой (если он способен перегоняться без разложения) или колоночной хроматографией.
Перекристаллизация
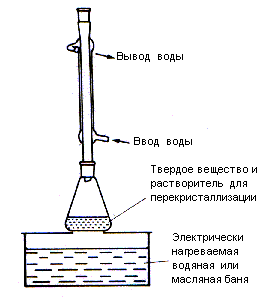
Перекристаллизация – наиболее общий метод очистки твердых органических веществ, он часто применяется как в лаборатории, так и на производстве. Метод основан на том, что растворимость твердых соединений в горячих растворителях намного выше, чем в холодных. Если приготовить насыщенный горячий раствор органического соединения и дать ему остыть, то раствор станет пересыщенным и из него начнут выпадать кристаллы очищаемого вещества. Однако раствор не будет пересыщенным по отношению к небольшому количеству примесей, содержащихся в продукте, и последние останутся в растворе. В результате чистый кристаллический продукт отделяют от маточного раствора фильтрованием. Процесс перекристаллизации состоит из следующих стадий: 1) растворение твердого вещества в минимальном объеме кипящего растворителя; 2) фильтрование горячего раствора для удаления нерастворимых примесей (или фильтрование горячего раствора после обработки его активированным углем для удаления окрашенных примесей); 3) охлаждение раствора и выдерживание его до полной кристаллизации; 4) отделение кристаллов от маточного раствора фильтрованием; 5) высушивание кристаллов. Для очистки продукта иногда перекристаллизацию проводят несколько раз и из различных растворителей. Успешная перекристаллизация определяется прежде всего правильным выбором растворителя. Растворитель подбирают экспериментальным путем, основываясь на знании температуры плавления вещества и предполагая, что «подобное растворяется в подобном». Это означает, что, например, высшие спирты могут кристаллизоваться из низших спиртов, высшие карбоновые кислоты – из низших кислот; однако углеводороды часто кристаллизуются из метанола или этанола. Растворитель для перекристаллизации должен отвечать следующим требованиям: 1) не должен вступать в химическое взаимодействие с очищаемым веществом; 2) должен иметь температуру кипения на 15-20 градусов ниже температуры плавления очищаемого вещества (чтобы продукт не выделялся из пересыщенного раствора в расплавленном виде); 3) должен хорошо растворять кристаллизуемое вещество при нагревании и почти не растворять его на холоду; 4) должен растворять примеси не хуже, чем очищаемое вещество, иначе примеси будут выпадать из раствора вместе с продуктом; в этом случае для очистки применяют колоночную хроматографию (раздел 3.4.2) или перегонку с водяным паром (раздел 3.3.4). 5) должен способствовать образованию кристаллов (вещество не должно выделяться при охлаждении в виде коллоидных частиц); 6) должен легко удаляться с поверхности кристаллов при сушке. Первые два свойства позволяют отбросить ряд растворителей, если известна структура вещества и его температура плавления. Растворитель, удовлетворяющий остальным свойствам, подбирают путем пробных кристаллизаций в пробирках небольших количеств (5-10 мг) вещества. Наиболее часто используемые растворители приведены в табл. 3.1. Таблица 3.1
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 564; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.63.252 (0.007 с.) |