
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие правила работы в лабораторииСодержание книги Поиск на нашем сайте
ОБЩИЕ МЕТОДЫ РАБОТЫ В ЛАБОРАТОРИИ ОРГАНИЧЕСКОЙ ХИМИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Самара 2004
Экспериментальные методы
Предметом практической органической химии является получение органических веществ заданной структуры. Цель студенческих лабораторных работ – освоение основных приемов синтетической работы в лаборатории. Лабораторный синтез обычно состоит из трех последовательных операций: - собственно химическая реакция, - отделение продукта реакции от растворителей, побочных или неорганических веществ («обработка» реакционной смеси), - очистка и идентификация продукта реакции. Методы проведения реакций достаточно просты и обычно заключаются в смешивании реагентов с последующим нагреванием для ускорения реакции или при охлаждении в случае использования высоко-активных реагентов. Однако использование последних, а также применение чувствительных к воздуху и влаге реагентов требует применения специальных приборов, методов для проведения реакции в инертной атмосфере. «Обработка» реакционной смеси для отделения продукта от побочных веществ (образующихся в результате основной реакции параллельно с продуктом), от растворителя является порой самым трудоемким и сложным этапом работы, часто занимает больше времени, чем сама химическая реакция. Очистка продукта от примесей (образующихся в результате побочных реакций, от примесей исходных реагентов) необходима для идентификации полученного вещества, особенно если вещество получено впервые. Кроме методов, напрямую связанных с препаративной работой, часто необходимо наблюдать за полнотой протекания реакции, для чего обычно используют тонкослойную хроматографию (ТСХ), высокоэффективную жидкостную хроматографию (ВЭЖХ) или газо-жидкостную хроматографию (ГЖХ). Препаративная жидкостная колоночная хроматография с использованием силикагеля в качестве сорбента применяется для очистки продуктов реакции и для разделения смеси нескольких продуктов, часто образующихся в реакции. Полученное при синтезе химическое соединение должно быть идентифицировано. Идентификацию известных соединений проводят по их физическим свойствам: по температуре плавления, температуре кипения, показателю преломления. Эти константы являются также критериями чистоты синтезированного вещества. Для впервые полученного соединения физические константы тоже измеряются, но его структура дополнительно подтверждается инструментальными методами: данными элементного анализа, инфракрасной (ИК) спектроскопии, ультрафиолетовой (УФ) спектроскопии, масс-спектрометрии (МС), спектроскопии ядерного магнитного резонанса (ЯМР) и рентгеноструктурного анализа (РСтА). Только последний метод позволяет однозначно и надежно установить структуру нового соединения, особенно если о нем отсутствует какая-либо дополнительная информация. Если известно строение исходных соединений, то в большинстве случаев структуру продукта можно подтвердить методом ЯМР.
Общие правила работы в лаборатории 1. В лаборатории при выполнении синтезов должно находиться не менее двух человек. 2. Работающие в лаборатории должны знать правила техники безопасности и пожарной безопасности, знать, где находится огнетушитель и кошма для тушения пожара. 3. Запрещается в лаборатории принимать пищу, курить и пить воду из химической посуды. 4. До начала работы необходимо изучить свойства используемых и образующихся веществ, правила безопасной работы с ними. 5. Нельзя проводить опыты в грязной посуде; посуду следует мыть сразу же после выполнения работы. 6. Нельзя оставлять без присмотра работающие лабораторные установки и включенные электроприборы. 7. При выполнении работы нужно пользоваться необходимыми средствами индивидуальной защиты. 8. Все работы, в ходе которых возможно выделение паров токсичных веществ, необходимо проводить в вытяжном шкафу. 9. Запрещается пробовать на вкус какие бы то ни было вещества. 10. Нельзя наклоняться над сосудом с нагревающейся жидкостью, направлять отверстие таких сосудов на себя или на других. 11. Запрещается использовать вещества из посуды, не имеющей этикеток. 12. Определять запах вещества следует, осторожно направляя пары к себе легким движением руки и не вдыхая их полной грудью. 13. Запрещается выливать в раковины остатки кислот, щелочей, органических жидкостей, бросать в раковины бумагу, спички и другие твердые предметы.
14. Категорически запрещается нагревать жидкость в закупоренных сосудах и стеклянных приборах, кроме предназначенных для этого автоклавов. Каждая установка должна сообщаться с атмосферой. 15. Каждый работающий в лаборатории должен знать, где находится аптечка с медикаментами, уметь оказать первую помощь при различных травмах.
ПРОВЕДЕНИЕ ХИМИЧЕСКОЙ РЕАКЦИИ Для проведения химической реакции, при отсутствии конкретной методики синтеза, прежде всего подбирают такие условия, при которых: - исходные вещества реагируют с подходящей скоростью, - образуется минимальное количество побочных продуктов, - продукт реакции устойчив. Условия проведения реакции в значительной степени определяются ее природой. При проведении реакции обычно необходимо контролировать ее температуру и порядок смешения реагентов; в некоторых случаях требуется изолировать реакционную смесь от кислорода и влаги воздуха. В учебной лаборатории условия реакции уже подобраны и подробно описаны в соответствующей методике.
Смешивание реагентов Реакцию можно проводить, в зависимости от ее природы, несколькими способами: - навески реагентов сразу смешивают в реакционном сосуде перед началом реакции (реакцию ведут, например, при нагревании); - один из реагентов постепенно добавляют к смеси остальных реагентов в течение определенного промежутка времени, поддерживая заданную температуру (это наиболее часто встречающаяся процедура); - два реагента добавляют постепенно в ходе реакции (используется в редких случаях). В некоторых случаях (в мелкомасштабных реакциях) реагенты взвешивают непосредственно в реакционном сосуде, но обычно их лучше отмерять в отдельных сосудах и затем переносить в реакционную колбу. Твердые вещества взвешивают в химическом стакане или на листе плотной бумаги и засыпают их в реакционный сосуд через воронку для сыпучих веществ (см. рис. 2.2), чтобы избежать загрязнения шлифа. Жидкости обычно не взвешивают, а отмеряют по объему с помощью мерного цилиндра, мерного стакана или пипетки; заливают жидкость в колбу с помощью обычной химической или капельной воронки. Для постепенного добавления реагентов жидкости и растворы прикапывают из капельной воронки (см. рис. 2.2 и 2.3), при этом лучше использовать колбу с параллельными шлифами. Твердые вещества вводят небольшими порциями через воронку для сыпучих веществ; при проведении реакции в кипящем растворителе перед каждым добавлением порции вещества надо дать реакционному сосуду слегка остыть.
Перемешивание реакционной смеси
Перемешивание реакционной смеси обеспечивает: - хорошее смешивание по мере введения реагентов; - удерживает твердые вещества и масла в виде суспензии или эмульсии; -способствует равномерному кипению при кипячении с обратным холодильником. Существует два способа перемешивания: - при помощи лопастной мешалки, соединенной с моторчиком (см. рис. 2.3); - при помощи магнитной мешалки (рис. 2.4). Магнитную мешалку можно использовать только при перемешивании низковязких растворов, небольших количеств реагентов. Лопастная мешалка является универсальной и позволяет перемешивать вязкие растворы, суспензии, эмульсии, объемы жидкостей от нескольких миллилитров до нескольких литров.
Контроль за температурой Экстракция
Чаще всего простую экстракцию выполняют в делительной воронке (рис. 3.1). Сам процесс экстракции включает в себя смешивание органического раствора (в растворителе, не смешивающимся с водой) с водой (или с водным раствором кислоты, щелочи, хлористого натрия) в делительной воронке, встряхивание воронки для перемешивания слоев, отстаивание смеси для полного разделения слоев и слив нижнего слоя в какой-либо другой сосуд. Смешивание позволяет веществу перейти из одного слоя в другой в зависимости от его относительной растворимости в каждом из них (коэффициента распределения). Существует несколько видов экстракции: 1) экстракция продукта реакции органическим растворителем из водного раствора; 2) экстракция водой для удаления из смеси водорастворимого вещества (обычно неорганического); 3) экстракция водным раствором кислоты или щелочи для удаления из органического слоя соответственно органического основания или кислоты. Если продукт реакции мало растворим в воде, то при экстракции водой часть его будет переходить в воду, что уменьшит выход продукта. В таких случаях органический слой промывают водным раствором хлорида натрия (для нейтральных или основных продуктов) или сульфатом аммония (для кислых веществ). Неорганическая соль, растворенная в воде, снижает растворимость в ней органического вещества (явление высаливания), что существенно уменьшает его потери при экстракции.
МЕТОДИКА ЭКСТРАКЦИИ. Выберите делительную воронку нужного размера, которую можно было бы заполнить не более чем на 2/3 объема. Проверьте кран и убедитесь, что он свободно вращается (нанесите немного смазки на стеклянный кран, если он не смазан и вращается с трудом). Закройте кран, закрепите воронку в штатив (не пользуйтесь для этого когтистой лапкой!) или вставьте в кольцо, залейте через коническую воронку органический раствор. Добавьте воды (или водного раствора кислоты или основания) и закройте пробкой. Возьмите воронку в руки и, придерживая пробку одной рукой, а зарытый кран – другой, переверните воронку и плавными круговыми движениями вращайте ее в течение нескольких секунд, чтобы образовался водоворот (но не трясите!). При перевернутой воронке откройте кран, чтобы стравить давление (рис. 3.1, б) (давление внутри воронки может быть значительным при использовании легко летучих растворителей). Закройте кран, повращайте более энергично и стравите давление снова. Проделайте это несколько раз до прекращения увеличения давления. После этого делительную воронку можно потрясти, чтобы перемешать ее содержимое. Не нужно трясти слишком энергично или долго, так как может образоваться эмульсия, которую будет трудно разрушить. Опять закрепите воронку в штатив (с помощью лапки или кольца) и дайте постоять, чтобы произошло разделение фаз, и между ними образовалась четкая граница. После разделения слоев вынимают пробку, и нижний слой сливают в отдельный сосуд (плоскодонная или коническая колба или стакан). Нижний слой может быть органическим или водным, в зависимости от плотности органического растворителя. Процесс экстракции обычно повторяют несколько раз, объединяя органические слои для дальнейшей обработки. Выливать водный слой в слив можно только после окончательного выделения продукта и определения его выхода, иначе можно потерять часть продукта с водным слоем.
Экстракция с использованием делительной воронки дает удовлетворительные результаты только тогда, когда выделяемое вещество имеет высокий коэффициент распределения (отношение концентраций соединения в двух несмешивающихся фазах) и почти полностью переходит в один из слоев. Однако некоторые органические вещества легко растворяются как в органических растворителях, так и в воде. Такие вещества выделяют из водных растворов непрерывной экстракцией. Непрерывная экстракция используется также для экстракции из твердой фазы, например, при отделении продукта от значительного количества полимерных и смолистых примесей. Конструкция аппаратов для непрерывной экстракции приведена во многих практических пособиях по органическому синтезу (например [1 - 7]). После окончания водной экстракции органический слой содержит некоторое количество воды, как в виде небольших капель, так и в растворенном виде. Воду удаляют добавлением небольшого количества порошкообразного неорганического осушителя, который затем удаляют фильтрованием. В качестве осушителей применяются соли, образующие устойчивые кристаллогидраты и не вступающие в реакцию с большинством органических соединений, например сульфат натрия, сульфат магния, хлористый кальций. Из отфильтрованного от осушителя раствора отгоняют растворитель на приборе для простой перегонки, а остаток далее очищают кристаллизацией (если продукт твердый), перегонкой (если он способен перегоняться без разложения) или колоночной хроматографией.
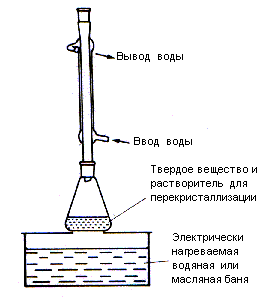
Перекристаллизация
Перекристаллизация – наиболее общий метод очистки твердых органических веществ, он часто применяется как в лаборатории, так и на производстве. Метод основан на том, что растворимость твердых соединений в горячих растворителях намного выше, чем в холодных. Если приготовить насыщенный горячий раствор органического соединения и дать ему остыть, то раствор станет пересыщенным и из него начнут выпадать кристаллы очищаемого вещества. Однако раствор не будет пересыщенным по отношению к небольшому количеству примесей, содержащихся в продукте, и последние останутся в растворе. В результате чистый кристаллический продукт отделяют от маточного раствора фильтрованием.
Процесс перекристаллизации состоит из следующих стадий: 1) растворение твердого вещества в минимальном объеме кипящего растворителя; 2) фильтрование горячего раствора для удаления нерастворимых примесей (или фильтрование горячего раствора после обработки его активированным углем для удаления окрашенных примесей); 3) охлаждение раствора и выдерживание его до полной кристаллизации; 4) отделение кристаллов от маточного раствора фильтрованием; 5) высушивание кристаллов. Для очистки продукта иногда перекристаллизацию проводят несколько раз и из различных растворителей. Успешная перекристаллизация определяется прежде всего правильным выбором растворителя. Растворитель подбирают экспериментальным путем, основываясь на знании температуры плавления вещества и предполагая, что «подобное растворяется в подобном». Это означает, что, например, высшие спирты могут кристаллизоваться из низших спиртов, высшие карбоновые кислоты – из низших кислот; однако углеводороды часто кристаллизуются из метанола или этанола. Растворитель для перекристаллизации должен отвечать следующим требованиям: 1) не должен вступать в химическое взаимодействие с очищаемым веществом; 2) должен иметь температуру кипения на 15-20 градусов ниже температуры плавления очищаемого вещества (чтобы продукт не выделялся из пересыщенного раствора в расплавленном виде); 3) должен хорошо растворять кристаллизуемое вещество при нагревании и почти не растворять его на холоду; 4) должен растворять примеси не хуже, чем очищаемое вещество, иначе примеси будут выпадать из раствора вместе с продуктом; в этом случае для очистки применяют колоночную хроматографию (раздел 3.4.2) или перегонку с водяным паром (раздел 3.3.4). 5) должен способствовать образованию кристаллов (вещество не должно выделяться при охлаждении в виде коллоидных частиц); 6) должен легко удаляться с поверхности кристаллов при сушке. Первые два свойства позволяют отбросить ряд растворителей, если известна структура вещества и его температура плавления. Растворитель, удовлетворяющий остальным свойствам, подбирают путем пробных кристаллизаций в пробирках небольших количеств (5-10 мг) вещества. Наиболее часто используемые растворители приведены в табл. 3.1. Таблица 3.1 Температура плавления
После проведения кристаллизации необходимо удостовериться, что вещество является достаточно чистым. Наиболее простым и эффективным методом идентификации и определения меры чистоты вещества является определение его температуры плавления (Т пл). Температурой плавления называют интервал температур, при котором твердое вещество переходит в жидкую фазу. Все чистые химические соединения имеют узкий температурный интервал перехода из твердого состояния в жидкое. Этот температурный интервал для чистых веществ составляет максимум 1–2 оС. Использование температуры плавления в качестве меры чистоты вещества основывается на том, что присутствие примесей (1) понижает температуру плавления и (2) расширяет температурный интервал плавления. Например, чистый образец бензойной кислоты плавится в интервале 120–122 оС, а слегка загрязненный – при 114-119 оС. Использование температуры плавления для идентификации отличается, очевидно, большой неопределенностью, так как существует несколько миллионов органических соединений, и неизбежно температуры плавления многих из них совпадают. Однако, во-первых, Т пл полученного в синтезе вещества почти всегда отличается от Т пл исходных соединений. Во-вторых, можно использовать методику «определения температуры плавления смешанной пробы». Если Т пл смеси равных количеств исследуемого вещества и известного образца не отличается от Т пл последнего, то оба образца представляют собой одно и то же вещество.
МЕТОДИКА ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ. Тщательно растирают исследуемое вещество в тонкий порошок. Заполняют веществом капилляр (на 3–5 мм по высоте; капилляр должен быть тонкостенным, запаянным с одной стороны, с внутренним диаметром 0.8–1 мм и высотой 3–4 см). Для этого осторожно вдавливают капилляр открытым концом в порошок вещества и периодически ударяют его запаянным концом о поверхность стола 5–10 раз. Для полного смещения порошка к запаянному концу капилляра его бросают в вертикальную стеклянную трубку (длиной 30–40 см и диаметром 0.5–1 см) на твердую поверхность. Вставляют капилляр в металлическую кассету, закрепленную на носике термометра (рис. 3.5), и помещают термометр с кассетой в прибор для определения температуры плавления.
В приборе термометр с капиллярами нагревается электрической спиралью, напряжение на которую подается через трансформатор, и скорость нагрева определяется подаваемым напряжением. Сначала нагревают прибор со скоростью 4– 6 оС в минуту, а за 10 оС до предполагаемой Т пл нагревают со скоростью 1–2 оС в минуту. За температуру плавления принимают интервал от размягчения кристаллов (смокания вещества) до полного их плавления. Полученные данные записывают в лабораторный журнал.
Перегонка
Перегонка является важным и широко используемым методом очистки органических жидкостей и разделения жидких смесей. Этот метод заключается в кипячении и выпаривании жидкости с последующей конденсацией паров в дистиллят. Разделение двух жидкостей с разницей температур кипения 50–70 оС и более можно осуществить простой перегонкой. Если разница меньше, необходимо использовать фракционную перегонку на более сложном приборе. Некоторые жидкости с высокими температурами кипения в процессе перегонки разлагаются. Однако при снижении давления температура кипения понижается, что позволяет перегонять высококипящие жидкости без разложения в вакууме.
Перегонка с водяным паром
Некоторые органические соединения, почти не смешивающиеся с водой, можно отделить от нелетучих загрязнений перегонкой с водяным паром. Этот процесс представляет собой совместную перегонку с водой и заключается в пропускании струи водяного пара через горячую смесь перегоняемого вещества и воды. Если вещество имеет высокое давление паров (более 5 мм рт. ст. при 100 оС), оно переносится с паром и легко отделяется от дистиллята, будучи не смешивающимся с водой (вещество также не должно вступать в химическую реакцию с водой). Перегонка с паром позволяет: - очищать высококипящие вещества, разлагающиеся при высокой температуре; - отделять летучие продукты от смолистых веществ, часто образующихся в реакциях и не удаляющихся перегонкой или перекристаллизацией. Прибор для перегонки с паром показан на рис. 3.11. В качестве перегонной колбы можно использовать колбу Вюрца, а также круглодонную колбу с насадкой Вюрца или круглодонную двухгорлую колбу.
Р и с. 3.11. Прибор для перегонки с водяным паром
3.3.5. Сублимация твердых веществ (возгонка)
Сублимация – метод очистки небольших количеств органических твердых веществ. В процессе сублимации вещество испаряется при нагревании до температуры, ниже его температуры плавления и пары конденсируются непосредственно в твердое состояние на холодном приемнике. Только малое число органических веществ имеет относительно высокое давление паров, и могут возгоняться при атмосферном давлении при температурах ниже их температур плавления. Этот метод лучше всего подходит для неполярных соединений, которые обычно более летучи, чем полярные с одинаковой молекулярной массой (например, сублимацией можно очистить нафталин, антрацен, адамантан). Преимущества метода заключаются в простоте, легкости исполнения и минимальных потерях вещества. Главный недостаток состоит в невозможности разделения веществ со сходной летучестью (они будут возгоняться вместе). Для сублимации небольших количеств веществ используют пробирку с боковым отводом и пальчиковый холодильник (см. рис. 3.8, ж). Помещаемое на дно пробирки вещество при нагревании (обычно в вакууме) возгоняется и оседает на поверхности пальчикового холодильника.
Хроматография
Хроматография охватывает ряд очень эффективных экспериментальных методов разделения смесей органических соединений. Их разделяют на две группы: мало масштабные аналитические методы качественного и количественного анализа смесей и более масштабные препаративные методы разделения в количествах от миллиграмма до нескольких десятков граммов. Качественный анализ проводят методом тонкослойной хроматографии (ТСХ). Этот метод часто применяется для контроля за ходом реакции, так как позволяет легко и быстро определить присутствие в реакционной смеси исходных веществ и продуктов реакции. Количественный хроматографический анализ проводят методом газо-жидкостной хроматографии (ГЖХ), используемым для анализа летучих веществ, а также методом высокоэффективной жидкостной хроматографии (ВЭЖХ), позволяющим анализировать, в том числе, и практически нелетучие органические соединения сложной структуры. Препаративное разделение смесей органических соединений проводят методом колоночной жидкостной хроматографии.
Тонкослойная хроматография
Разделение смеси проводят на пластинке, покрытой тонким слоем сорбента – силикагелем (гелем двуокиси кремния) или оксидом алюминия (рис. 3.12, а). Анализируемую смесь, растворенную в соответствующем растворителе, наносят с помощью тонкого капилляра в виде капель на пластинку (рис. 3.12, б) и, после испарения растворителя, помещают пластинку в хроматографическую камеру (обычно – стакан с притертой крышкой, рис. 3.12, в), в которую налито немного растворителя. Растворитель (элюент) поднимается по слою сорбента под действием капиллярных сил. При этом различные соединения, находящиеся в смеси, поднимаются с разными скоростями в зависимости от силы их взаимодействия (в основном диполь-дипольного) с сорбентом. По достижении растворителем верхнего слоя сорбента соединения, в идеальном случае, должны полностью разделиться, поднявшись на разную высоту (рис. 3.12, г). Четкость разделения смеси зависит от размера пятна после нанесения капли смеси (рис. 3.12, б) – диаметр пятна не должен превышать 2 – 3 мм. Расстояние между центрами пятен и от центров пятен до краев пластинки должно быть около 10 мм. Уровень элюента в хроматографической камере (см. рис. 3.12, в) должен составлять примерно 5 мм, чтобы нанесенные образцы не погружались в растворитель. Перед нанесением образцов на пластинку ее обычно осторожно, чтобы не повредить слой сорбента, размечают мягким карандашом, отмечая линию старта, линию финиша и точками - места нанесения образцов. Для нанесения образца заполняют тонкий капилляр раствором, погрузив конец капилляра в раствор (капилляр заполняется под действием капиллярных сил), затем слегка прикасаются заполненным кончиком к сорбенту, стараясь не повредить его поверхность. Чем тоньше выбран капилляр, тем меньшего диаметра пятно удается нанести на пластинку, что улучшает последующее разделение веществ.
Р и с. 3.12. Тонкослойная хроматография
Если соединения в смеси окрашены, то их легко различить визуально после хроматографирования. Для обнаружения бесцветных веществ используют пластинки с добавками неорганического флуоресцентного агента, что позволяет наблюдать такие вещества при освещении ультрафиолетовой лампой (с длиной волны 254 нм). Другим распространенным методом является выдерживание просушенной после хроматографирования пластинки в камере, заполненной парами йода; пары йода растворяются в «пятнах» органических соединений, вследствие чего они становятся видны на более светлом фоне. В конкретных условиях (сорбент, растворитель, температура) характеристикой соединения является его коэффициент удерживания (R f), представляющий собой отношение расстояния, пройденного веществом, к расстоянию, пройденному фронтом растворителем (см. рис. 3.12, г). Таким образом, если значение R f соединения, находящегося в смеси, совпадает со значением R f «подлинного» образца, то можно считать, что эти вещества одинаковы. Однако идентичные условия часто воспроизвести достаточно сложно, поэтому рядом с анализируемой смесью наносят «пятна» «свидетелей» - веществ, которые наиболее вероятно присутствуют в смеси. По совпадению расстояний, пройденных веществами в смеси, с расстояниями, пройденными «свидетелями», определяют, какие вещества присутствуют в анализируемой смеси. При анализе реакционных смесей в качестве «свидетелей» наносят исходные вещества. По окончании анализа в рабочем журнале зарисовывают хроматографическую пластинку с пятнами веществ, указывают состав элюента и рассчитывают значения коэффициентов удерживания (R f).
Колоночная хроматография
Колоночная хроматография – это единственный наиболее важный метод для разделения смесей жидких или твердых органических веществ в препаративном масштабе (от нескольких миллиграммов до десятков граммов). Обычно разделение проводят жидкостно-адсорбционной хроматографией (физическая природа та же, что и в случае ТСХ), которая эффективна для большинства неионных соединений. Разделение проводят на колонке (рис. 3.13, а), представляющую собой стеклянную трубку, заполненную сорбентом (обычно силикагелем), играющим роль пористого слоя, через который протекает подвижная фаза (элюирующий растворитель, например, гексан, хлороформ). Разделяемая смесь подается в верхнюю часть колонки, где она сорбируется неподвижной фазой, а затем через колонку непрерывно подается элюент (рис. 3.13, б). Каждый компонент смеси переносится вниз по колонке подвижной фазой (элюентом) со скоростью, которая зависит от сродства к сорбенту (ее можно оценить по величине R f метод ТСХ). В идеальном случае смесь разделяется на ряд отдельных компонентов (полос) (рис. 3.13, в), которые медленно опускаются по колонке и в конечном счете собираются в приемник. После отгонки растворителя из соответствующих приемников выделяют чистые вещества.
4. Контрольные вопросы 1. Почему нельзя использовать для кристаллизации растворитель, обладающий хорошей растворяющей способностью, не зависящей от температуры? 2. Почему спирты мало пригодны для перекристаллизации карбоновых кислот? 3. Какой процесс называется возгонкой? 4. В чем преимущества и недостатки возгонки перед перегонкой и перекристаллизацией? 5. Что называется температурой кипения? 6. Как зависит температура кипения от давления? 7. Как влияет наличие примеси на температуру кипения? 8. Как влияет наличие примеси на температуру плавления? 9. Какое влияние оказывает строение органического соединения на температуру кипения? 10. Почему перегонную колбу наполняют не более чем на 2/3 объема? 11. Почему при достижении температуры кипения не испаряется мгновенно вся жидкость? 12. Для чего необходимо помещать в перегонную колбу «кипелки»? 13. Можно ли помещать «кипелки» в нагретую до кипения жидкость? 14. Изобразите схемы приборов для перегонки: а) этилового эфира уксусной кислоты, б) нитробензола, в) бромбензола (температуры кипения найдите в справочнике). 15. Какие смеси жидких веществ можно разделить простой перегонкой? 16. С какой скоростью проводится перегонка? 17. С какой целью проводят перегонку под уменьшенным давлением? 18. Какую роль выполняет капилляр при вакуумной перегонке? 19. Какой из трех изомерных нитрофенолов перегоняется с водяным паром и почему? 20. Как производится осушка жидких органических веществ? 21. Что общего между экстракцией и хроматографией? 22. Почему нужно использовать очень тонкий капилляр при нанесении раствора на пластинку для тонкослойной хроматографии?
Расчет синтеза
Перед проведением синтеза по определенной методике необходимо сделать следующее: - найти в справочниках свойства целевого продукта и используемых исходных реагентов (табл. 5.1); - провести практический и теоретический расчет (табл. 5.2) для определения мольных соотношений реагентов, для вычисления теоретически возможного выхода продукта. Практический расчет заключается в пропорциональном увеличении или уменьшении количеств веществ, данных в методическом руководстве. Теоретический расчет проводится на основе стехиометрических коэффициентов уравнения реакции. При проведении расчетов используются следующие простейшие уравнения:
m = V . d (5.1) V = m / d (5.2)
где: m – масса, г; V – объем, мл; d – плотность, г/мл;
m = m . M (5.3) m = m / M (5,4)
где: m – масса, г; m - количество вещества, моль; M - молекулярная масса, г/моль.
После проведения расчета синтеза нужно понять, почему тот или иной реагент взят в избытке или недостатке, и каким способом происходит очистка продукта от остатков избыточно взятого реагента.
ПРИМЕР. Синтез бромистого бутила из 15 г бромистого калия.
Уравнение реакции:
СН3СН2СН2СН2ОН + КВr + H2SO4 = СН3СН2СН2СН2Br + KHSO4 + H2O
В методике (инструкции) даны следующие количества реагентов:
Находят в справочнике свойства всех веществ, с которыми предстоит работать, и заполняют таблицу (табл. 5.1). Таблица 5.1. ОБЩИЕ МЕТОДЫ РАБОТЫ В ЛАБОРАТОРИИ ОРГАНИЧЕСКОЙ ХИМИИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Самара 2004
Экспериментальные методы
Предметом практической органической химии является получение органических веществ заданной структуры. Цель студенческих лабораторных работ – освоение основных приемов синтетической работы в лаборатории. Лабораторный синтез обычно состоит из трех последовательных операций: - собственно химическая реакция, - отделение продукта реакции от растворителей, побочных или неорганических веществ («обработка» реакционной смеси), - очистка и идентификация продукта реакции. Методы проведения реакций достаточно просты и обычно заключаются в смешивании реагентов с последующим нагреванием для ускорения реакции или при охлаждении в случае использования высоко-активных реагентов. Однако использование последних, а также применение чувствительных к воздуху и влаге реагентов требует применения специальных приборов, методов для проведения реакции в инертной атмосфере. «Обработка» реакционной смеси для отделения продукта от побочных веществ (образующихся в результате основной реакции параллельно с продуктом), от растворителя является порой самым трудоемким и сложным этапом работы, часто занимает больше времени, чем сама химическая реакция. Очистка продукта от примесей (образующихся в результате побочных реакций, от примесей исходных реагентов) необходима для идентификации полученного вещества, особенно если вещество получено впервые. Кроме методов, напрямую связанных с препаративной работой, часто необходимо наблюдать за полнотой протекания реакции, для чего обычно используют тонкослойную хроматографию (ТСХ), высокоэффективную жидкостную хроматографию (ВЭЖХ) или газо-жидкостную хроматографию (ГЖХ). Препаративная жидкостная колоночная хроматография с использованием силикагеля в качестве сорбента применяется для очистки продуктов реакции и для разделения смеси нескольких продуктов, часто образующихся в реакции. Полученное при синтезе химическое соединение должно быть идентифицировано. Идентификацию известных соединений проводят по их физическим свойствам: по температуре плавления, температуре кипения, показателю преломления. Эти константы являются также критериями чистоты синтезированного вещества. Для впервые полученного соединения физические константы тоже измеряются, но его структура дополнительно подтверждается инструментальными методами: данными элементного анализа, инфракрасной (ИК) спектроскопии, ультрафиолетовой (УФ) спектроскопии, масс-спектрометрии (МС), спектроскопии ядерного магнитного резонанса (ЯМР) и рентгеноструктурного анализа (РСтА). Только последний метод позволяе
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.43.27 (0.02 с.) |


 Р и с. 3.5. Размещение капилляров при определении температуры плавления
Р и с. 3.5. Размещение капилляров при определении температуры плавления


 Р и с. 3.13. Колоночная хроматография
Р и с. 3.13. Колоночная хроматография



