Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Питательные среды для культивирования и идентификации псевдомонадСодержание книги
Похожие статьи вашей тематики
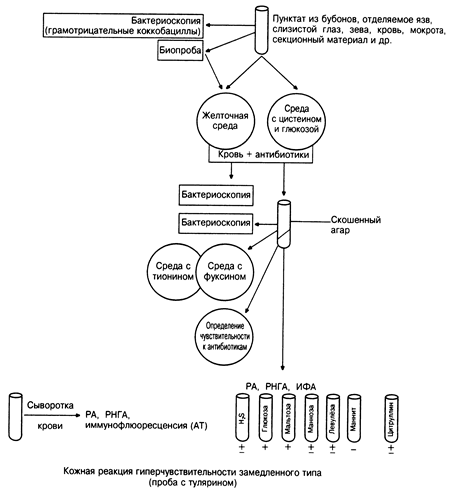
Поиск на нашем сайте Среда Кинга А. Пептон — 20,0 г, глицерин — 10,0 г, калий сернокислый — 10,0 г, магний хлористый — 1,4 г, агар — 20,0 г, вода дистиллированная — до 1000,0 мл. Среда Кинга В. Пептон — 20,0 г, глицерин - 10,0 г, калий фосфорнокислый двузамещенный — 1,5 г, магний сернокислый — 1,5 г,агар — 15,0 г, вода дистиллированная — до 1000,0 мл (рН 7,2). Среда Мак-Конки. Пептон — 20,0 г, лактоза — 10,0 г, натрий хлористый — 5,0 г, таурохолат натрия — 5,0 г, нейтральный красный — 0,03 г, агар — 20,0 г, вода дистиллированная — до 1000,0 мл (рН 7,4). Среда Хью-Лейвсена. Пептон — 2,0 г, агар - 3,0 г, натрий хлористый — 5,0 г, калий фосфорнокислый двузамещенный — 0,3 г, 0,2 %-ный водный раствор бромтимолового голубого — 15,0 мл, глюкоза — 10,0 г, дистиллированная вода — до 1000,0 мл. Цетримидный агар. Пептон — 20,0 г, агар —13,0 г, магний хлористый — 1,4 г, калий сернокислый — 10,0 г, цетримид (цетилтриметиламмония бромид) - 0,3 г, глицерин — 10,0 г, вода дистиллированная — до 1000,0 мл (рН 7,2). Селективная среда (Мороз, Бекбергенов, Афиногенов). Пептон — 20,0 г, агар — 10,0 г, калий сернокислый — 7,0 г, магний хлористый — 15,0 г, магний сернокислый — 1,5 г, цетилпиридиния хлорид — 2,0 г, вода дистиллированная — до 1000,0 мл (рН 6,8-7,0). Среда с ацетамидом. Агар — 15,0 г, натрий хлористый — 5,0 г, магний сернокислый — 0,2 г, аммоний фосфорнокислый однозамещенный — 1,0 г, калий фосфорнокислый двузамещенный — 1,0 г, ацетамид — 20,0 г, вода дистиллированная — до 1000,0 мл (рН 6,7). Среда Паллерони—Дудорова. Хлористый аммоний — 1,0 г, магний сернокислый — 0,5 г, железо аммоний цитрат — 0,05 г, хлористый кальций — 0,005 г, 0,33 М Na-К фосфатный буфер (рН 6,8) — до 1000 мл. Первые два ингредиента добавляют к буферному раствору и автоклавируют при 115°С 30 минут. Железа аммонийцитрат и хлористый кальций стерилизуют путем фильтрации и вносят в основной раствор асептически (перед засевом среды). Картофельно-глицериновая среда. Вырезанные из очищенного картофеля цилиндры диаметром 1 см и длиной 4-5 см разрезают по диагонали для получения клиньев. Клинья выдерживают 2 ч в 1%-ном растворе бикарбоната натрия, после чего подсушивают и в течение 2 суток вымачивают в 5-6%-ной глицериновой воде или бульоне. Опускают основанием вниз в пробирки с 5%-ной глицериновой водой. Для того чтобы картофель не касался глицериновой воды, используют пробирки с перетяжкой в нижней части или в них опускают короткие стеклянные палочки. Среду автоклавируют при 115-120°С 20 минут. Пробирки со средой хранят в наклонном положении плоской поверхностью картофеля вниз (с целью сохранения поверхности для посева влажной). Микроорганизмы рода Frаncisella Francisella — мелкие кокковидные (до эллипсоидных) при культивировании на подходящей среде, впоследствии плеоморфные палочки; неподвижные, спор не образуют. Строгие аэробы; не растут на обычных средах; расщепляют некоторые углеводы с образованием кислоты, образуют H2S. Распространены во многих пресноводных водоемах; могут паразитировать у человека, млекопитающих, птиц и членистоногих; род представлен видами Francisella novicida (известен один уникальный штамм, выделенный из озерной воды в США) и Francisella tularensis (возбудитель туляремии — болезнь Фрэнсиса). Заболевание впервые описано японскими врачами (1837). До открытия Охарой (1925) новой бактерии, названной кокком Охары-Хагч, болезнь не связывали с конкретным возбудителем. Как возбудитель чумоподобной лихорадки земляных белок (Cytellus beechei) микроорганизм также выделили Маккой и Чепин (1911) в районе озера Туляре (графство Туляре, штат Калифорния). Позднее была установлена эпидемическая связь заболевания с кровососущими членистоногими (1924), лишь в 1928 г. Фрэнсис доказал идентичность туляремии и болезни Охары. Нозогеографически туляремия принадлежит к распространенным инфекциям, ее регистрируют повсеместно в Северном полушарии (исключая Англию) в ареале между 30° и 70° с. ш. На территории РФ впервые официально выделена данная культура С. Суворовым и др. в 1926 г (Астраханская область). Возбудитель дифференцируют на экологогеографические расы и варианты. Тип A (Nearctica) выделяют от многих грызунов и кровососущих насекомых; высоковирулентен для человека и кроликов; ферментирует глицерин, содержит цитруллинуреидазу. Тип распространен в Северной Америке; очень патогенен для человека. Тип В (Palaearcticа) выделяют из воды и от водных животных; маловирулентен для человека и кроликов; не ферментирует глицерин, не содержит цитруллинуреидазу. Возбудитель регистрируют в Европе и Азии; не ферментирует глицерин, умеренно патогенен для домашних кроликов и человека, вариант japonica выделяют в Японии (ферментирует глицерин), вариант mediasiatica вызывает заболевания в Средней Азии в дельтах рек Или и Аму-Дарьи (ферментирует глицерин, содержит цитруллинуреидазу; умеренно патогенен для домашних кроликов и человека). Распространение Francisella tularensis выделена от многих диких и домашних животных, а также птиц, рыб и земноводных. Основные источники заражения человека — обыкновенные полевки (Microtus arvalis), домовые мыши (Mus musculus), водяные крысы (Arvicola terrestis), ондатры (Ondathra zibethica), а также зайцы, особенно русак (Lepus europeus) и беляк (L. timidus). Переносчики инфекции — кровососущие членистоногие: иксодовые и гамазовые клещи, блохи, слепни (оленьи мухи), комары, москиты. На юго-западе США бактерии выделяют из оленьих мух; на северо-западе — из лесных клещей. На востоке США возможными источниками инфекции для человека считают белок-летяг (Pternmyidae). Человек заражается от больных животных, кровососущих членистоногих или объектов внешней среды. Пути заражения: контактный (через кожу и слизистую оболочку глаз), инокулятивный (при укусе переносчика), алиментарный (через ЖКТ) и аспирационный (через дыхательные пути). Морфология Клетки Francisella tularensis — мелкие (размером 0,1-0,5 мкм), неподвижные капсулированные грамотрицательные палочки с выраженным полиморфизмом (от кокковидных до нитевидных форм), особенно у неарктических видов. В мазках из культур доминируют кокковидные формы, в мазках из органов — коккобактерии, которые возможно слабо воспринимают краситель и окрашиваются бледнее, чем прочие патогенные микроорганизмы, однако бактерии легко воспринимают краску Гимзы; в мазках-отпечатках не дают биполярной окраски, что отличает их от возбудителя чумы, но в чистой культуре могут окрашиваться биполярно. Размножаются почкованием. Отличий в микроструктуре клеток различных рас не отмечают: у авирулентных штаммов находят массированное подобие капсулы, у вирулентных — нестойкое слизистое вещество. Клеточная стенка имеет гладкие контуры. Колонии. На обогащенных агаровых средах колонии Francisella tularensis мелкие, в виде капелек беловатого цвета с голубоватым отливом, круглые, с ровным краем, выпуклые и блестящие. При разреженном посеве через несколько суток достигают диаметра 2 мм и более (рост становится заметным с 3-5 суток культивирования). Изолированные колонии удобно получать при посеве на среды О. Емельяновой или Маккоя; используют также агар с переваром сердечной мышцы, дополненный 5% крови барана или кролика. Колонии вирулентных штаммов по морфологии и биологическим свойствам соответствуют S-диссоциатам. На жидких средах размножаются хуже и только у поверхности среды, что связано, по-видимому, с аэрофильностью бактерий; более удовлетворительных результатов достигают аэрацией среды или внесением биоколлоидов (яичного желтка, агара и т.д.). Культуральные свойства У Francisella tularensis оптимальный рост наблюдают только в аэробных условиях; температурный оптимум 36-37°С (пределы 5-43оС). Бактерии культивируют на сложных агаровых или желточных средах с добавлением тканевых экстрактов, цистеина, кроличьей дефибринированной крови и других питательных веществ. Включение в питательную среду полимиксина В или пенициллина подавляет рост других микроорганизмов. Ферментируют до кислоты глюкозу, мальтозу, левулезу и маннозу (американские, среднеазиатские и японские штаммы дополнительно и глицерин), но определить эту способность можно только на специальных средах с ограниченным содержанием белка и точно определенным рН: наиболее точные результаты ферментации углеводов и спиртов получают манометрией на аппарате Варбурга. Имеют следующие ферменты: каталазу, глутаминазу, аспарагиназу, дез- и трансаминазу, цитруллинуреидазу. Индол не образуют, продуцируют аммиак и сероводород, редуцируют некоторые краски, например тионин, метиленовый синий, малахитовый зеленый и др. Работа с кровью, мокротой или аспиратами лимфатических узлов больного связана с большим риском для сотрудников лаборатории и предъявляет особые требования к ее оснащению и квалификации персонала. Патогенез После проникновения возбудителя в организм его дальнейшее распространение происходит, как правило, с током лимфы и реже через кровоток, куда он попадает позднее (что создает угрозу генерализации). Фагоциты активно поглощают Francisella tularensis, но они не способны к их внутриклеточному киллингу, что создает предпосылки для депонирования бактерий в лимфатических узлах. Часть возбудителей при этом погибает, что сопровождается выделением эндотоксина, действующего на узел и окружающие ткани. Таким образом, вслед за стадией лимфогенного заноса развивается стадия очаговых реакций, в результате чего формируются туляремийные бубоны. По аналогии с чумой человека последние разделяют на первичные (возникают метастатически лимфогенно и связаны с местом входных ворот) и вторичные, а также на бубоны первого порядка, второго и т.д., учитывая время их появления. Периодически из сформированных очагов возбудитель проникает в лимфо- и кровоток, что сопровождается выделением новых порций эндотоксина и сенсибилизацией (регистрируют кожными пробами). Прорывы бактерий могут приводить к метастазированию в печень, селезенку, легкие, костный мозг и другие органы, что обусловливает вторичные поражения (например, вторичную пневмонию, менингит и т.д.). Лабораторная диагностика Предположительный диагноз основывают на соответствующем анамнезе и клинических проявлениях. Наиболее достоверные результаты дает выделение Francisella tularensis (рис. 14), однако культивирование возбудителя сопряжено не только с трудностями, но и с угрозой заражения персонала и разрешено только в лабораториях особо опасных инфекций.
Рисунок 14. Принципиальная схема бактериологического выделения возбудителя туляремии При отсутствии возможности выделения возбудителя используют биологический метод, основанный на заражении лабораторных животных (мышей или морских свинок) патологическим материалом (пунктат бубона, слизь из зева, гнойное отделяемое слизистой оболочки глаза, кровь и т.д.) с последующей идентификацией микроба агглютинирующей сывороткой. Материал из бубона следует брать до 14-20 суток болезни, из слизистой оболочки глаза — до 17 суток, кровь — до 6 дня заболевания. Серологические методы. Наличие AT к Francisella tularensis в сыворотке больного определяют в реакции агглютинации с туляремийным диагностикумом; положительной считают видимую глазом реакцию при разведении сыворотки 1:100 и больше (положительные результаты на 1 неделе выявляют у 12,5% больных, на 4 — у 93,2%). Возможна экспресс-диагностика, основанная на идентификации Аг в мазках из очагов поражений AT, меченными флюоресцеинами. Для ранней диагностики эффективна аллергическая кожная проба. В качестве Аг используют тулярин — взвесь бактерий, убитых нагреванием до 70°С.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 716; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |