Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Токсины и клинические проявленияСодержание книги
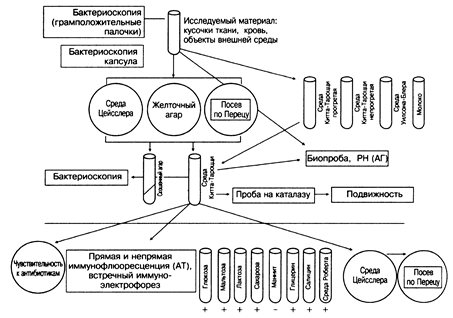
Поиск на нашем сайте Токсины. Clostridium perfringens образует как минимум 12 идентифицированных токсинов (ферментов) и энтеротоксин; у гиалуронидазы и дезоксирибонуклеазы (m- и n- токсины) токсичность не доказана; b-, g-, h-, d-, e‑, q- и i-токсины обладают летальным свойством, но их биохимическая активность изучена недостаточно, и только a-, k- и l-токсины – ферменты с выраженным токсическим действием. Мишени для действия основных токсинов — биологические мембраны в различных тканях, в основе поражения находятся ферментативные процессы, катализирующие гидролитическое расщепление и нарушение клеточной проницаемости с последующим отеком. Последний сопровождается снижением окислительно-восстановительного потенциала в клетках, активацией эндогенных протеаз, приводящих к аутолизу тканей, характерному для газовой гангрены. a-Токсин (лецитиназа С) проявляет дерматонекротизирующее, гемолитическое и летальное (убивает лабораторных животных при внутривенном введении) действие, опосредованное лецитиназной (фосфолипазной) активностью (разлагает лецитин на фосфорилхолин и глицериды), продуцируют все типы Clostridium perfringens, но наиболее интенсивно тип А. b-Токсин вызывает некроз тканей и оказывает летальное действие на морских свинок-альбиносов, гемолитического действия не оказывает, активность in vivo реализуется в развитии некротических энтеритов, основные продуценты — типы В и С. d-Токсин проявляет гемолитическую активность в отношении эритроцитов барана, но не в отношении эритроцитов кролика или лошади, оказывает летальное действие на лабораторных животных, основные продуценты — типы В и С. q-Токсин оказывает гемолитическое (кислород-чувствительное), дерматонекротизирующее и летальное действие, разрушает эритроциты барана и лошади, а также (незначительно) мыши, основной продуцент — Clostridium perfringens типа С, типы А, В, D и Е образуют его в меньших количествах. e- и i-токсины оказывают летальное и дерматонекротизирующее действие, протоксины, выявляемые в фильтратах культур, активируются трипсином. e-токсин продуцируют типы В и D, i-токсин — штаммы типа Е. k-токсин (коллагеназа и желатиназа) разрушает ретикулярную ткань мышц и коллагеновые волокна соединительной ткани, активно усиливает цистеин в присутствии Fe2+, оказывает летальное и некротизирующее действие, продуценты — типы А, С, Е и некоторые штаммы типа D. l-токсин (протеиназа) расщепляет денатурированный коллаген и желатин, во многом действует подобно фибринолизину, как и e-токсин, секретируется в форме протоксина, активируемого трипсином. Проявляет активность экзоэнзима, обусловливающего некротические свойства. g-и h-токсины оказывают летальное действие на лабораторных животных; их биохимическая природа остается неизвестной. m- и n-токсины по своей химической природе — гиалуронидаза и дезоксирибонуклеаза, m-токсин ответствен за повышение проницаемости тканей, n-токсин расщепляет нуклеиновые кислоты, тем самым нарушая реакции белкового синтеза. Фильтраты микробных культур Clostridium perfringens могут содержать также различные токсические вещества (например, фибринолизин и гиалуронидазу). Энтеротоксин образуют Clostridium perfringens типов А и С, вызывающие пищевые токсикоинфекции, по своей природе он термолабильный протеин, продуцируемый при споруляции бактерий в толстой кишке, его практически не образуют лабораторные культуры, и он быстро разрушается при термической обработке пищевых продуктов, что значительно затрудняет его биохимическое изучение и идентификацию; вызывает рвоту и диарею, оказывает летальное действие, а также обусловливает появление эритематозной кожной сыпи у лабораторных животных. Диарея развивается вследствие потери воды и электролитов за счет дилатации и повышения проницаемости капилляров. Газовая гангрена развивается при попадании Clostridium perfringens на раневые поверхности, где бактерии активно размножаются в условиях пониженного содержания кислорода. Микроорганизмы, а чаще их споры, могут быть занесены в раны из внешней среды, а также с кожи или из ЖКТ пациента Для поражений характерны некроз тканей и образование газа с гнилостным запахом. Обильное образование газа характерно преимущественно для анаэробных раневых инфекций, вызванных данным микроорганизмом, известным также как палочка газовой гангрены. Характерная особенность гистологических препаратов, полученных из очагов поражения — практически полное отсутствие фагоцитов в очаге некротических поражений. Пищевые токсикоинфекции, вызванные серотипами А и С, приобретают все большую значимость и представляют актуальную проблему для здравоохранения большинства стран мира. Clostridium perfringens типа А вызывает преимущественно токсикоинфекции легкой и средней тяжести, инкубационный период составляет 6-24 ч; заболевания развиваются остро, с ощущениями боли в животе, рвотой (иногда с кровью) и диареей (до 20 раз в сутки), общие нарушения проявляются слабостью, головокружениями, повышение температуры наблюдают редко. Симптомы исчезают в последующие 12-24 ч. Летальные исходы наблюдают редко, обычно у ослабленных пациентов — пожилых лиц, хронических больных и детей с нарушениями питания. Следует помнить о способности микроорганизмов проникать в кровоток и вызывать тяжелый анаэробный сепсис. Более тяжело протекает некротический энтерит, вызванный штаммами серотипа С. При острых формах болезнь может закончиться смертью пациента в течение 12-24 ч. Симптомы аналогичны поражениям, вызываемым бактериями серотипа А, и обусловлены действием b-токсина, подобные пациенты нередко попадают на операционный стол с диагнозом «кишечная непроходимость», смертность достигает 35%. Заболевание регистрируют достаточно редко; большое число случаев наблюдали в Германии после второй мировой войны (в 1945-1948 гг. — 1056 случаев), а в настоящее время периодически отмечают в Новой Гвинее, что связано с особенностями национальной кухни. Термоустойчивость спор. Даже внутри серотипа А она может меняться в зависимости от штамма. При варке мяса некоторые споры погибают в течение нескольких минут, тогда как другие выдерживают кипячение в течение часа и дольше (особенности штамма). Споры, находящиеся в жировой ткани, выживают на протяжении длительного времени (до 6 часов). Повышение температуры до 75°С стимулирует прорастание спор, температурный оптимум для роста в вареном мясе 43°С, в оптимальных условиях дочерние популяции образуются в течение 12-13 минут. Лабораторная диагностика В соответствии с методическими указаниями по лабораторной диагностике (1979) предусмотрено обнаружение и идентификация токсина в содержимом тонкого кишечника в реакции нейтрализации на белых мышах. Параллельно проводится выделение и идентификация возбудителя по тинкториальным, культуральным и токсигенным свойствам, изучение ферментативных свойств не предусмотрено. Используются лабораторные животные. Выделение проводят по общепринятой схеме (рис. 2). При смешанных инфекциях можно прогреть исследуемый материал и выделить Clostridium perfringens из термоустойчивых спор, внесенных в питательную среду, с последующим развернутым анализом. Идентификация микроорганизма осуществляется набором стандартных тестов — подвижность, серологические реакции и др.; Clostridium perfingens также можно идентифицировать по росту на яичном агаре: колонии С. perfringens окружены опалесцирующим белым «преципитатом», появляющимся под действием a-токсина (лецитиназы С); образование зон преципитации можно ингибировать, наслоив на половину чашки специфическую антисыворотку одновременно с посевом тест-культуры.
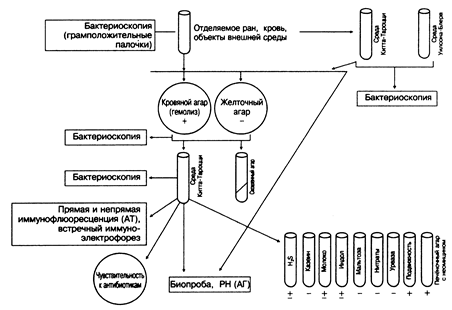
Рисунок 2. Схема бактериологического исследования на Clostridium perfringens Столбнячная палочка Clostridium tetani вызывает столбняк — тяжелое заболевание, опосредованное нейротоксическим действием бактериального экзотоксина (тетаноспазмина), ведущее проявление — судорожный синдром, включающий болезненные сокращения мышц (тетанус) и длительное напряжение мышц (мышечная ригидность). Характерными проявлениями последнего считаются опистотонус (тетанический спазм, при котором позвоночник и конечности согнуты, больной лежит на спине и опирается на затылок и пятки) и risus sardonicus (risus caninus) — подобие оскала, вызванного спазмом мышц головы. Возбудитель столбняка практически одновременно открыли Монастырский (1883) и Николайер (1884), в чистой культуре впервые выделен Китазато (1889). Распространение Микроорганизмы встречаются повсеместно, но точных статистических данных об их распространении нет, так как во многих странах болезнь не подлежит обязательной регистрации. Тем не менее, ежегодная смертность от столбняка превышает 100 000 человек. Естественный резервуар и источник инфекции — почва, хотя многие исследователи бопее склонны считать резервуаром инфекции толстую кишку сельскохозяйственных и диких животных. Входные ворота инфекции — бытовые и производственные травмы, причем наиболее часто поверхностные, когда больной не обращается за медицинской помощью. Повышенную заболеваемость отмечают в регионах с теплым климатом, создающим условия не только для длительного сохранения спор в почве, но и для их прорастания и размножения вегетативных форм. Заболеваемость значительно возрастает во время военных действий у раненых; основная группа риска в мирное время — работники сельского хозяйства (составляют 80-86% заболевших). Морфология возбудителя Вегетативные клетки. Бактерии представляют собой грамположительные палочки с закругленными концами длиной 4-8 мкм и толщиной 0,3-0,8 мкм (в молодых культурах иногда образуют нитевидные клетки), располагаются одиночно или цепочками, подвижны (содержат 20 и более жгутиков, расположенных по периферии клетки), но в старых культурах (30 сут. и более) преобладают неподвижные формы. Облигатные (строгие) анаэробы, отличаются высокой чувствительностью к О2; у бактерий отсутствуют цитохромы, цитохромоксидаза, пероксидаза и каталаза. Споры круглые, реже овальные, расположены терминально, их диаметр в 2-3 раза превышает толщину бактерий, вследствие чего спорангий имеет форму теннисной ракетки или барабанной палочки. Их отличает высокая устойчивость к химическим и физическим воздействиям, в частности, они выживают в течение 8-10 ч в 1% растворе сулемы и 5% растворе фенола, а также выдерживают кипячение в течение 0,5-1 ч. Спорообразование начинается на 2-3 сутки; на 4-6 сутки роста на жидкой среде вегетативные клетки разрушаются, и в среде остаются почти одни споры. Морфология колоний. На МПА и желатине в строго анаэробных условиях возбудитель растет медленно и образует тонкие прозрачные колонии с ровными или шероховатыми краями, рост колоний характерный — сначала на поверхности среды появляется сеточка, образованная сливающимися колониями с отростками. Растет в виде прозрачных или серовато-желтых шероховатых (R) и гладких (S) колоний. При посеве столбиком в полужидкий агар через 24-48 ч формирует колонии в виде чечевичек (R-форма) или пушинок с плотным коричневым центром (S-форма). Антигенная структура У Clostridium tetani выявляют О- и Н-Аг. По жгутиковым Аг выделяют 10 сероваров, все серовары продуцируют идентичные по своим антигенным свойствам тетаноспазмин и тетанолизин. Биохимия Основные продукты метаболизма — уксусная, масляная, пропионовая кислоты, этанол. Большинство штаммов не обладает сахаролитической активностью, но выделено несколько штаммов, ферментирующих глюкозу. Clostridium tetani проявляет слабые протеолитические свойства; медленно расщепляет белки и пептоны до аминокислот (последние разлагаются до угольной кислоты, водорода, аммиака, летучих кислот и индола); для роста необходимы аргинин, гистидин, тирозин, валин, изолейцин, лейцин и триптофан. Бактерии образуют желатиназу и рениноподобный фермент, опосредующий появление затемненных зон вокруг колоний С. tetani на молочном агаре. Патогенность Патогенность Clostridium tetani обусловлена способностью образовывать тетаноспазмин и тетанолизин: действие этих токсинов на организм, в особенности тетаноспазмина, вызывает столбняк у человека и животных. Тетаноспазмин — полипептид; Mr 150 000 Д; действует дистанционно, т.к. бактерии редко покидают пределы раны. Считают антигенно однородным, хотя обнаружено 4 группы детерминант, но их структура и локализация плохо изучены. Токсин фиксируется на поверхности отростков нервных клеток, проникает в них (за счет лигандопосредованного эндоцитоза) и посредством ретроградного аксонного транспорта попадает в ЦНС. Механизм действия связан с подавлением высвобождения тормозных нейромедиаторов (в частности, глицина и g-аминомасляной кислоты) в синапсах (токсин связывается с синаптическими белками синаптобревином и целльбревином). Первоначально токсин действует на периферические нервы, вызывая местные тетанические сокращения мышц. Токсин появляется в культурах на 2 сутки, достигая пика образования к 5-7 дню. Разрушается при длительном хранении в термостате, под действием света и кислорода. Для получения токсина in vitro бактерии можно выращивать на мясных средах, например бульоне Мартена с пептоном, среде Мюллера с настоем бычьего сердца и пептоном из триптического гидролизата казеина; в отечественной практике наибольшее распространение получила среда из кислотного гидролизата казеина, экстракта пшеничных отрубей и дрожжевого экстракта (в среду можно добавлять рыбную муку). Тетанолизин (тетаногемолизин) Clostridium tetani обладает гемолитическим, кардиотоксическим и летальным свойствами, в патогенезе заболевания играет менее важную роль; максимальноe накопление токсина в культуре наблюдают уже через 20-30 ч, процессы его образования не связаны с синтезом тетаноспазмина. Клинические проявления Легкая форма (локальный столбняк) характеризуется периодическими спазмами в пораженной области. Мозговые поражения включают поражения черепных нервов (наиболее часто — VII); характерны тонические спазмы мышц головы и глотки. Генерализованный столбняк — наиболее часто встречаемая форма с характерными мышечными спазмами; из других проявлений можно отметить тахикардию, аритмии, менингит, гипокальциемию. Иммунитет Естественный иммунитет к столбняку отсутствует. В отношении постинфекционного иммунитета существуют противоречивые данные: некоторые авторы считают, что он не формируется, тогда как другие выявляли антитоксин в сыворотках переболевших лиц в концентрациях 0,001-1,5 АЕ/мл. Иммунопрофилактика. Со времен Беринга и Китазато известно, что введение в организм обезвреженного токсина создает выраженный иммунитет к столбняку. Позднее Рамон разработал метод его получения; его высокую эффективность подтвердили единичные случаи столбняка в войсках союзников во время второй мировой войны. Иммуногенные свойства анатоксина увеличивает его сорбция на гидроокиси алюминия. В настоящее время столбнячный анатоксин применяют для активной иммунопрофилактики столбняка, первичною вакцинацию проводят детям в возрасте с 5-6 месяцев до 5 лет (курс включает 3 инъекции с интервалом 30-40 суток); при заболевании применяют столбнячный антитоксин – гипериммунную человеческою антисыворотку (курс — 2 инъекции, в тяжелых случаях — 3 инъекции дробно). Лабораторная диагностика Возбудитель обычно обнаруживают в месте проникновения в организм больного. Поэтому наиболее рационально исследование различного материала, взятого в месте ранения. В тех случаях, когда входные ворота неизвестны, следует тщательно осмотреть больного для выявления ссадин, царапин, катаральных и воспалительных процессов, необходимо обратить внимание на старые рубцы после ранения, т.к. возбудитель может долго в них сохраняться; в некоторых случаях исследуют слизь из носа, бронхов, глотки, налет с миндалин, а также выделения из влагалища и матки (при послеродовом столбняке или аборте). При бактериологическом исследовании трупов также принимают во внимание возможность генерализации инфекции. Для анализа забирают кровь (10 мл) и кусочки печени и селезенки (20-30 г). Выделение возбудителя проводят по стандартной схеме (рис. 3) Исследованию подлежит материал от больного или трупа, перевязочный и шовный хирургический материал, а также почва, пыль и воздух.
Рисунок 3. Схема бактериологической идентификации Clostridium tetani Биологическая проба. При исследовании материала от больного или трупа параллельно бактериологическому анализу проводят обнаружение столбнячного анатоксина в биологической пробе на мышах. Для этого материал измельчают, добавляют двойной объем физиологического раствора, инкубируют в течение часа при комнатной температуре, фильтруют, часть фильтрата смешивают с противостолбнячной сывороткой из расчета 0,5 мл (200 АЕ/мл) сыворотки на 1 мл экстракта и инкубируют 40 минут. Затем одной группе животных вводят экстракт без предварительной инкубации с сывороткой, а другой группе — проинкубированную смесь, при наличии Clostridium tetani у животных первой группы развиваются симптомы столбняка. Clostridium botulinum Clostridium botulinum — возбудитель ботулизма, тяжелой, часто фатально заканчивающейся пищевой токсикоинфекции. В России первое клинико-эпидемиологическое описание ботулизма привел Зенгбуш (1818); возбудитель открыл ван Эрменген (1869). Распространение Clostridium botulinum широко распространены в почве. Заболевание регистрируют повсеместно, исключая районы вечной мерзлоты. Наиболее часто заболевания вызывают типы А и В, тип G первично выявлен в Аргентине, а тип Е более распространен в регионах, включающих большие естественные водоемы, — Северной Японии, области Великих озер (США, Канада), Швеции, Дании, Британской Колумбии (Канада), РФ, где бактерии настолько обильно колонизируют придонный ил, что отмечаются случаи заражения рыб. Периодическое пересыхание водоемов стимулирует рост Clostridium botulinum. Для профилактики интоксикаций продуктами промышленного производства при консервировании мяса широко применяют нитриты; в этом плане наибольшую опасность представляют мясные, рыбные и овощные консервы домашнего приготовления. Естественный резервуар и источник инфекции — почва и различные животные. Морфология возбудителя Вегетативные клетки — палочки с закругленными концами размером 4-8´0,6-0,8 мкм, подвижны (перитрихи). При неблагоприятных условиях образуют эндоспоры, расположенные терминально и субтерминально. Строгие анаэробы; молодые культуры окрашиваются грамположительно, 4-5-суточные — грамотрицательно. Оптимум рН для роста 7,3-7,6, для прорастания спор 6,0-7,2. Морфология колоний. На кровяном агаре с глюкозой образуют очень мелкие сероватые или мутные желтоватые колонии линзообразной формы (на различных средах у одного и того же штамма могут варьировать). Вокруг колонии образуются зоны гемолиза различной ширины. На печеночном агаре образуют полиморфные звездчатые колонии, на желатине — сероватые, окруженные зоной разжиженного желатина. На столбике агара можно обнаружить диссоциаты, R-формы имеют форму чечевичных зерен, S-формы — пушинок. Хорошо растут на жидких средах (обычно на бульоне Тароцци, бульонах из гидролизатов казеина, мяса или рыбы) при условии предварительного удаления О2 из среды кипячением в течение 15-20 мин с быстрым охлаждением. Вызывают помутнение среды и газообразование, иногда имеется запах прогорклого масла, но этот признак непостоянен. Антигенный состав Серологическая идентификация Clostridium botulinum основана на выявлении токсинов, по их структуре бактерии разделяют на 8 сероваров — А, В С1(a), С2(b), D, Е, F и G. Антигенная структура бактерий остается малоизученной, показано наличие жгутиковых, группоспецифических (Н) и соматических, типоспецифических (О) Аг, не проявляющих токсических свойств. Оптимальная температура для токсинообразования вариабельна для бактерий типов А, В, С и D 35°С, для бактерий типов Е и F 28-30°С Биохимические свойства Все типы Clostridium botulinum образуют желатиназу, лецитиназу и Н2S, проявляют широкий спектр сахаролитической активности (бактерии типов А, В, Е и F ферментируют глюкозу, левулезу, фруктозу, мальтозу и сахарозу типов С и D — глюкозу и мальтозу, тип G инертен к углеводам). Clostridium botulinum типов А и В обладают выраженными протеолитическими свойствами, разлагают свернувшийся яичный белок и гидролизуют желатин По биохимическим свойствам выделяют 4 группы. Бактерии I группы проявляют выраженные протеолитические свойства, гидролизуют желатин и эскулин, ферментируют глюкозу и мальтозу, проявляют липазную активность на яичном агаре. Бактерии II группы проявляют сахаролитическую активность, но лишены протеолитической. Бактерии III группы проявляют липазную активность и гидролизуют желатин. Бактерии IV группы гидролизуют желатин, но, в отличие от прочих возбудителей ботулизма не проявляют сахаролитических свойств и липазной активности, что послужило основанием для предложения выделить их в отдельный вид —Clostridium argentiense. Патогенность Патогенность Clostridium botulinum различна для различных видов млекопитающих; заболевания человека вызывают бактерии типов А, В, Е и F; Clostridium botulinum типов С и D вызывают заболевания животных и птиц (в редких случаях от больных животных выделяют бактерии типов А и В). Патогенность типа G для человека и животных не доказана. Клинические проявления преимущественно обусловлены действием нейротоксина (т.к. в условиях организма размножение вегетативных форм Clostridium botulinum затруднено) и включают: · классическую пищевую токсикоинфекцию, более распространенную под названием «ботулизм»; · раневой ботулизм (возникает при загрязнении некротизированных тканей почвой); · ботулизм новорожденных (у детей от 3 до 20 недель), характерны генерализованная гипотония и амиотрофия, развивается при заглатывании спор с последующим развитием вегетативных форм (в США ежегодно регистрируют около 70 случаев); · неопределенно классифицируемый ботулизм (у детей старше одного года и взрослых), не связанный с указанными факторами риска (пища, рана). Фармакокинетическая активность токсинов различных типов Clostridium botulinum практически одинакова: все они сорбируются на клетках слизистой оболочки кишечника, проникают в кровь (где их можно выявить серологически) и в периферические нервные окончания. Фармакологическое действие включает связывание Н-цепи токсина с мембраной, поглощение токсина и формирование пор в синаптических пузырьках (каждую пору формируют 4 молекулы токсина), что приводит к блокированию слияния синаптических пузырьков с мембраной; мишень для действия — интегральные синаптические белки. В частности, токсины серотипов В, D и F расщепляют синаптобревин, А и Е — SNAP-25, С — синтаксин, D и F — целлюбревин. Избирательно поражают a-моторные нейроны передних рогов спинного мозга, что обусловливает характерные параличи мышц. Токсины термолабильны, но для полной инактивации требуется кипячение в течение 20 минут. Клинические проявления. Временной интервал между попаданием токсина в организм и появлением первых признаков ботулизма обычно не превышает 24 ч, но может варьировать от 4-6 до 96 ч и более. Проявления зависят от природы продукта, ставшего причиной отравления, количества токсина, поступившего в организм, и состояния больного. Первые, но непостоянные признаки — расстройства ЖКТ (тошнота, рвота, боли в животе). Часто больные жалуются на сухость во рту или гиперсаливацию. Одновременно развиваются головная боль и нервно-паралитические явления — нарушение глотания, дисфагия и офтальмоплегический синдром; часто наступают односторонний или двусторонний блефароптоз и анизокория — результат поражения сфинктера зрачка. Циркуляция токсина в кровотоке приводит к уменьшению притока крови к правому предсердию. Кроме поражения ЦНС, ботулотоксин вызывает периферические поражения нервно-мышечной передачи, проявляющиеся сначала вялостью движений или полной адинамией с последующим развитием парезов и/или параличей глазных, глоточных и гортанных мышц, а также мышц шеи и конечностей. Довольно часто случаи детского ботулизма связаны с кормлением детей медом. Первый такой случай зарегистрирован в 1943г.; симптоматика раневого ботулизма аналогична таковой при пищевом отравлении и обусловлена действием токсина, выделяемого бактериями в ране. Токсин Clostridium botulinum — белок, оказывающий нейротоксическое действие. В зависимости от типа возбудителя, идентифицируемого по антигенной структуре токсина, Mr может варьировать от 60 до 150 кД. Представлен Zn2+-зависимыми эндопептидазами, при протеолизе разлагается на 2 связанных дисульфидной связью фрагмента (L- и Н-цепи). Механизм биологической активности реализуется через связывание Н-цепи с мембраной, проникновение токсина в клетку, формирование пор в пузырьках (каждую пору формируют 4 молекулы токсина), что приводит к блокированию слияния синаптических пузырьков с мембраной. Токсин разрушается при кипячении, легко кристаллизуется в белый хлопьевидный порошок. Токсины всех типов также оказывают гемолизирующее действие. Иммунитет Чувствительность к ботулиническому токсину у различных животных (в том числе одного вида) подвержена резким колебаниям. Абсолютно резистентные виды неизвестны, но всеядные животные обладают меньшей чувствительностью. Динамика заболевания не сопровождается выработкой значимых титров AT, что связано с незначительной (с точки зрения иммуногенных свойств) дозой токсина, вызвавшей поражение. Перенесенное заболевание не оставляет антитоксического иммунитета. У выздоровевших пациентов в сыворотке определяют AT к токсинам и микробным клеткам, что свидетельствует о комплексном характере иммунного ответа, направленного как на связывание токсина, так и на элиминацию возбудителя. Следовательно, ботулизм можно рассматривать не только как интоксикацию, но и как токсикоинфекцию (конечно, не отрицая ведущей роли токсина в патогенезе заболевания). Лабораторная диагностика Выделение возбудителя проводят по общепринятой схеме (рис. 4). Лабораторному исследованию подлежат остатки пищевых продуктов, материал, полученный от больного, секционный материал. Кровь берут из вены пациента в количестве 5-10 мл и разводят 3-4% раствором цитрата натрия в соотношении 2:1, промывные воды из желудка забирают в объеме 50-100 мл, кал — 50-60 г. На секции забирают кусочки печени (50-60 г), отрезки кишечника и желудка и их содержимое. До поступления в лабораторию образцы хранят на холоде. Кровь исследуют только на наличие токсина с помощью биологической пробы на мышах (вводят 2 мл) или морских свинках (вводят 5-8 мл). Испражнения исследуют только на наличие возбудителя посевом на питательные среды, весь остальной материал — на наличие токсина и возбудителя. Банки с консервами выдерживают в термостате 10-12 суток, стерильно отбирают 50-100 г, растирают и центрифугируют, в надосадочной жидкости определяют токсин, в осадке — возбудитель. Мясо и рыбу обрабатывают спиртом и забирают пробы из внутренних частей (пробы рыбы рекомендуют брать от хребта и внутренних органов). Пробы изучают аналогично исследованиям консервированных продуктов.
Рисунок 4. Принципиальная схема бактериологического выделения Clostridium botulinum Clostridium novyi Clostridium novyi (Clstridium oedematiens типа А) — как и Clostridium perfringes – основной возбудитель анаэробной раневой инфекции, также известной как газовая гангрена, газовый или злокачественный отек, инфекционного некротического гепатита овец. Впервые раневая госпитальная гангрена была описана Паре в 1562 г, через 3 столетия Вельпо (1839) опубликовал свои наблюдения над подобным заболеванием, названным им «травматическая эмфизема». Полное описание клинической картины и течения разлитых форм газовой инфекции, наблюдаемых им во время Севастопольской и Кавказской кампаний, дал Н.И. Пирогов. Позднее Веинберг и Сэган (1891) установили, что открытая ими бацилла злокачественного отека (Clostridium oedematiens типа А) способна вызывать инфекции у человека; возбудитель позднее (1894) был охарактеризован Нови и получил его имя. В годы второй мировой войны инфекции, вызванные Clostridium novyi, составляли 42% случаев гангрены. Микроорганизм широко распространен в природе, может быть выделен из почвы, осадочных отложений, а также из органов ЖКТ здоровых животных.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 532; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.013 с.) |