Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В микробиологической лабораторииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Микробиология
Рабочая тетрадь
МОСКВА 2016
РАБОЧАЯ ТЕТРАДЬ ПО МИКРОБИОЛОГИИ
Фамилия И.О. __________________________________ Группа _________________________________________ Факультет ______________________________________
Введение Рабочая тетрадь по курсу «Микробиология» предназначена для бакалавров, обучающихся по направлению подготовки «Продукты питания из растительного сырья». В ней изложен учебный материал для лабораторно-практических занятий. Рабочая тетрадь представлена в форме лабораторного журнала, в котором даётся краткая теория выполняемого задания, шаблоны полей зрения для зарисовки изучаемых микроорганизмов, таблицы для записи результатов собственных наблюдений. Каждый раздел курса завершается коллоквиумом, на котором студент в устной форме отвечает на вопросы по заданной теме; примерные вопросы приведены в рабочей тетради. Выполнение каждого задания регистрируется преподавателем. Полностью выполненный курс лабораторно-практических занятий оценивается преподавателем и студент допускается к экзамену. В результате освоения курса лабораторно-практических занятий студент должен уметь: приготовить препараты микроорганизмов, различать основные формы бактерий, готовить искусственные питательные среды для выращивания микроорганизмов, проводить количественный учёт микроорганизмов в различных средах, проводить качественные реакции на продукты микробиологических процессов, ставить и оценивать опыты по трансформации соединений углерода и азота микроорганизмами.
ПРАВИЛА РАБОТЫ В МИКРОБИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
1. Не разрешается входить в лабораторию в пальто, головном уборе, вносить посторонние вещи. 2. К занятиям допускаются студенты только в халатах. 3. Студенты несут ответственность за используемые ими микроскопы, оборудование, чистоту рабочего места. 4. Необходимо ознакомиться с техникой безопасности при работе в микробиологической лаборатории и расписаться в журнале по технике безопасности. 5. Строго соблюдать правила обращения с химическими реактивами и красителями. 6. Запрещается работать с неисправными электроприборами. О всех неполадках сообщать преподавателю. 7. В лаборатории необходимо поддерживать порядок и чистоту. По окончании занятий протереть иммерсионный объектив микроскопа мягкой тканью, привести в порядок рабочее место. 8. Не оставлять открытыми чашки, пробирки, колбы с культурами микроорганизмов, чтобы не допускать их распыления, поскольку некоторые микроорганизмы являются аллергенами. 9. Перед уходом из лаборатории дежурный проверяет, выключены ли газ, вода, электроприборы. Раздел 1. МОРФОЛОГИЯ МИКРООРГАНИЗМОВ
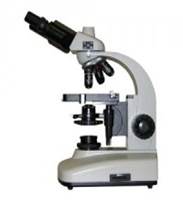
Световой микроскоп 1. На представленном рисунке микроскопа отметить основные составные части его 2. Зарисовать схему хода лучей в сухой и иммерсионной системах:
Техника приготовления фиксированного окрашенного препарата: 1. 2. 3. 4. 5. 6. 7. 8. Техника микроскопирования: 1. 2. 4.
Тестовая контрольная работа «Микроскоп, техника приготовления препаратов и микроскопирования» Прокариоты. Основные морфологические типы бактерий Приготовить фиксированные окрашенные препараты, промикроскопировать и зарисовать шаровидные (Micrococcus agilis, Azotobacter chroococcum, Sarcina flava), палочковидные (Bacillus mycoides, Erwinia herbicola, Lactobacillus acidophilus) и спиралевидные (Vibrio sp., Spirillum sp., Spirochaeta dentium) и нитчатые (Leptothrix ochracea) бактерии. К рисункам предъявляются следующие требования: рисовать простым хорошо отточенным карандашом, по возможности изображать клетки в натуральную величину. Подписи под рисунком должны быть сделаны ручкой, по латыни (помните, что у микроорганизмов бинарная номенклатура). Ниже указать общее увеличение микроскопа. Шаровидные формы
Палочковидные формы
Спиралевидные формы
Нитчатые формы Записать методику приготовления препарата в раздавленной капле:
1.
2.
3.
Приготовить препарат в раздавленной капле железобактерий Leptothrix ochracea, представляющих нитчатые формы бактерий.
Актиномицеты Приготовить и посмотреть фиксированный окрашенный препарат актиномицета Streptomyces chromogenes.
Микроскопические эукариоты
Приготовить препараты: дрожжей Saccharomyces cerevisiae, Schizosaccharomyces pombe, Candida kefir (фиксированные, окрашенные), микроскопических грибов Mucor stolonifer, Aspergillus niger, Penicillium expansum, Fusarium sp. и др. (в раздавленной капле). Грибы просмотреть сначала с увеличением объектива × 10, затем с увеличением × 40. Зарисовать спорангии, конидиеносцы, конидии. Дрожжи
Микроскопические грибы
Простые и сложные методы окраски микроорганизмов. Выявление включений и спор, окраска по Граму
Теория вопроса. Окрасить включения в клетках микроорганизмов: гликоген в клетках Saccharomyces cerevisiae, гранулезу в клетках маслянокислых бактерий Clostridium butyricum, жир в клетках Saccharomyces cerevisiae. Приготовить препараты в раздавленной капле. Заполнить таблицу 1 и оформить рисунки (цветными карандашами). Методика окраски включений: Гранулеза –
Гликоген –
Жир –
Таблица 1 Исследуемого субстрата
Таблица 4 ОРГАНИЧЕСКИХ ВЕЩЕСТВ Теория вопроса. Спиртовое брожение Постановка опыта. Воспроизвести в лабораторных условиях процесс спиртового брожения, осуществляемый дрожжами. Опыт ставят в нестерильных условиях, однако в среде будут развиваться преимущественно дрожжи, благодаря созданию элективных условий, т.е. будут учтены избирательные потребности дрожжей - возбудителей спиртового брожения в специфических условиях развития, при этом жизнедеятельность других групп микроорганизмов будет подавлена.
Элективные условия для дрожжей - возбудителей спиртового брожения:
1.
2.
3.
4.
Опыт выполняют в строго контролируемых условиях, используя колбу Эрленмейера объемом 250 - 300 мл с каучуковой пробкой, в которую вставлен затвор Мейссля с резиновым клапаном Бунзена, представляющим собой резиновую трубочку с продольным надрезом, закрытую бусиной. В колбу из мерного цилиндра наливают 100 мл жидкой питательной среды, добавляют 0,5 г дрожжей (Saccharomyces cerevisiae). Затем плотно закрывают колбу каучуковой пробкой с затвором и взвешивают всю систему на весах с точностью до второго знака. Массу системы, фамилию, номер группы, факультет записывают на этикетке, и колбу с этикеткой помещают в термостат. Результаты опыта. За время инкубации в термостате (одна неделя) дрожжи активно развиваются, образуя в процессе спиртового брожения диоксид углерода и этиловый спирт. Уравнение спиртового брожения:
Углекислый газ легко выделяется через отверстие в клапане Бунзена, в то время как пары воды задерживаются затвором Мейссля. Воздух внутрь колбы не проходит. Взвесив систему, по разности в массе определить количество выделившегося диоксида углерода, далее по уравнению спиртового брожения рассчитать количество образовавшегося спирта, сброженной сахарозы.
Расчеты провести в следующей последовательности. 1. Определить количество выделившегося диоксида углерода, г.
2. Рассчитать количество образовавшегося этилового спирта, г.
3. Рассчитать количество сброженного сахара (сахарозы), г.
5. Приготовить препарат дрожжей (фиксированный или в раздавленной капле) для микроскопирования, взяв пипеткой осадок из сброженной среды (культуральной жидкости). Препарат посмотреть с иммерсией и зарисовать форму дрожжей. Подписать рисунок по-латыни.
6. По результатам опыта заполнить табл. 9. Таблица 9 К спиртовому брожению
Маслянокислое брожение
Теория вопроса. Постановка опыта. В лабораторных условиях воспроизвести процесс маслянокислого брожения. Для этого сырой неочищенный картофель нарезать мелкими кубиками, заполнить ими на 1/3 высокую пробирку, добавить немного мела, залить на 2/3 водопроводной водой и пастеризовать 10 мин при 80оС на водяной бане. Затем поместить в термостат. Элективные условия для маслянокислого брожения крахмала: 1.
2.
3.
4. Результаты опыта.
1. Указать признаки маслянокислого брожения. Дать органолептическую оценку масляной кислоты.
2. Записать уравнение маслянокислого брожения.
3. Приготовить препарат маслянокислых бактерий в раздавленной капле. Окраску произвести по гранулезе раствором Люголя (I2 в КI). Препарат зарисовать.
4. Провести качественную реакцию на масляную кислоту с FeCl3, записать уравнение реакции.
5. Заполнить табл. 11.
Таблица 11 К маслянокислому брожению
Молочнокислое брожение
Теория вопроса. Методика определения кислотности молока: 1.
2.
3.
Постановка опыта 1. Определить начальную титруемую кислотность свежего молока. Кислотность молока выразить в градусах Тернера (оТ). Результат записать в таблицу. 2. Разлить молоко в 4 колбы по 40-50 мл и закрыть ватными пробками. 2 колбы поставить на асбестовую сетку и довести молоко до кипения. Колбы с кипяченым и некипяченым молоком поместить в термостат для инкубации при t ~ 28оС.
Результаты опыта. 1. Описать характер сгустка скисшего молока, получившегося из сырого (некипяченого) молока и кипяченого молока. Объяснить различия.
2. Записать уравнения различных типов молочнокислого брожения.
3. Приготовить фиксированный препарат из скисшего некипяченого и кипячёного молока. Зарисовать, подписать доминирующие формы молочнокислых бактерий.
кипяченое некипяченое
4. Определить конечную титруемую кислотность скисшего некипяченого молока. Кислотность выразить в градусах Тернера (оТ). Рассчитать изменение кислотности в оТ. Рассчитать количество накопившейся молочной кислоты в скисшем некипячёном молоке в процентах, исходя из данных кислотности в градусах Тернера (умножить на коэффициент 0,009). Результаты опыта по анализу скисшего некипячёного молока отразить в таблице 13.
Таблица 13 АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ Теория вопроса. Аммонификация органических азотсодержащих соединений
Теория вопроса. Постановка опыта. В лабораторных условиях воспроизвести процесс аммонификации (минерализации) белка. Для этого ~ 30 мл мясо-пептонного бульона (МПБ) поместить в колбу, добавить немного почвы или навоза в качестве посевного материала и закрыть ватной пробкой, подвесив над средой красную лакмусовую или универсальную индикаторную бумагу, смоченную дистиллированной водой, фильтровальную бумагу, смоченную раствором ацетата свинца и фильтровальную бумагу, смоченную горячим насыщенным раствором щавелевой кислоты. Индикаторные бумажки закрепить между пробкой и стенкой горлышка колбы. Результаты опыта. 1. Визуально по изменению цвета индикаторных бумажек определить качественный состав выделяющихся газообразных продуктов.Провести качественную реакцию на аммиак, образовавшийся в гниющем субстрате, при помощи реактива Несслера. Реакция капельная. По результатам наблюдений заполнить таблицу 16. Таблица 16
Заполните таблицу 20 Таблица 20
2. Методом отпечатков приготовить фиксированные препараты из свежего и несвежего мяса. Отпечатки взять с поверхности и из глубинного слоя.
Свежее мясо поверхность глубинный слой
Несвежее мясо поверхность глубинный слой
Вопросы к коллоквиуму по теме «Специальная микробиология» 1. Окисление жира. Значение процесса в природе и при хранении пищевых продуктов. Микробиологические пороки масла. 2. Окисление этилового спирта в уксусную кислоту. Роль в виноделии. Способы производства уксуса. 3. Превращение микроорганизмами соединений азота. Значение этих процессов в природе и сельском хозяйстве. 4. Аммонификация белковых соединений. Меры предупреждения гнилостных процессов при хранении пищевых продуктов. 5. Эпифитные микроорганизмы. Роль эпифитных микроорганизмов при хранении урожая. 6. Биологические основы хранения овощей, фруктов и факторы, определяющие их устойчивость к микроорганизмам. 7. Биологические принципы консервирования. 8. Использование молочнокислых бактерий в пищевой промышленности и кормопроизводстве. Закваски. 9. Силосование и сенажирование кормов. Микробиологические процессы при разных способах силосования. Методы регулирования процессов силосования. 10. Основные направления применения методов биоконверсии в сельском хозяйстве. 11. Микроорганизмы ризосферы и их влияние на растение. 12. Микробные землеудобрительные препараты и их применение в земледелии. 13. Применение микроорганизмов для борьбы с болезнями растений и профилактики заболеваний. 14..Микрофлора молока. Санитарно-микробиологическая характеристика молока. 15. Микрофлора мяса и мясных продуктов. Эндогенное и экзогенное обсеменение мяса. Развитие микроорганизмов при созревании мяса. 16. Санитарная оценка пищевых продуктов. Профилактика кишечных заболеваний.
Вопросы для подготовки к экзамену по микробиологии
Микробиология
Рабочая тетрадь
МОСКВА 2016
РАБОЧАЯ ТЕТРАДЬ ПО МИКРОБИОЛОГИИ
Фамилия И.О. __________________________________ Группа _________________________________________ Факультет ______________________________________
Введение Рабочая тетрадь по курсу «Микробиология» предназначена для бакалавров, обучающихся по направлению подготовки «Продукты питания из растительного сырья». В ней изложен учебный материал для лабораторно-практических занятий. Рабочая тетрадь представлена в форме лабораторного журнала, в котором даётся краткая теория выполняемого задания, шаблоны полей зрения для зарисовки изучаемых микроорганизмов, таблицы для записи результатов собственных наблюдений. Каждый раздел курса завершается коллоквиумом, на котором студент в устной форме отвечает на вопросы по заданной теме; примерные вопросы приведены в рабочей тетради. Выполнение каждого задания регистрируется преподавателем. Полностью выполненный курс лабораторно-практических занятий оценивается преподавателем и студент допускается к экзамену. В результате освоения курса лабораторно-практических занятий студент должен уметь: приготовить препараты микроорганизмов, различать основные формы бактерий, готовить искусственные питательные среды для выращивания микроорганизмов, проводить количественный учёт микроорганизмов в различных средах, проводить качественные реакции на продукты микробиологических процессов, ставить и оценивать опыты по трансформации соединений углерода и азота микроорганизмами.
ПРАВИЛА РАБОТЫ В МИКРОБИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
1. Не разрешается входить в лабораторию в пальто, головном уборе, вносить посторонние вещи. 2. К занятиям допускаются студенты только в халатах. 3. Студенты несут ответственность за используемые ими микроскопы, оборудование, чистоту рабочего места. 4. Необходимо ознакомиться с техникой безопасности при работе в микробиологической лаборатории и расписаться в журнале по технике безопасности. 5. Строго соблюдать правила обращения с химическими реактивами и красителями. 6. Запрещается работать с неисправными электроприборами. О всех неполадках сообщать преподавателю. 7. В лаборатории необходимо поддерживать порядок и чистоту. По окончании занятий протереть иммерсионный объектив микроскопа мягкой тканью, привести в порядок рабочее место. 8. Не оставлять открытыми чашки, пробирки, колбы с культурами микроорганизмов, чтобы не допускать их распыления, поскольку некоторые микроорганизмы являются аллергенами. 9. Перед уходом из лаборатории дежурный проверяет, выключены ли газ, вода, электроприборы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1758; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.108 (0.01 с.) |