
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В-31 Перевірка першого закону термодинамікиСодержание книги
Поиск на нашем сайте
Мета: перевірити виконання першого закону термодинаміки для ізобарного, ізотермічного та адіабатного процесів. Прилади і матеріали: програма комп’ютерної лабораторної роботи „Робота газу“.
Теоретичні відомості Термодинаміка – це наука про теплові явища. Її висновки спираються на сукупність дослідних фактів і не залежать від наших знань про внутрішню будову речовини, хоча в цілому ряді випадків термодинаміка використовує молекулярно-кінетичні моделі для ілюстрації своїх висновків. Систему, яка складається із макроскопічних тіл і полів, які можуть обмінюватися енергією як між собою, так і з зовнішніми тілами і полями (із зовнішнім середовищем) називають термодинамічною системою. Термодинаміка розглядає ізольовані системи тіл, що знаходяться в стані термодинамічної рівноваги. Це означає, що в таких системах припинилися всі макроскопічні процеси. Ізольованою (замкнутою) системою в термодинаміці вважають систему, яка не обмінюється енергією з зовнішнім середовищем. Якщо термодинамічна система піддавалася зовнішньому впливу, то в результаті вона переходить в інший рівноважний стан. Такий перехід називається термодинамічним процесом. Процеси, які складаються з послідовності рівноважних станів, називаються квазістатичними. Одним з найважливіших понять термодинаміки є внутрішня енергія тіла. Вона складається з кінетичної енергії всіх атомів і молекул і потенціальної енергії їхньої взаємодії, енергії коливальних рухів атомів і молекул, енергії електронних оболонок в атомах та йонах і внутрішньоядерної енергії. Внутрішня енергія є функцією стану системи (змінюється зі зміною стану системи) і не залежить від способу, яким система переводиться з одного стану в інший. У термодинаміці практичне значення має не сама внутрішня енергія, а її зміна внаслідок переходу системи з одного стану в інший. Внутрішня енергія в термодинаміці змінюється тільки за рахунок зміни енергії теплового руху частинок речовини та їх потенціальної енергії взаємодії. Енергія електронів в атомах та іонів і внутрішньоядерна енергія в цьому випадку залишаються незмінними. Тому під внутрішньою енергією в термодинаміці розуміють сумарну енергію теплового руху частинок речовини та потенціальну енергію їх взаємодії. Внутрішня енергія для довільної маси газу
де
Внутрішня енергія тіла може змінюватися внаслідок виконання над ним роботи. Якщо об’єм газу змінився на величину dV, то виконана ним робота
відповідає площі виділеної на графіку p(V) смуги (рис. 31.1). Робота, яку виконує газ внаслідок розширення від об’єму V1 до V2 дорівнює сумі елементарних робіт δA. Графічно вона визначається площею заштрихованої криволінійної трапеції (рисунок 31.1). При розширенні роботу, яку виконує газ, прийнято вважати додатньою, а при стиску – від’ємною. У загальному випадку внаслідок переходу газу з деякого початкового стану 1 у кінцевий стан 2 здійснена ним робота виражається формулою:
Внутрішня енергія тіла може змінюватися не тільки в результаті виконаної ним роботи, але і внаслідок теплообміну. Передача енергії від одного тіла до іншого у формі тепла може відбуватися тільки за наявності різниці температур між ними. Тепловий потік завжди спрямований від гарячого тіла до холодного. Внаслідок теплового контакту таких тіл внутрішня енергія одного з них збільшується, а внутрішня енергія іншого – зменшується. У цьому випадку говорять про тепловий потік від одного тіла до іншого. Кількістю теплоти Q, отриманої тілом, називають зміну внутрішньої енергії тіла в результаті теплообміну. Кількість теплоти Q є енергетичною величиною. У СІ кількість теплоти вимірюється в одиницях механічної роботи – джоулях (Дж). Іноді для вимірювання кількості теплоти використовують калорії (кал). 1 калорія еквівалентна 4,18 Дж. Число, яке показує відношення одиниці механічної роботи до одиниці кількості теплоти, називають механічним еквівалентом роботи:
Величина, обернена до механічного еквівалента теплоти Перший закон термодинаміки виражає закон збереження і перетворення енергії в застосуванні до теплових процесів і формулюється так: кількість теплоти, яку отримує система ззовні, витрачається на збільшення її внутрішньої енергії і на виконання системою роботи проти зовнішніх сил
Для нескінчено малої зміни стану системи рівняння (31.5) буде мати вигляд
У різних газових процесах значну цікавість представляє робота газу і кількість отриманої ним теплоти. Запишемо перший закон термодинаміки, використавши формулу (31.2) та (31.3) для одного моля ідеального газу
Розглянемо роботу газу і кількість отриманої ним теплоти для ізопроцесів. Ізобарний процес. р =const; dp =0. Для визначення роботи в ізобарному процесі проінтегруємо вираз для елементарної роботи (31.3)
Кількість теплоти, яку отримує газ в ізобарному процесі можна знайти, проінтегрувавши вираз (31.7)
Врахувавши, що згідно з рівнянням Клапейрона-Менделєєва
де Ізотермічний процес. Т =const; dT =0. Визначимо тиск р з рівняння Клапейрона-Менделєєва і підставимо його у вираз (31.3)
Проінтегрувавши цей вираз, отримаємо
Для ізотермічного процесу, оскільки dT =0,
Адіабатний процес. Перший закон термодинаміки буде мати вигляд
звідки
Проінтегрувавши вираз (31.3) і виключивши тиск за рівнянням Пуассона отримаємо вираз
де
Інтерфейс програми „Робота газу“
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.26.231 (0.009 с.) |

 , (31.1)
, (31.1) , CV – молярна теплоємність газу за сталого об’єму, а зміна внутрішньої енергії внаслідок переходу з стану 1 у стан 2
, CV – молярна теплоємність газу за сталого об’єму, а зміна внутрішньої енергії внаслідок переходу з стану 1 у стан 2 . (31.2)
. (31.2) (31.3)
(31.3)
 . (31.4)
. (31.4) .
. називають тепловим еквівалентом роботи.
називають тепловим еквівалентом роботи. . (31.5)
. (31.5) . (31.6)
. (31.6) . (31.7)
. (31.7) . (31.8)
. (31.8) . (31.9)
. (31.9) отримаєм вираз
отримаєм вираз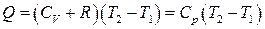 , (31.10)
, (31.10)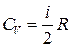 , а
, а 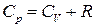 – рівняння Майєра.
– рівняння Майєра. .
. . (31.11)
. (31.11) (внутрішня енергія ідеального газу залишається сталою). Згідно з першим принципом термодинаміки, в ізотермічному процесі вся теплота, яку отримує газ, йде на виконання роботи:
(внутрішня енергія ідеального газу залишається сталою). Згідно з першим принципом термодинаміки, в ізотермічному процесі вся теплота, яку отримує газ, йде на виконання роботи: . (31.12)
. (31.12) .
. ,
, .
. , (31.13)
, (31.13) – показник адіабати.
– показник адіабати.



