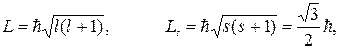Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В-88 Квантування електронних орбіт і виникнення хімічного зв’язку в твердих тілахСодержание книги
Поиск на нашем сайте
Мета: ознайомитись із: 1) особливостями виникнення хімічного зв’язку в твердих тілах; 2) квантуванням значень основних характеристик електронів (енергії, дебройлівської довжини хвилі, відстані від ядра, моменту імпульсу, частоти та ін.), коли атом перебуває в різних стаціонарних станах. Устаткування: комп’ютерна програма “Квантування електронних орбіт”.
Теоретичні відомості Відмінність між різними типами твердих тіл зумовлена відмінністю в характері розподілу електронів і ядер в атомах і молекулах і, особливо, в характері розподілу найбільш віддалених від ядра (валентних) електронів та йонних остовів атомів. Для вивчення того чи іншого кристалу необхідно вияснити, перш за все, просторове розташування ядер та електронів. Що ж утримує разом атоми в кристалах? Зв’язок між атомами майже повністю забезпечується силами електростатичного притягання між негативно зарядженими електронами і позитивно зарядженими ядрами. [1] Для того щоб за допомогою сил електростатичного притягання між валентними електронами і йонними остовами утворити із атомів тверде тіло, необхідно виконати наступні чотири умови, які не завше можна сумістити одна з одною: ♦ позитивно заряджені йонні остови повинні перебувати на такій відстані одне від одного, щоб при цьому було до мінімуму зведено електростатичне (кулонівське) відштовхування між ними. ♦ валентні електрони також повинні знаходитись на певних відстанях один від одного, які відповідають попередній вимозі. ♦ в той же час валентні електрони повинні перебувати настільки близько від позитивних йонів, щоб електростатичне притягання між ними було максимальним. ♦ виконання цих трьох умов приведе до зменшення потенціальної енергії системи, однак воно повинно відбуватись таким чином, щоб кінетична енергія системи тільки незначно збільшилась.
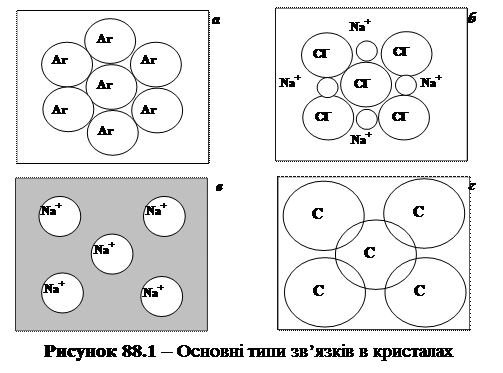
Існування стабільних зв’язків між атомами в кристалах передбачає, що повна енергія кристала – кінетична плюс потенціальна – повинна бути меншою за повну енергію такої ж кількості вільних атомів. Різниця цих двох значень енергій називається енергією хімічного зв’язку або просто енергією зв’язку. На рисунку 88.1 схематично показані основні типи зв’язків в кристалах.
Реалізація ван-дер-ваальсівського зв’язку продемонстровано на прикладі кристалічного аргону. Нейтральні атоми аргону (рисунок 88.1,а) утворюють кристал за рахунок слабих сил Ван-дер-Ваальса, які діють між ними і виникають в результаті флуктуацій в розподілі заряду атома. Йонний зв’язок реалізується за рахунок сил електростатичного притягання між додатними йонами лужного металу Na+ і негативними йонами галогену Cl- (рисунок 88.1,б). Тобто атоми Натрію віддають свої валентні електрони атомам Хлору. Металічний зв’язок продемонстровано на прикладі натрію (рисунок 88.1,в). Валентні електрони атомів лужного металу натрію покидають свої атоми і утворюють “електронну рідину”, в яку занурені позитивні йони. Ковалентний зв’язок утворюється, коли нейтральні атоми (наприклад Карбону – рисунок 88.1,г) за рахунок перекриття (успільнення) їх електронних оболонок утворюють кристал (алмаз). Експериментальні дослідження значення енергії зв’язку атома в кристалах свідчать, що вона складає від одного і менше відсотка від енергії йонізації електрона атома. Таким чином цієї енергії недостатньо для того, щоб сильно спотворити (збурити, деформувати) електронні оболонки атома. Тобто можна вважати, що розподіл електронів у вільних атомах незначно відрізняється від розподілу електронів в атомах кристалу (принаймні у тих, де реалізується ван-дер-ваальсівський зв’язок). В даній роботі робиться акцент на те, щоб зрозуміти і побачити на моделі найпростішого атома, які основні властивості електронів, особливо валентних, як відбувається квантування їх основних характеристик. Для цього детально розглянемо будову найпростішого із атомів – Гідрогену. Подивимося, як електрон веде себе, коли атом перебуває в різних стаціонарних станах. Пригадаємо, що серія дослідів Резерфорда та його учнів на початку минулого століття дали змогу Резерфорду накреслити ядерну модель атома: в центрі атома міститься позитивно заряджене ядро, розміри якого приблизно 10-15 м; навколо ядра замкнутими орбітами в просторі, обмеженому об’ємом сфери радіусом 10-10 м обертаються електрони, причому кількість їх дорівнює порядковому номеру елемента. Проте з погляду класичної фізики така модель була неспроможна пояснити закономірності в лінійчатих спектрах атомів і навіть самого факту випромінювання атомом монохроматичного світла; не могла пояснити характерної стійкості атома.
Правильні висновки з труднощів ядерної моделі Резерфорда зробив датський фізик Нільс Бор у 1913р. Він не відкинув самої моделі атома, оскільки вона ґрунтувалась на дослідних даних, але зробив сміливі припущення про те, що в мікроструктурі атома закони класичної електродинаміки не справджуються і що для з’ясування внутрішнього механізму атома треба керуватися ідеєю квантової теорії випромінювання Планка. У пошуках загальної квантової теорії Бор сформулював постулати, в яких, зокрема, твердив, що ♦ атому властиві цілком стійкі стани з відповідним значенням енергії, перебуваючи в яких він не поглинає і не випромінює електромагнітних хвиль. ♦ цим станам відповідають певні орбіти, на яких перебувають електрони, моменти імпульсу яких квантуються:
де mе – маса електрона, υ т – його орбітальна швидкість, rn – радіус n -ої стаціонарної орбіти. Ціле число n називається головним квантовим числом. Правило квантування орбіт Бора одержало наочну інтерпретацію в теорії де Бройля, який запропонував гіпотезу про наявність в електрона хвильових властивостей (1924 р.). Згідно цієї теорії електрону (і будь-якому іншому мікрооб'єкту) відповідає хвильовий процес з довжиною хвилі
де p – імпульс електрона. Застосувавши до орбітального руху електрона на стаціонарній круговій орбіті в атомі Гідрогену правила квантування Бора, отримуємо співвідношення
nλ = 2πrn. (88.3) Це означає, що довжина хвилі де Бройля ціле число раз укладається на довжині стаціонарної кругової орбіти електрона, тобто стаціонарна орбіта відповідає круговій стоячій хвилі де Бройля на довжині орбіти. Комп'ютерна модель є якісною ілюстрацією ідеї де Бройля виникнення стоячих хвиль на стаціонарних орбітах. Комп'ютерна модель на прикладі орбіт із квантовими числами n = 2, 3 і 4 ілюструє закономірність, якій підкоряються радіуси стаціонарних кругових орбіт в атомі Гідрогену. Відповідно до теорії Бора rn = n2r1, (88.4) де r1 = 5,29·10–11 м – радіус першої борівської орбіти. Модель дозволяє, плавно змінюючи радіус, вибирати стаціонарні орбіти, на довжині яких укладається ціле число довжин хвиль де Бройля й утворюється стояча хвиля. Слід зауважити, що теорія Бора, а слід за нею і гіпотеза де Бройля були тільки першими кроками квантового підходу до пояснення властивостей електрона і атома. Подальший розвиток цих ідей привів до створення квантової фізики, яка відкидає поняття орбіти, а, відповідно, і радіуса орбіти. Говорять про величину ймовірності знаходження електрона на певній відстані від ядра атома в певному напрямі. А квантування моменту імпульсу та інших характеристик електронів в атомах здійснюють так: Абсолютна величина можливих значень механічного моменту електрона: орбітального спіну
l = 0, 1, 2, … – орбітальне s =1/2 – спінове квантове число квантове число
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.35.247 (0.007 с.) |

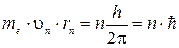 , (88.1)
, (88.1)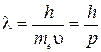 , (88.2)
, (88.2)