
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Что произойдет при сливании растворов хлорида железа (II) и карбоната натрия? Написать уравнения совместного гидролиза в ионно-молекулярной и молекулярной формах.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
До сливания в растворе каждой соли гидролизу подвергаются ионы Fe2+ и СО32-. I ступень: Fe 2+ +H OH <=>FeOH+ + → Н2О pH < 7; CO 32-+ H OH<=>HCO3-+ pH > 7. После сливания растворов продукт гидролиза первой соли (Н+) взаимодействует с продуктом гидролиза второй соли (ОН-) с образованием слабо диссоциирующего соединения Н2О, что приводит к смещению химического равновесия в сторону прямой реакции. Усиление гидролиза первой и второй соли приводит к протеканию II ступени гидролиза с образованием осадка и выделением газа. II ступень:
FeOH+ + H OH = Fe(OH)2↓ + → Н2О HCO3- + H OH = H2CO3 + ↓ CO2↑ H2O Сокращенное ионно-молекулярное уравнение совместного гидролиза двух солей: Fe2+ + CO32- + H2O = Fe(OH)2↓ + CO2↑. Молекулярное уравнение совместного гидролиза: FeCl2 + Na2CO3 + H2O= Fe(OH)2↓ + CO2↑ + 2NaCl. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ УРОВЕНЬ В Закончить уравнения реакций и уравнять их используя метод электронного баланса. Указать окислитель и восстановитель а) Pb + HNO3 конц → б) S + HNO3 конц → в) P + H2SO4 конц → г) Mg + H2SO4 конц → а) Металл + НNО3(конц) → соль + оксид азота + Н2О. Формула оксида азота зависит от активности металла: N2O выделится, если в реакцию вступает активный металл (стоящий в ряду стандартных электродных потенциалов в интервале Li...Al); NО выделится, если в реакцию вступает металл средней активности (Mn–Рb); NO2 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
Переносим полученные коэффициенты в молекулярное урав-нение: 3Pb0 + 2HN+5O3(конц) = 3Pb+2(N+5O3)2 + N+2O + H2O. Поскольку азотная кислота расходуется не только на получение 2 моль NO, но и на получение 3 моль Pb(NO3)2, в которых содержится 6NO
Суммируем число моль HNO3 и уравниваем количество водорода и кислорода (4Н2О): 3Рb + 8HNO3(конц) = 3Pb(NO3)2 + 2NO + 4Н2О. б) Неметалл + HNO3(конц) → кислота, в которой неметалл проявляет высшую степень окисления + NO2 + (Н2О): B → H3B+3O3; P → H3P+5O4; S → H2S+6O4; Se → H2Se+6O4; Si → H2Si+4O3; C → H2C+4O3; As → H3As+5O4. Решение So + HN+5O3(конц) = Н2S+6O4 + N+4O2 + H2O Восст. окисл. НОК ДМ восст-ль Sº – 6ē = S+6 1 окисл-ль N+5 + ē = N+4 6 Sº + 6N+5 = S+6 + 6N+4 S + 6HNO3(конц) = Н2SO4 + 6NO2 + 2H2O. в) Неметалл + H2SO4(конц) → кислота, в которой неметалл проявляет высшую степень окисления + SO2 +(Н2O); см. пример б). Решение P0 + H2S+6O4(конц) = Н3Р+5О4 + S+4O2 + H2O Восст. окисл. НОК ДМ восст-ль P0 – 5ē = P+5 2 окисл-ль S+6 + 2ē = S+4 5 2Р0 + 5S+6 = 2P+5 + 5S+4 2P + 5H2SO4(конц) = 2Н3РО4 + 5SO2 + 2H2O. г) Металл + H2SO4(конц) → соль + (H2S, S, SO2) H2S выделится, если в реакцию вступает активный металл S выделится, если в реакцию вступает металл средней активности (Mn–Рb), SO2выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода). Решение Mg0 + H2S+6O4(конц) = Mg+2SO4 + H2S-2 + H2O. восст. oкисл. НОК ДМ осст-ль Mg0 – 2ē = Mg+2 4 окисл-ль S+6 + 8ē = S-2 1 4Mg0 + S+6 = 4Mg+2 + S-2 Аналогично примеру (а) уравниваем реакцию: 4H2SO4(конц) + 4Mg + H2SO4(конц) = 4MgSО4 + H2S + 4H2O 4Mg + 5H2SO4(конц) = 4MgSО4 + H2S + 4H2O. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. КОРРОЗИЯ МЕТАЛЛОВ. УРОВЕНЬ В 1.а) Алюминиевый электрод погружен в 5∙10-4 М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
По табл. 11.1 определяем стандартный электродный потенциал алюминия:
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе соли: Al – 3ē = Al3+. n – число электронов, участвующих в электродном процессе. Для данной реакции n равно заряду иона алюминия Al3+(n = 3). Рассчитываем концентрацию ионов алюминия в растворе Al2(SO4)3:
Разбавленный раствор Al2(SO4)3 – сильный электролит. Следовательно, α = 1. По уравнению диссоциации Al2(SO4)3. Al2(SO4)3 = 2Al3+ + 3SO число ионов Al3+, образующихся при диссоциации одной молекулы Al2(SO4)3, равно 2. Следовательно, Тогда Рассчитываем электродный потенциал алюминиевого электрода:
Ответ: б) Потенциал цинкового электрода, погруженного в раствор своей соли, равен –0,75 В. Вычислить концентрацию ионов цинка в растворе.
Откуда:
По табл. 11.1 определяем стандартный электродный потенциал цинка:
Тогда
Ответ: Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой – катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ. Решение В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом – менее активный металл с большим алгебраическим значением электродного потенциала. По табл. 11.1 находим а) Олово является анодом ГЭ. В качестве катода можно выбрать любой металл с Выбираем медь А(-) Sn │ Sn2+ ││ Cu2+ │ Cu(+)K Или А(-) Sn │ SnSO4 ││ CuSO4 │ Cu(+)K. Уравнения электродных процессов: НОК ДМ На A(-) Sn – 2ē = Sn2+ 1 – окисление На К(+) Cu2+ + 2ē = Cu 1 – восстановление Sn + Cu2+ = Sn2+ + Cu – суммарное ионно-молекулярное уравнение токообразующей реакции; Sn + CuSO4 = SnSO4 + Cu – суммарное молекулярное уравнение токообразующей реакции. Рассчитываем стандартное напряжение ГЭ:
б) Олово является катодом ГЭ. В качестве анода ГЭ можно выбрать любой металл с Выбираем магний
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 842; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.99.39 (0.007 с.) |

 со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3:
со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3: 6HNO3 (конц) + 3Pb0 + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O
6HNO3 (конц) + 3Pb0 + 2HNO3(конц) = 3Pb(NO3)2 + 2NO + H2O = 5∙10-4 моль/л
= 5∙10-4 моль/л
 =
=  +
+ 
 –?
–?
 = –1,67 В.
= –1,67 В. =
=  ∙ α ∙
∙ α ∙  .
.
 = 2.
= 2. = 5∙10-4∙1∙2 =
= 5∙10-4∙1∙2 =  моль/л.
моль/л. = -1,67 +
= -1,67 +  = –1,73 В.
= –1,73 В. = –1,73 В.
= –1,73 В. = –0,75 В
= –0,75 В
 =
=  +
+  .
.
 –?
–?
 =
= 
 = 0,76 В, n – равно заряду иона цинка Zn2+ (n = 2).
= 0,76 В, n – равно заряду иона цинка Zn2+ (n = 2).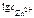 =
=  = 0,338.
= 0,338.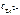 = 100,339 моль/л = 2,18 моль/л
= 100,339 моль/л = 2,18 моль/л = 2,18 моль/л.
= 2,18 моль/л. = –0,14 В.
= –0,14 В. >
>  .
.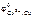 = + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
= + 0,34 В. В паре Sn–Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ: =
=  = +0,34 – (–0,14) = 0,48 В.
= +0,34 – (–0,14) = 0,48 В. , кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
, кроме щелочных и щелочноземельных металлов, так как они реагируют с водой. = –2,37 В.
= –2,37 В.


