
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения состава растворовСодержание книги
Поиск на нашем сайте УРОВЕНЬ В 1. Сколько граммов хлорида железа (III) содержится в 500 см3 0,1 н раствора?
откуда
где
В = 3 – валентность железа, n = 1 – число атомов железа в молекуле соли. Тогда где 10-3 – пересчет кубических сантиметров в литры. Ответ: 2. Сколько граммов хлорида магния потребуется для приготовления 800 см3 25 %-го раствора плотностью 1,2 г/см3?
m р-ра = V р-ра·ρр-ра = 800·1,2 = 960 г. Откуда
Ответ: 3. Определить молярную концентрацию вещества в растворе, содержащем 40 г сульфата меди (II) в 800 см3 раствора.
где
Тогда
где 10-3 – пересчет кубических сантиметров в литры. Ответ: Определить моляльность вещества в растворе, если в 100 г раствора содержится 5,3 г карбоната натрия.
Массу воды определяем из условия
Тогда
Следовательно,
Где 1000 – коэффициент пересчета граммов в килограммы. Ответ: 5. Определить титр раствора вещества, если в 200 см3 раствора содержится 0,1 моль гидроксида калия.
Согласно условию задачи откуда m KOH = 0,1· M KOH = 0,1·56 = 5,6 г, где М КОН – молярная масса гидроксида калия: М КОН = 39 + 16 + 1 = 56 г/моль. Следовательно, Ответ: 6. Определить молярную долю растворенного вещества в 3,42 %-м растворе сахарозы (С12Н22О11).
где m М Массы сахарозы и воды определяем согласно условию задачи (3,42 %-й раствор сахарозы). Следовательно, в 100 г раствора содержится 3,42 г С12Н22О11, m
Ответ: ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ УРОВЕНЬ В Рассчитать изменение стандартных энтальпии и энтропии химической реакции 4HCl(г) + O2(г) = 2Н2О(г) + 2Сl2(г)
D rH o(298 K) = [2D f Ho(298 K, Н2О(г)) + 2D f Ho(298 K, Cl2(г))] – – [4D fH o(298 K, НCl(г)) + D fH o(298 K, О2(г))]; D rS o(298 K) = [2 S o(298 K, Н2О(г)) + 2 S o(298 K, Cl2(г))] – – [4 S o(298 K, НCl(г)) + S o(298 K, О2(г))], где D rH o(298 K, В) и S o(298 K, В) – стандартные энтальпии образования и энтропии веществ, которые находим из таблицы:
тогда: D rH o(298 K) = 2(–241,84) – 4(–92,3) = –114,48 кДж; ∆ rS o(298 K) = (2·188,7 + 2·222,9) – (4·186,8 + 205) = –129 Дж/К. Ответ: D rH o(298 K) = –114,48 кДж, D rS o(298 K) = –129 Дж/К. 2. Стандартная энтальпия сгорания этилена (С2Н4) равна
1C2H4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж); D flH o(298 K) = – 1410,8 кДж/моль. Стандартной энтальпией сгорания вещества называется тепловой эффект реакции полного сгорания 1 моль органического вещества до СО2(г) и Н2О(ж) при стандартных условиях. Следовательно, для данной реакции D flH o(298 K) = D rH o(298 K) = –1410,8 кДж. Для определения D fH o(298 K, C2H4(г)) используем первое следствие из закона Гесса для этой же реакции: D rH o(298 K) = 2D fH o(298 K, СО2(г)) + 2D fH o(298K, Н2О(ж)) – – D fH o(298 K, С2Н4(г)) – 3D fH o(298 K, О2(г)). Откуда D fH o(298 K, С2Н4(г)) = 2D fH o(298 K, СО2(г)) + + 2D fH o(298K, Н2О(ж)) – D rH o(298K) – 3D fH o(298K, О2(г)). Значения стандартных энтальпий образования (Н2О(ж) и СО2(г)) берем из таблицы: D fH o(298 K, С2Н4(г)) = 2(–393,5) + + 2(–285,8) – (–1410,8) = 52,2 кДж/моль. Ответ: D fH o(298 K, С2Н4(г)) = 52,2 кДж/моль. 3. По заданным термохимическим уравнениям рассчитать стандартную энтальпию образования Fe2O3(к) из простых веществ: Fe(к) +1/2O2(г) = FeO(к), D rH o(298 K, 1) = – 264,8 кДж. (4.1) 4FeO(к) + O2(г) = 2Fe2O3(к), D rH o(298 K, 2) = – 585,2 кДж. (4.2)
термохимическое уравнение реакции образования Fe2O3(к) из простых веществ Fe(к) и O2(г): 2Fe(к) + 3/2O2(г) = Fe2O3(к). (4.3) Из двух реакций (4.1) и (4.2) необходимо получить реакцию (4.3). Для этого складываем термохимические уравнения (4.1) и (4.2), предварительно умножив на 2 стехиометрические коэффициенты реакции (4.1) и разделив на 2 стехиометрические коэффициенты реакции (4.2): 2Fe(к) + O2(г) + 2FeO(к) + ½O2(г) = 2FeO(к) + Fe2O3(к). После сокращения получаем уравнение реакции (4.3): 2Fe(к) + 3/2O2(г) = Fe2O3(к). Для определения изменения стандартной энтальпии реакции (4.3) аналогичные математические действия осуществляем с тепловыми эффектами приведенных реакций (4.1) и (4.2): D rH o(298 K, 3) = 2D rH o(298 K, 1) + ½D rH o(298 K, 2) = = 2(-264,8) + ½(-585,2) = – 822,2 кДж. Так как реакция (4.3) соответствует образованию 1 моль Fe2O3 из простых веществ, то D fH o(298 K, Fe2O3) = – 822,2 кДж/моль. Ответ: D fH o(298 K, Fe2O3) = – 822,2 кДж/моль.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ УРОВЕНЬ В
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 575; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.2 (0.006 с.) |


 .
. ,
,
 – молярная масса эквивалента хлорида железа (III).
– молярная масса эквивалента хлорида железа (III). – молярная масса хлорида железа (III), г/моль:
– молярная масса хлорида железа (III), г/моль: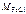 = 56 + 3∙35,5 = 162,5 г/моль,
= 56 + 3∙35,5 = 162,5 г/моль,
 54,17 г/моль;
54,17 г/моль;
 = 800 cм3
= 800 cм3
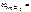 25 % мас.
25 % мас.
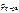 = 1,2 г/см3
= 1,2 г/см3
 откуда
откуда 
 ?
?


 = 40 г
= 40 г
 моль/л,
моль/л,
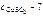
 молярная масса сульфата меди (II), г/моль.
молярная масса сульфата меди (II), г/моль. = 64 + 32 + 64 = 160 г/моль.
= 64 + 32 + 64 = 160 г/моль.
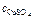 = 0,31 моль/л.
= 0,31 моль/л.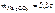
 .
.

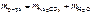 .
.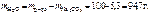
 ,
,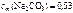 моль/кг.
моль/кг.
 .
.

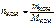 = 0,1 моль,
= 0,1 моль, .
. = 0,028 г/см3.
= 0,028 г/см3.

 –?
–?

 =
=  ,
, и m
и m  – соответственно массы сахарозы и воды;
– соответственно массы сахарозы и воды; и М
и М 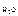 – соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
– соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль). = 100 – 3,42 = 96,58 г.
= 100 – 3,42 = 96,58 г.
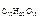 =
=  .
. = 0,00186.
= 0,00186. = 48кДж/моль
= 48кДж/моль
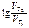 =
= 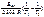 ;
;
 =
=  1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда
1,09,
где 103 – коэффициент пересчета килоджоулей в
джоули, тогда
 =101,09 = 12,3 раза.
=101,09 = 12,3 раза.
 –?
б)
–?
б)  –?
–?

 .
.



