
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
n
КHOCl – константа диссоциации HOCl: К Тогда
c тогда рН = – lg5,0·10-5 = (-lg 5) + (-lg10-5) = – 0,7 + 5 = 4,3. Ответ: рН 0,05 М HOCl равно 4,3. 3. Определить произведение растворимости MgF2, если его растворимость в воде при 25 ºС равна 1,17·10-3 моль/л.
MgF2(к) <=> Mg2+ (р) + 2F-(р), ПР [Mg2+ ] = c MgF2 – сильный электролит, α = 1; n [Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л; [F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л. Тогда ПР Ответ: ПР
8. ГИДРОЛИЗ СОЛЕЙ УРОВЕНЬ B 1.Написать ионно-молекулярные и молекулярные уравнения гидролиза солей: а) сульфата хрома (III), б) сульфида натрия И указать реакцию среды их водных растворов.
Под формулой соли написать формулы основания и кислоты, которыми образована соль, и подчеркнуть общий ион в формуле соли и слабого электролита. Cr2 (SO4)3 Cr (OH)3 + H2SO4 Слаб. сильн. 2.Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды: Cr 3+ + H+ OH - <=> + pH < 7, среда кислая. 3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты: Cr2(SO4)3 + 2H2O <=> 2CrOHSO4 + H2SO4. б) Используя последовательность написания процесса гидролиза, изложенное в а), составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли Na2S. Na2S диссоциирует в водном растворе: Na2S → 2Na+ + S2-. Na2 S NaOH + H2 S Сильн. слаб. Сокращенное ионно-молекулярное уравнение
Молекулярное уравнение гидролиза: Na2S + H2O <=> NaHS + NaOH. 2.Написать ионно-молекулярное и молекулярное уравнения гидролиза хлорида алюминия (III). Как влияет на равновесие гидролиза прибавление к раствору следующих веществ: а) хлороводородной кислоты; б) гидроксида калия; в) нитрата натрия? Решение AlCl3 диссоциирует в водном растворе. AlCl3 → Al3+ + 3Cl- Al Cl3 Al (OH)3 + HCl Слаб. сильн. Взаимодействие Al3+ с молекулами воды приводит к образованию малодиссоциирующего катиона (AlOH)2+. Сокращенное ионно-молекулярное уравнение гидролиза Al3+ + H+ OH - <=> +
Как видно из сокращенного ионно-молекулярного уравнения, при гидролизе образуются катионы Н+, обусловливающие кислую среду раствора (рН < 7). Молекулярное уравнение гидролиза: AlCl3 + HOH <=> AlOHCl2 + HCl. Реакция гидролиза – процесс обратимый, поэтому равновесие гидролиза соли может смещаться при введении в раствор некоторых веществ (согласно правилам смещения равновесия по принципу Ле Шателье). а) Если к раствору AlCl3 добавить HCl, то в результате её диссоциации (HCl = H+ + Cl-) в растворе увеличится концентрация ионов H+, вследствие чего равновесие реакции гидролиза AlCl3 сместится в левую сторону (образование исходных веществ), т.е. гидролиз AlCl3 ослабевает. ← Al3+ + HOH <=> AlOH2+ + HCl = Cl- + б) Если же к раствору AlCl3 добавить щелочь (КОН), то в результате ее диссоциации (КОН = К+ + ОН-) в растворе появляются ионы ОН-, которые с образовавшимися в реакции гидролиза ионами Н+ образуют молекулу слабого электролита (H2O), и это приведет к уменьшению концентрации ионов Н+ и смещению равновесия реакции гидролиза в правую сторону, т.е. гидролиз AlCl3 усилится. → Al3+ + HOH <=> AlOH2+ + → Н2О. КОН = К+ + в) Добавление нитрата натрия (NaNO3) не смещает положения равновесия, т.к. нитрат натрия – сильный электролит и не имеет общих ионов ни с AlCl3, ни с продуктами его гидролиза и не связывает их в малодиссоциирующие соединения, т.е. прибавление NaNO3 на процесс гидролиза не влияет. Al3+ + HOH <=> AlOH2+ + H+; NaNO3 = Na+ + NO3-.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 589; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.28.97 (0.01 с.) |

 = 0,05 М
= 0,05 М
 ,
,
 – число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
– число Н+ образовавшихся при диссоциации одной молекулы HOCl, n  = 1.
= 1. ;
;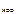 = 5,0·10-8 (таблица),
= 5,0·10-8 (таблица),
 = 1,17·10-3 моль/л
= 1,17·10-3 моль/л
 –?
–?
 = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,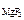 ·α· n
·α· n  , [F-] = c
, [F-] = c  ·α· n
·α· n  .
. = 1, n
= 1, n 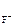 = 2 (из приведенного уравнения)
= 2 (из приведенного уравнения) = 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9. = 6,41·10-9.
= 6,41·10-9. S2- + H +OH- <=> +, pH > 7, среда щелочная.
S2- + H +OH- <=> +, pH > 7, среда щелочная.


