
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Написать уравнения диссоциации этих соединений в водных растворах.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Заряд комплексного иона [Mo(CN)8]4- равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку. Вторичная диссоциация комплексного иона обратима и протекает по типу диссоциации слабого электролита: [Mo(CN)8]4- <=> Мо х + 8 CN-. Степень окисления комплексообразователя (х) определяется по заряду комплексного иона: х [Mo(CN)8] 4-. х + 8·(–1) = –4, откуда х = + 4, т.е. заряд комплексообразователя Мо4+. Координационное число комплексообразователя (Мо4+) равно суммарному числу лигандов (CN-), окружающих комплексообразователь, т.е. Так как соединение [PtCl4(NH3)2] не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация: [Pt(NH3)2Cl4]0 <=> Рt x + 2NH x + 2 · 0 + 4 · (–1) = 0, x = +4, т.е. заряд комплексообразователя Рt4+, а Ответ: [Mo(CN)8]4-,[PtCl4(NH3)2]0; Мо4+, Pt4+; 2.Константы нестойкости комплексных ионов [Fe(CN)6]4- и [Fe(CN)6]3- соответственно равны 1·10-37 и 1·10-44. Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным?
[Fe(CN)6]3- <=> Fe3+ + 6CN-;
Константы устойчивости – константы равновесия обратных процессов (образования комплексных ионов). Fe2+ + 6CN- <=> [Fe(CN)6]4-;
Fe3+ + 6CN- <=> [Fe(CN)6]3-;
Значение константы устойчивости комплексного иона [Fe(CN)6]3- больше константы устойчивости комплексного иона [Fe(CN)6]4-. Значит, комплексный ион [Fe(CN)6]3- более прочный. Ответ: комплексный ион [Fe(CN)6]3- более прочный. 3. Составить формулы следующих комплексных соединений с координационным числом платины (IV), равном шести: PtCl4·6NH3; PtCl4·4NH3; PtCl4·2NH3. Написать уравнения диссоциации этих солей в водном растворе и назвать их.
PtCl4·6NH3 → [Pt(NH3)6]Cl4 = [Pt(NH3)6]4+ + 4Cl-; [Pt(NH3)6]4+ <=> Pt4+ + 6NH3; PtCl4·4NH3 → [Pt(NH3)4Cl2]Cl2 = [Pt(NH3)4Cl2]2+ + 2Cl-; [Pt(NH3)4Cl2]2+ <=> Pt4+ + 4NH3 + 2Cl-; PtCl4 ·2NH3 → [Pt(NH3)2Cl4] <=> Pt4+ + 2NH3 + 4Cl-; [Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV); [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV); [Pt(NH3)2Cl4] – тетрахлородиамминплатина
ЖЕСТКОСТЬ ВОДЫ УРОВЕНЬ В Вычислить жесткость воды, если в 140 л воды содержится 16,2 г ионов кальция и 2,92 г ионов магния.
Перевод моль в миллимоль. Ж = Ответ: Ж = 7,53 ммоль/л. Определить массу сульфата кальция в 200 л воды, если жесткость, обусловленная этой солью, равна 9 ммоль/л. откуда
Ответ: 3.Рассчитать обменную емкость катионита КУ-2, если через адсорбционную колонку, содержащую 1 кг катионита, пропустили 2,5 м3 воды общей жесткости 13,6 ммоль/л. Написать уравнение протекающей реакции. Na2 R + Ca2+(Mg2+, Fe2+) = 2Na+ + Ca(Mg2+, Fe2+) R; ε = ε = Ответ: ε = 34 ммоль/г ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (ПОЛИМЕРЫ). СПОСОБЫ ПОЛУЧЕНИЯ УРОВЕНЬ В Методом полимеризации получить: 1.Полиэтилен (ПЭ); 2.Полипропилен (ПП); 3.Полиизобутилен; 4.Полистирол (ПС); 5.Поливинилхлорид (ПВХ); 6.Полиакрилонитрил (ПАН); 7.Поливинилацетат (ПВА); 8.Полиметилметакрилат (ПММА, оргстекло); 9.Политетрафторэтилен (тефлон); Сополимер акрилонитрила, бутадиена и стирола (пластик АБС). Ответ: 1. Полиэтилен: n CH2 = CH2 → (─ CH2 ─ CH2 ─) n. Этилен полиэтилен 2. Полипропилен: n CH2 = CH(СH3) → (─ CH2 ─ CH(СH3) ─) n. Пропилен полипропилен 3. Полиизобутилен: n CH2 = C(СH3)(СH3) → [─ CH2 ─ C(СH3)(СH3) ─ ]n. Изобутилен полиизобутилен 4. Полистирол: n CH2 = CH(С6H5) → [─ CH2 ─ CH(С6H5) ─) n. Стирол полистирол 5. Поливинилхлорид: n CH2 = CHCl → (─ CH2 ─ CHCl ─) n. Винилхлорид поливинилхлорид 6. Полиакрилонитрил: n CH2 = CH(CN) → (─ CH2 ─ CH(CN) ─) n. Акрилонитрил полиакрилонитрил 7. Поливинилацетат: n CH2 = CH(OCOCH3) → [─ CH2 ─ CH(OCOСH3) ─ ] n. Винилацетат поливинилацетат 8. Полиметилметакрилат: n CH2 = C(CH3)(OCOCH3) → [─ CH2 ─ C(CH3)(OCOСH3) ─ ] n.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.166.141 (0.009 с.) |

 = 8.
= 8. + 4Cl-.
+ 4Cl-. Pt4+ = 6.
Pt4+ = 6. = 8;
= 8;  = 6.
= 6. –?
–?
 –?
–?
 = 1·10-24;
= 1·10-24; = 1·10-3.
= 1·10-3. = 1024;
= 1024; = 1031.
= 1031. = 200 л
Ж = 9 ммоль/л
= 200 л
Ж = 9 ммоль/л
 ,
,
 –?
–?
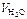 = 2,5 м3
Жобщ = 13,6 ммоль/л
= 2,5 м3
Жобщ = 13,6 ммоль/л
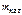 = 1 кг
= 1 кг
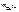 = 16,2 г
= 16,2 г
 = 2,92 г
= 2,92 г
 +
+ 
 ;
;
 = 20 г/моль (мг/ммоль)
= 20 г/моль (мг/ммоль)
 =12 г/моль (мг/ммоль).
=12 г/моль (мг/ммоль).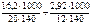 =7,53 ммоль/л.
=7,53 ммоль/л. ;
;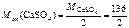 = 68 г/моль (мг/ммоль).
= 68 г/моль (мг/ммоль). =122,4 г.
=122,4 г.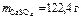
 ;
; = 34 ммоль/г.
= 34 ммоль/г.


