
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классы неорганических соединенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ХИМИЯ
Методические указания к выполнению лабораторных работ
Иркутск 2009
Химия. Методические указания к выполнению лабораторных работ. Часть 1. Составили: В.П. Зуева, З.Н. Топшиноева, О.В. Лебедева. – Иркутск: 2009. – 36 с., ил.
Методические указания предназначены для студентов 1-го курса, обучающихся по техническим направлениям и специальностям. Включают описание 10 лабораторных работ. Каждой лабораторной работе предшествует краткое теоретическое введение, содержащее необходимые сведения для понимания химической сущности проводимых опытов и количественных расчетов.
Библиогр. 4 назв. Рис. 1. Табл. 5.
ОГЛАВЛЕНИЕ
Требования к результатам лабораторных работ по дисциплине «Химия» Каждый студент должен выполнить лабораторные работы, предусмотренные программой. Каждая работа должна быть оформлена в виде отчета на бумаге формата А4 вручную или на компьютере. При работе на компьютере: размер шрифта – 14; интервал между строк – одинарный; поля – везде по 2 см, внизу – 2,5 см; нумерация страниц – внизу посредине; абзацный отступ – 1,25 см; размещение текста – по ширине.
Содержание отчета: · титульный лист (образец прилагается); · цель работы; · краткое теоретическое введение к данной работе; · название опытов; · выполнить требования, предъявленные к результатам отдельных опытов или работы в целом; Защита лабораторной работы осуществляется на занятии, следующем после ее выполнения. При защите студент должен представить отчет по лабораторной работе, составленный по предложенной выше схеме, пояснить все приведенные расчеты и выводы, выполнить индивидуальное задание по теме лабораторной работы (решить задачи или составить уравнения химических реакций).
ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ХИМИИ
Отчет по лабораторной работе (номер и название работы)
Выполнил студент гр….09-1 Фамилия, инициалы
Проверил преподаватель Фамилия, инициалы
Иркутск 2009 Лабораторная работа 1 КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Теоретическое введение: Все вещества делятся на простые и сложные. Сложные вещества подразделяются на четыре важнейших класса: оксиды, кислоты, основания, соли. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. Оксиды бывают несолеобразующие (N2O, NO, СO) и солеобразующие. Солеобразующие оксиды по химическим свойствам делятся на основные (Na2O, CaO, MgO, CuO), кислотные (SO2, SO3, P2O5, CO2, SiO2, Cl2O7, Mn2O7, CrO3,) и амфотерные (ВеО, ZnO, PbO, SnO, Al2O3, Cr2O3,). Оксиды взаимодействуют:
Получаются оксиды взаимодействием простых и сложных веществ с кислородом, а также разложением некоторых кислородсодержащих веществ при нагревании: 2Са + O2 = 2СаO 2ZnS + 3O2 = 2ZnO + 2SO2 Cu(OH)2 = CuO + H2O Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка (H2SO4, HNO3, HCl). Кислоты взаимодействуют: 1. С основаниями с образованием соли и воды 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O 2. С основными оксидами с образованием соли и воды 2HCl + ВаO = ВаCl2 + H2O 3. С солями с образованием новой соли и новой кислоты H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3 Одним из способов получения кислот является взаимодействие кислотного оксида с водой: P2O5 + 3H2O = 2H3PO4 Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксильными группами (NaOH, KOH, Cu(OH)2, Fe(OH)3). Основания взаимодействуют: 1. С кислотами с образованием соли и воды 2NaOH + H2SO4 = Na2SO4 + 2H2O 2. С кислотными оксидами с образованием соли и воды 2KOH + N2O5 = 2K NO3 + H2O 3. С солями с образованием новой соли и нового основания 2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой: 2Na + 2H2O = 2NaOH + H2↑ BaO + H2O = Ba(OH)2 Нерастворимые в воде основания получают реакцией обмена: Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4 Соли – это продукты замещения водорода в кислоте на металл или гидроксильных групп в основании на кислотный остаток. Соли бывают средние, кислые, основные. Средние соли (К2SO4, Na3PO4) – это продукты полного замещения водорода в кислоте на металл: H2SO4 + 2KOH = K2SO4 + 2H2O Кислые соли (Сa(HCO3)2, Nа2НРО4, KHSO4) – это продукты неполного замещения водорода в кислоте на металл: KOH + H2SO4 = KHSO4 + H2O Основные соли ((СuOH)2СO3, FeOHSO4, MgOHCl) – это продукты неполного замещения гидроксильной группы в основании на кислотный остаток: Mg(ОН)2 + HCl = MgOHCl + Н2О
Выполнение работы Опыт 1. Получение и свойства основных оксидов ( групповой ) (Проводить в вытяжном шкафу!) Возьмите пинцетом кусочек магниевой стружки и внесите в пламя спиртовки. После воспламенения сожгите его над фарфоровой чашкой. Собранный в чашке оксид магния поместите в две пробирки. В одну прилейте 1-2 мл воды, хорошо взболтайте и добавьте 1-2 капли фенолфталеина. Объясните появление окраски. В другую пробирку добавьте 1-2 мл разбавленной серной кислоты и нагрейте на спиртовке до растворения осадка. Требования к результатам опыта: 1. Составьте уравнения реакций взаимодействия магния с кислородом, оксида магния с водой и серной кислотой. 2. Сделайте вывод, какими свойствами, основными или кислотными, обладает оксид магния. Опыт 2. Получение и свойства кислотных оксидов ( групповой ) (Проводить в вытяжном шкафу!) Поместите в металлическую ложечку кусочек серы величиной с горошину и нагрейте на пламени спиртовки. Когда сера загорится, поднесите к ней влажную индикаторную бумажку. В какой цвет она окрашивается? Требования к результатам опыта: 1. Напишите уравнения реакций взаимодействия серы с кислородом, оксида серы (IV) с водой. 2. Сделайте вывод, какими свойствами, основными или кислотными, обладает оксид серы (IV).
Опыт 3. Взаимодействие амфотерных оксидов С кислотами и щелочами В две пробирки поместите немного оксида цинка и прилейте в одну пробирку соляной кислоты, а в другую – щелочи. Если осадок не растворяется, пробирку подогрейте. Требование к результатам опыта: Напишите уравнения реакций взаимодействия оксида цинка с кислотой и щелочью.
Опыт 4. Получение и свойства оснований Налейте в пробирку 1-2 мл раствора сульфата никеля и прибавьте столько же щелочи NaOH. Наблюдайте образование студенистого осадка. Отметьте его цвет. Содержимое пробирки поделите на две части. Испытайте растворимость осадков в кислоте и щелочи. Требования к результатам опыта: 1. Составьте уравнения реакций получения гидроксида никеля (II) и его растворения. 2. Сделайте вывод, какие свойства, кислотные или основные, проявляет гидроксид никеля (II). Опыт 5. Получение основных солей К 1-2 мл раствора хлорида кобальта (II) добавьте концентрированный раствор щелочи до образования розового осадка гидроксида кобальта (II). К осадку прилейте по каплям раствор соляной кислоты. Наблюдайте образование синего осадка основной соли. Затем добавьте избыток кислоты до его растворения. Требования к результатам опыта: 1. Напишите уравнение реакции получения гидроксида кобальта (II). 2. Составьте уравнение реакции получения основной соли CoOHCl. 3. Напишите уравнение реакции растворения CoOHCl в избытке кислоты.
Лабораторная работа 2 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЦИНКА
Теоретическое введение Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (1/2 H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э(NaOH) = NaOH; Э(H2SO4) = 1/2H2SO4; Э(MgCl2) = 1|2MgCl2; Э(Са) = 1/2Са. Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов (Мэк)и выражаетсяв г/моль. При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество. Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле:
где МВ – молярная масса вещества В; Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg. Э(Mg) = 1/2 Mg; Мэк(Mg) = У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2: Э(Н2) = 1/2 Н2; Мэк(Н2) = Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов:
Выполнение работы
Определение молярной массы эквивалентов металла производится в приборе, изображенном на рисунке. Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная - со стеклянной трубкой Г, опущенной в приемник В.
Работу следует выполнять в следующем порядке. Наполните водой двугорлую склянку. В колбу налейте 10-15 мл соляной кислоты. Закрепите колбу в горизонтальном положении. Получите у преподавателя навеску цинка и поместите ее в сухое горло колбы. Закройте колбу резиновой пробкой и проверьте герметичность прибора. Для этого откройте зажим Д и вдуйте воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закройте зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылейте и поставьте его под трубку Г. Наклоните колбу так, чтобы навеска цинка упала в кислоту, и откройте зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, дайте прибору остыть, не закрывая зажима. Осторожно выньте из приемника трубку Г (следите, чтобы из нее не вылилась вода), измерьте мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии металла с кислотой. Запишите показания барометра и термометра. Требования к результатам работы: 1. Исходные данные и результаты расчетов занесите в табл. 1. Таблица 1 Лабораторная работа 3 Теоретическое введение Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы ΔН. При экзотермической реакции энтальпия системы уменьшается и ΔН<0, а при эндотермической – энтальпия системы увеличивается и ΔН>0. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают ΔН0. Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, термохимическое уравнение СаО(К) + Н2O(Ж) = Са(ОН)2(К), ΔН0 = -65,3 кДж показывает, что при взаимодействии 1 моль СаО и 1 моль воды образуется 1 моль Са(ОН)2 и выделяется количество теплоты, равное 65,3 кДж. Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии Δ Н) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса. Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Например, стандартная энтальпия реакции nА + mВ == рС + qD рассчитывается по формуле ΔН0х..р = (р ΔfН0 С + q ΔfН0, Р) ─ (n ΔfН0 А + mΔfН0B), где ΔfН0 – стандартная энтальпия образования соединения. Стандартной энтальпией образованиявещества называется стандартная энтальпия реакции получения 1 моль данного вещества из простых веществ. Любая реакция нейтрализации сильной кислоты щелочью сводится к процессу Н+ + ОН‾ = Н20 (1) Поэтому тепловой эффект реакции нейтрализации должен быть постоянным, независимо от взятых кислоты и щелочи. Выполнение работы Для определения теплового эффекта реакции можно воспользоваться упрощенным калориметром, состоящим из двух стаканов – внешнего и внутреннего, между которыми имеется изоляция из фольги. В сухой внутренний стакан калориметра с помощью мерного цилиндра налейте 25 мл раствора серной кислоты. В другой сухой стакан налейте мерным цилиндром 25 мл раствора щелочи. Опустите в раствор кислоты термометр. Запишите температуру и, не вынимая термометр из стакана, быстро влейте в кислоту щелочь. Осторожно помешивая раствор термометром, отметьте и запишите максимальную температуру. Эту температуру считайте конечной. Требования к результатам работы: 1. Полученные данные занесите в таблицу.
2. Вычислите: а) Количество выделившейся при реакции теплоты АН по формуле ΔH = -V где V – общий. объем раствора, мл; Примите плотность раствора после нейтрализации равной 1 г/мл, а тепло емкость его, равной теплоемкости воды, т. е. 4,18 Дж/г ∙ К. б) Тепловой эффект реакции нейтрализации в расчете на 1 моль эквивалентов кислоты. Так как 1 моль эквивалентов кислоты содержится в 1 л (1000мл) раствора, а для реакции было взято 25 мл, то
в) Теоретическое значение теплоты реакции нейтрализации г) Относительную ошибку опыта (Е): Лабораторная работа 4 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Теоретическое введение Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени. Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции nA + mB = pАВ зависимость скорости реакции от концентрации выражается уравнением: V = k CАn×CВm, где CА и CВ - концентрации реагирующих веществ; k - константа скорости реакции. Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза:
где V2 и V1 - скорости реакций при температурах t2 и t1; γ - температурный коэффициент скорости реакции.
Выполнение работы
Зависимость скорости реакции от концентрации реагирующих веществ и температуры удобно исследовать на примере взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + H2SO4 = Na2SO4 + SO2+ S↓ + H2O Признаком реакции является помутнение раствора вследствие выделения серы. Время, которое проходит от начала реакции до заметного появления мути, позволяет судить об относительной скорости реакции.
Реагирующих веществ С помощью бюреток заготовьте три раствора тиосульфата различной концентрации. С этой целью отмерьте в первую пробирку 6 мл раствора тиосульфата натрия, во вторую – 4 мл того же раствора и 2 мл воды, в третью – 2 мл того же раствора и 4 мл воды. В три другие пробирки отмерьте по 3 мл раствора серной кислоты. Быстро прилейте кислоту в первую пробирку и встряхните ее несколько раз. Отмерьте время от начала реакции до помутнения раствора. Также поступите с другими заготовленными растворами тиосульфата. Требования к результатам опыта: а) Рассчитайте относительную скорость реакции по соотношению V = 100/τ. Результаты опыта внесите в табл. 1.
Таблица 1
б) Выразите графически зависимость скорости реакции от концентрации реагирующих веществ, откладывая на оси абсцисс относительную концентрацию, а на оси ординат – относительную скорость реакции. в) Поясните, какой линией выражается найденная зависимость. Проходит ли она через начало координат и почему? г) Сделайте вывод о зависимости скорости реакции от концентрации. Лабораторная работа 5 Теоретическое введение Химическим равновесием называется такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции. Химическое равновесие остается неизменным до тех пор, пока условия равновесия, при которых оно установилось, сохраняются постоянными. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в направлении, которое ослабляет эффект внешнего воздействия. При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции. При увеличении концентраций продуктов реакции и уменьшении концентраций исходных веществ равновесие смещается в сторону обратной реакции. Например, в реакции 2СО + О2 ↔ 2СО2 увеличение концентраций СО, О2 или уменьшение концентрации СО2 приводит к смещению равновесия вправо. Увеличение концентрации СО2 или уменьшение концентраций исходных веществ смещает равновесие влево. Когда в реакции участвуют газы, равновесие может нарушиться при изменении давления. При увеличении давления в системе равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, то есть в сторону понижения давления; при уменьшении давления равновесие смещается в сторону реакции, идущей с возрастанием числа молекул газов, то есть в сторону увеличения давления. Например, в реакции N2 + 3H2 ↔ 2NH3 в левой части уравнения четыре молекулы, в правой - две, поэтому при повышении давления равновесие смещается вправо, при понижении давления - влево. При повышении температуры равновесие смещается в направлении эндотермической, при понижении - в направлении экзотермической реакции. Например, в равновесной системе N2 + O2 ↔ 2NO; ∆Н0 = 180,5 кДж повышение температуры приводит к смещению химического равновесия в сторону прямой реакции (эндотермической), а понижение температуры - в сторону обратной реакции (экзотермической).
Выполнение работы
На химическое равновесие Лабораторная работа 6 Теоретическое введение Электролитами называют вещества (кислоты, основания, соли), которые в растворах диссоциируют на ионы и проводят электрический ток. Электролитическая диссоциация – распад молекул растворенного вещества на ионы под действием полярных молекул растворителя. Кислоты – электролиты, диссоциирующие в растворах с образованием ионов водорода: HCN ↔ H+ + CN‾ Основания – электролиты, диссоциирующие в растворах с образованием гидроксид-ионов: NH4OH ↔ NH4+ + OH‾ Существуют электролиты, которые могут диссоциировать как кислоты и как основания. Такие электролиты называются амфотерными. К ним относятся Be(OH)2, Al(OH)3, Cr(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2 и многие другие. Диссоциацию растворимой части амфотерного электролита можно представить следующей схемой: 2H+ + [Ве(OH)4]2-- ↔ Ве(OH)2 + 2H2O ↔ [Ве(H2O)2]2+ +2OH‾ Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов: BaCl2 = Ba2+ + 2Cl‾ NaHCO3 = Na+ + HCO3‾ CuOHCl = CuOH+ + Cl‾ Все электролиты делят на сильные и слабые. Сильные электролиты – это вещества, которые при растворении в воде полностью диссоциируют на ионы. Сильными электролитами являются: все хорошо растворимые соли; хорошо растворимые основания ( щелочи ) (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2; кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4). Слабые электролиты – это вещества, частично диссоциирующие на ионы. Важнейшие слабые электролиты: H2O; кислоты: CH3COOH, HF, HNO2, HCN, HClO, H2SO3, H2CO3, H2S, H3PO4; основания: NH4OH и все нерастворимые в воде основания, например Mg(OH)2, Fe(OH)3, Cu(OH)2. Реакции в растворах электролитов протекают между ионами. Обычно такие реакции изображаются при помощи ионных уравнений. Порядок составления ионных уравнений следующий: 1. Записывают молекулярное уравнение реакции и подчеркивают в нем вещества, которые не будут диссоциировать на ионы (нерастворимые вещества, слабые электролиты, газы): AgNO3 + KCl = AgCl ↓ + KNO3 2. Составляют полное ионное уравнение реакции. Осадки, газы и слабые электролиты на ионы не диссоциируют и в ионных уравнениях записываются в молекулярном виде: Ag+ + NO3‾ + K+ + Cl‾ = AgCl↓ + K+ + NO3 3. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон: Ag+ + Clˉ = AgCl↓ Реакции обмена в растворах электролитов протекают только в том случае, если: 1. Образуется осадок (↓): 3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl 3Ca2+ + 6Cl‾ + 6Na+ + 2PO43- = Ca3(PO4)2↓ + 6Na+ + 6Cl‾ 3Ca2+ + 2PO43- = Ca3(PO4)2↓ 2. Выделяется газ (↑): 2HCl + Na2S = H2S ↑ + 2NaCl 2H+ + 2Cl‾ + 2Na+ + S2- = H2S↑ + 2Na+ +2Cl‾ 2H+ + S2- = H2S↑ 3. Образуется слабый электролит: H2SO4 + 2K NO2+ = 2HNO2 + K2SO4 2H+ + SO42 + 2К+ + 2NO2‾ = 2HNO2 + 2K+ + SO42- NO2‾ + H+ = HNO2 В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, слабого электролита, реакции обмена не протекают. Нередко встречаются процессы, в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой – слабый электролит. Так, равновесие в системе: Mg(OH)2↓ + 2HCl = MgCl2 + 2H2O Mg(OH)2↓ + 2H+ + 2Cl‾ = Mg2+ + 2Cl‾ + 2H2O Mg(OH)2↓ + 2H+ = Mg2+ + 2H2O смещено вправо, поскольку ионы OH‾ связываются в малодиссоциированные молекулы воды полнее, чем в гидроксиде магния. Выполнение работы Лабораторная работа 7 ГИДРОЛИЗ СОЛЕЙ
Теоретическое введение Гидролизом солей называется обменное взаимодействие ионов соли с водой, которое приводит образованию слабого электролита и сопровождается изменением pH среды. Суть гидролиза заключается в следующем. При внесении в воду солей, в состав которых входят ионы слабых кислот или слабых оснований, эти ионы связываются с ионами H+ или OH‾ из воды с образованием слабого электролита, в результате чего нарушается равновесие электролитической диссоциации воды H2O ↔ H+ + OH‾. В растворе накапливаются ионы H+ или ОН‾, сообщая полученному раствору кислую или щелочную реакцию. Следовательно, гидролизу подвергаются соли, в состав которых входят катионы слабого основания или анионы слабой кислоты или те и другие одновременно. Соли, образованные сильным основанием и сильной кислотой (KCl, LiNO3, Na2SO4 и т.п.) гидролизу не подвергаются. В этом случае ни катион, ни анион соли не будут связывать ионы воды в малодиссоциированные продукты, поэтому равновесие диссоциации воды не нарушается. Реакция среды в растворах таких солей нейтральная (pH = 7). Можно выделить три типа гидролиза: 1. Г и д р о л и з п о а н и о н у происходит в растворах солей, состоящих из анионов слабых кислот и катионов сильных оснований (KCN, Na2CO3, Cs3PO4 и т.п.) В качестве примера рассмотрим гидролиз цианида калия KCN. Эта соль образована сильным основанием KOH и слабой кислотой HCN. При растворении в воде KCN полностью диссоциирует на ионы K+ и CN‾. Катионы K+ не могут связывать ионы ОH‾ воды, так как KOH - сильный электролит. Анионы же CN‾ связывают ионы H+ воды, в результате чего в растворе появляются молекулы слабой кислоты HCN и гидроксид-ионы OH‾. Сокращенное ионное уравнение реакции гидролиза имеет вид CN‾ + H2O ↔ HCN + OH‾ Для написания уравнения реакции в полной ионной форме прибавим к левой и правой частям уравнения ионы, не претерпевающие в результате гидролиза никаких изменений. В рассматриваемом примере - это катионы калия. K+ + CN‾ + H2O ↔ HCN + K+ + OH‾ Молекулярное уравнение легко получить из полной ионной формы, соединяя ионы в молекулы с учетом знаков заряда KCN + H2O ↔ HCN + KOH Далее при рассмотрении реакций гидролиза сохранен этот порядок записи уравнений: сокращенное ионное уравнение; полное ионное уравнение; молекулярное уравнение. Если соль образована сильным основанием и многоосновной слабой кислотой, то гидролиз протекает ступенчато. Например, гидролиз Na2S (NaOH - сильное основание, H2S - слабая двухосновная кислота) протекает в две ступени: I ступень S2- + H2O ↔ HS‾ + OH‾ 2Na+ + S2- + H2O ↔ Na+ + HS‾ + Na+ + OH‾ Na2S + H2O ↔ NaHS + NaOH II ступень HS‾ + H2O ↔ H2S + OH‾ Na+ + HS‾ + H2O ↔ H2S + Na+ + OH‾ NaHS + H2O ↔ H2S + NaOH При комнатной температуре гидролиз проходит только по первой ступени, поскольку HS‾ (продукт первой ступени) более слабый электролит, чем H2S (продукт второй ступени). При гидролизе солей, образованных слабой кислотой и сильным основанием, в растворе создается избыток гидроксид-ионов, и реакция раствора будет щелочной (pH > 7). 2. Г и д р о л и з п о к а т и о н у происходит в растворах солей, состоящих из катионов слабых оснований и анионов сильных кислот (NH4Cl, CuSO4, FeCl3 и т.п.). Рассмотрим гидролиз ZnSO4 - соли слабого двукислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катион Zn2+ связывает гидроксид-ионы воды, образуя катионы основной соли (ZnOH)+. Образование молекулы Zn(OH)2 не происходит, так как ионы (ZnOH)+ диссоциируют намного труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Ионы SO42- с ионами H+ слабого электролита не образуют. Таким образом, соль гидролизуется по катиону: Zn2+ + H2O ↔ ZnOH+ + H+ 2Zn2+ + 2SO42- + 2H2O ↔ 2ZnOH+ + SO42- + 2H+ + SO42- 2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4 В результате гидролиза такой соли в растворе образуется избыток ионов H+, т.е. pH < 7. 3. Г и д р о л и з п о а н и о н у и к а т и о н у одновременно происходит в растворах солей, образованных слабыми основаниями и слабыми кислотами (NH4NO2, Al2S3, Fe(CH3COO)3 и т.п.). В этом случае с водой взаимодействует как катион слабого основания, так и анион слабой кислоты, например NH4+ + CH3COO‾ + H2O ↔ NH4OH + CH3COOH NH4CH3COO + H2O ↔ NH4OH + CH3COOH Гидролиз идет по катиону и аниону, среда близка к нейтральной. pH ~ 7. Как правило, гидролиз – обратимый процесс: протеканию реакции до конца препятствует обратная реакция нейтрализации. Практически необратимо гидролизуются только те соли, продукты гидролиза которых уходят из раствора в виде нерастворимых или газообразных соединений. Необратимо гидролизующиеся соли невозможно получить в результате реакции обмена в водных растворах. Например, вместо ожидаемого Cr2S3 при смешивании растворов CrCl3 и Na2S образуется осадок Cr(OH)3 и выделяется газообразный H2S. 2CrCl3 + 3Na2S + 6H2O = 6NaCl + 2Cr(OH)3↓ + 3H2S↑ На равновесие гидролиза влияют температура и концентрация. Смещение равновесия гидролиза происходит в соответствии с принципом Ле Шателье. Гидролиз - это реакция, обратная нейтрализации, а нейтрализация – экзотермический процесс, следовательно, гидролиз – эндотермический. Поэтому увеличение температуры усиливает гидролиз (то есть смещает равновесие вправо). При постоянной температуре равновесие гидролиза можно сместить вправо (усилить гидролиз), разбавля
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1382; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.192.250 (0.027 с.) |

 ,
,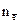 - число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
- число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.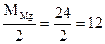 г/моль
г/моль г/моль
г/моль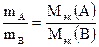

 cΔT,
cΔT,

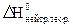 для уравнения (1). ΔfН° образования Н+, ОH‾ и Н20 соответственно равны 0, -230,2 и -285,8 кДж/моль.
для уравнения (1). ΔfН° образования Н+, ОH‾ и Н20 соответственно равны 0, -230,2 и -285,8 кДж/моль.




