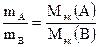Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Получение и свойства кислотных оксидовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
( групповой ) (Проводить в вытяжном шкафу!) Поместите в металлическую ложечку кусочек серы величиной с горошину и нагрейте на пламени спиртовки. Когда сера загорится, поднесите к ней влажную индикаторную бумажку. В какой цвет она окрашивается? Требования к результатам опыта: 1. Напишите уравнения реакций взаимодействия серы с кислородом, оксида серы (IV) с водой. 2. Сделайте вывод, какими свойствами, основными или кислотными, обладает оксид серы (IV).
Опыт 3. Взаимодействие амфотерных оксидов С кислотами и щелочами В две пробирки поместите немного оксида цинка и прилейте в одну пробирку соляной кислоты, а в другую – щелочи. Если осадок не растворяется, пробирку подогрейте. Требование к результатам опыта: Напишите уравнения реакций взаимодействия оксида цинка с кислотой и щелочью.
Опыт 4. Получение и свойства оснований Налейте в пробирку 1-2 мл раствора сульфата никеля и прибавьте столько же щелочи NaOH. Наблюдайте образование студенистого осадка. Отметьте его цвет. Содержимое пробирки поделите на две части. Испытайте растворимость осадков в кислоте и щелочи. Требования к результатам опыта: 1. Составьте уравнения реакций получения гидроксида никеля (II) и его растворения. 2. Сделайте вывод, какие свойства, кислотные или основные, проявляет гидроксид никеля (II). Опыт 5. Получение основных солей К 1-2 мл раствора хлорида кобальта (II) добавьте концентрированный раствор щелочи до образования розового осадка гидроксида кобальта (II). К осадку прилейте по каплям раствор соляной кислоты. Наблюдайте образование синего осадка основной соли. Затем добавьте избыток кислоты до его растворения. Требования к результатам опыта: 1. Напишите уравнение реакции получения гидроксида кобальта (II). 2. Составьте уравнение реакции получения основной соли CoOHCl. 3. Напишите уравнение реакции растворения CoOHCl в избытке кислоты.
Лабораторная работа 2 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ ЦИНКА
Теоретическое введение Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях, или одному электрону в окислительно-восстановительных реакциях. Под реальной частицей понимают реально существующие соединения (NaOH, H2SO4, H2O), под условной – доли этих реальных частиц (1/2 H2SO4, ½ H2O). Эквивалент – безразмерная величина, состав которой выражают с помощью знаков и формул. Например, Э(NaOH) = NaOH; Э(H2SO4) = 1/2H2SO4; Э(MgCl2) = 1|2MgCl2; Э(Са) = 1/2Са. Единицей количества вещества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,02×1023 эквивалентов. Масса одного моля эквивалентов называется молярной массойэквивалентов (Мэк)и выражаетсяв г/моль. При определении молярной массы эквивалентов необходимо исходить из конкретной реакции, в которой участвует данное вещество. Молярная масса эквивалентов вещества В, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле:
где МВ – молярная масса вещества В; Например, в реакции Mg0 + 2H+Cl = Mg+2Cl2 + H20 степень окисления магния изменяется от 0 до +2. Следовательно, магний теряет 2 электрона, т.е. одному электрону эквивалентна условная частица ½ атома Mg. Э(Mg) = 1/2 Mg; Мэк(Mg) = У водорода степень окисления меняется от +1 до 0, а т.к. молекула водорода состоит из двух атомов, то число принятых электронов будет равно 2. Таким образом, одному электрону эквивалентна условная частица ½ молекулы Н2: Э(Н2) = 1/2 Н2; Мэк(Н2) = Закон эквивалентов: массы реагирующих друг с другом веществ пропорциональны их молярным массам эквивалентов:
Выполнение работы
Определение молярной массы эквивалентов металла производится в приборе, изображенном на рисунке. Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная - со стеклянной трубкой Г, опущенной в приемник В.
Работу следует выполнять в следующем порядке. Наполните водой двугорлую склянку. В колбу налейте 10-15 мл соляной кислоты. Закрепите колбу в горизонтальном положении. Получите у преподавателя навеску цинка и поместите ее в сухое горло колбы. Закройте колбу резиновой пробкой и проверьте герметичность прибора. Для этого откройте зажим Д и вдуйте воздух в прибор через стеклянную трубку Г. В приборе создается избыточное давление, вследствие чего вода из трубки Г вытекает. Когда давление внутри прибора станет равным атмосферному, вода из трубки перестанет течь. Закройте зажим Д. Если вода из трубки Г не уходит, прибор герметичен. Воду из приемника вылейте и поставьте его под трубку Г. Наклоните колбу так, чтобы навеска цинка упала в кислоту, и откройте зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, дайте прибору остыть, не закрывая зажима. Осторожно выньте из приемника трубку Г (следите, чтобы из нее не вылилась вода), измерьте мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии металла с кислотой. Запишите показания барометра и термометра. Требования к результатам работы: 1. Исходные данные и результаты расчетов занесите в табл. 1. Таблица 1
|
|||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 656; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.18.192 (0.01 с.) |

 ,
,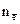 - число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.
- число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя.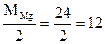 г/моль
г/моль г/моль
г/моль