
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В паре mg–sn магний является анодом, Олово – катодом.Содержание книги
Поиск на нашем сайте
Составляем схему ГЭ: А(-) Mg │ Mg2+ ││ Sn2+ │ Sn(+)K Или А(-) Mg │ MgSO4 ││ SnSO4 │ Sn(+)K. 3. Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком: а) в атмосферных условиях (Н2О + О2); б) кислой среде (Н2SO4); в) кислой среде в присутствии кислорода (HCl + O2). Написать уравнения электродных процессов и суммарной реакции процесса коррозии. Решение По табл. 11.1 находим значение стандартных электродных потенциалов железа (II) и цинка:
Так как а) Коррозия в атмосферных условиях (H2O + O2). Составляем схему коррозионного ГЭ: А(-)Zn H2O + O2 Fe(+)K Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ На A(-) Zn – 2ē = Zn2+ 2 На К(+) 2H2O + O2 + 4ē = 4OH- 1 2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии. б) Коррозия в кислой среде (H2SO4). Составляем схему коррозионного ГЭ: А(-)Zn │ H2SO4 │ Fe(+)K Или А(-)Zn │ H+ │ Fe(+)K Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ На A(-) Zn – 2ē = Zn2+ 1 На К(+) 2H+ + 2ē = H2 1 Zn + 2H+ = Zn2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии. Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии. в) Коррозия в кислой среде в присутствии кислорода (HCl + O2). Составляем схему коррозионного ГЭ: А(-)Zn │ HCl + O2 │ Fe(+)K Или А(-)Zn │ H+ + O2 │ Fe(+)K Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ На A(-) Zn – 2ē = Zn2+ 2 На К(+) 4H+ + O2 + 4ē = 2H2O 1 2Zn + 4H+ + O2 = 2Zn2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии. 2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии. Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк. ЭЛЕКТРОЛИЗ РАСТВОРОВ УРОВЕНЬ В 1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия. Какие продукты выделяются на катоде и аноде?
На катоде выделяется Cu, на аноде – Cl2. б) NaОН = Na+ + ОН-. K(-) A(+) инертный Na+ 4ОН 2H2O + 2ē = H2 + 2OH- На катоде выделяется Н2, на аноде – О2. 2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II), если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
K(-) A(+) инертный Ni2+ + 2ē = Ni 2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+. На катоде выделяется Ni и H2, на аноде выделяется О2. б) анод – никелевый: NiSO4 = Ni2+ + K(-) A(+) (Ni) Ni2+ + 2ē = Ni 2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+. На катоде выделяется Ni и H2, на аноде растворяется Ni. 3. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
В соответствии со схемой электролиза n эк (О2)(анод) = n эк (Н2)(катод) или Откуда
На катоде выделилось 1120 см3 водорода. Ответ: 1120 см3 водорода. б) AgNO3 = Ag+ + Схема электролиза: K(-) A(+) инертный Ag+ + ē = Ag H2O 2H2O – 4ē = О2 + 4H+ На катоде выделяется Ag, на аноде выделяется О2. По закону эквивалентов: n эк(О2)(анод) = n эк(Ag)(катод) или
Откуда где На катоде выделилось 10,8 г серебра. Ответ: 10,8 г серебра.
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ УРОВЕНЬ В
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1004; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.134.196 (0.008 с.) |

 = – 0,44В,
= – 0,44В,  = – 0,76В.
= – 0,76В. <
<  , то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
, то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо. – 4ē = О2 + 2H2О
– 4ē = О2 + 2H2О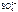 .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:
.
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:

 , Н2О
, Н2О  анод = 560 см3
Анод инертный
анод = 560 см3
Анод инертный
 .
Схема электролиза:
K(-) A(+) инертный
Ca2+
.
Схема электролиза:
K(-) A(+) инертный
Ca2+  2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
 –?
3.
–?
3.  –?
4.
–?
4.  –?
–?
 ,
, =
=  =
=  = 1120 см3,
= 1120 см3, = 11200 см3/моль.
= 11200 см3/моль. = 5600 см3/моль.
= 5600 см3/моль. .
. ,
,
 =
=  = 10,8 г.
= 10,8 г.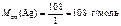 .
. ) = 1,12 л
) = 1,12 л
 .
m ZnO = m смеси – m Zn.
.
m ZnO = m смеси – m Zn.



