Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Микроскопический анализ металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
МАТЕРИАЛОВЕДЕНИЕ Методические указания к лабораторным работам
Омск Издательство ОмГТУ 2008 Негров Д. А. Бургонова О. Ю.
В методических указаниях изложены методы изучения строения и основных свойств материалов, приведены лабораторные работы по основным разделам курса (свойства материалов, кристаллизация металлов и сплавов, двойные диаграммы состояния сплавов, диаграмма «Железо – Рекомендуются для студентов машиностроительных специальностей.
Печатается по решению редакционно-издательского совета
Лабораторная работа № 1 Микроскопический анализ металлов Цель работы: ознакомление с микроскопическим анализом металлов и сплавов, с устройством и возможностями металлографического микроскопа;освоение одной из стандартных методик микроскопического анализа сплавов. Содержание работы Основными методами изучения строения металлов и сплавов являются микро- и макроскопические анализы. Макроанализ Макроструктура – строение металла, видимое без увеличения или при небольшом увеличении (до 10–30 раз) с помощью лупы. При макроанализе можно одновременно наблюдать большую поверхность детали (например, отливок, поковок) в изломе или на макрошлифе. Это дает представление об общем строении металла. Наиболее простым методом выявления строения металла является изучение излома. В отличие от аморфного тела металлы имеют зернистый (кристаллический) излом (рис. 1.1а). В большинстве случаев чем мельче зерно в изломе, тем выше механические свойства металла. По излому можно судить о размере зерна, особенностях литья и термической обработки, а также выявить отдельные дефекты.
Рис. 1.1. Макроструктура: а – излом слитка сурьмы; Макрошлифом называют поверхность образца (детали), подготовленную для исследования макроструктуры. Образцы, называемые темплетами, вырезают из крупных заготовок (слитков, проката), а мелкие и средних размеров детали разрезают в определенном месте и в определенной плоскости. Поверхность образца (детали) шлифуют и подвергают травлению кислотами или специальными реактивами, что позволяет выявить, например, дефекты, нарушающие сплошность металла (пузыри, трещины, раковины и др.), неоднородность строения, созданную обработкой давлением (полосчатость), строение литого металла, сварного соединения (рис. 1.1б) и др.
Методом макроанализа определяют: · вид излома − вязкий, хрупкий, нафталинистый (в стали), камневидный (в стали) и т. д.; · нарушения сплошности металла − усадочную рыхлость, центральную пористость, свищи, подкорковые пузыри, межкристаллитные трещины и трещины, возникшие при обработке давлением и термической обработке, флокены в стали, дефекты сварки (непровары, газовые пузыри · дендритное строение, зону транскристаллизации в литом металле; · химическую неоднородность литого металла (ликвацию) и присутствие в нем грубых включений; · волокнистую структуру деформированного металла; · структурную и химическую неоднородность металла, созданную термической, термомеханической или химико-термической обработкой. Микроанализ Микроскопический анализ (микроанализ) заключается в исследовании структуры металла при больших увеличениях (более 30 крат) и применяя-ется: · для определения количества и типа структурных составляющих металлов и сплавов; · для оценки формы, размера и характера расположения зерен; · для определения характера и качества предшествующей обработки (термической обработки, литья, обработки давлением, сварки); · для приблизительного определения содержания углерода в углеродистой и низколегированной стали по структуре в равновесном состоянии; · для установления наличия неметаллических включений и оценки их формы, размеров, характера расположения; · для установления наличия микродефектов – микротрещин, раковин · для определения глубины слоя, образовавшегося на поверхности после цементации, азотирования и других видов химико-термической обработки, глубины обезуглероживания и т.п.; · для обнаружения неметаллических включений – сульфидов, оксидов и др. Микроструктура – это строение (взаимное расположение, форма и размеры зерен) металлов и сплавов, видимое при помощи микроскопа. Для микроанализа из исследуемого материала вырезают образец, поверхность его подвергают шлифованию, полированию, травлению и затем рассматривают в металлографический микроскоп.
Структурная составляющая – это участок микроструктуры, имеющий свои строение и свойства и отдаленный от остальных участков поверхностью раздела (границей). Промышленные металлы и сплавы представляют собой конгломерат кристаллов неправильной формы, т. е. имеют поликристаллическое строение. Так как кристаллы должны иметь геометрически правильную огранку, то кристаллы неправильной формы в поликристаллическом агрегате принято называть зернами. Размер зерна поликристаллических материалов определяет большинство потребительских и технологических свойств материалов (см. приложение) и является важнейшим классификационным и диагностическим признаком, устанавливаемым в государственных стандартах и паспортах промышленно используемых материалов. Так как размер зерен в поликристаллических материалах может быть от единиц микронов до нескольких миллиметров, то изучение структуры поликристаллических материалов, в том числе определение размера зерен, как правило, проводится с применением оптической или электронной микроскопии. Для промышленно используемых материалов действуют соответствующие государственные стандарты на методы определения размера их зерен. Приготовление микрошлифа Образец металла, специально приготовленный для исследования его структуры под микроскопом, называется микрошлифом. Для микроанализа из исследуемого материала вырезают образец, поверхность его подвергают шлифованию, полированию, травлению и затем рассматривают в металлографический микроскоп. Шлифование поверхности вручную или на специальных шлифовальных станках начинают на шкурке с наиболее крупным абразивным зерном, затем постепенно переходят к шлифованию на шкурке с более мелким абразивным зерном, после чего поверхность образца полируют. Полирование проводят на специальном полировальном станке на вращающемся круге, обтянутом сукном, смачиваемым полировальной жидкостью − водой со взвешенными в ней частицами окиси хрома или алюминия. Обрабатываемая поверхность образца получается блестяще зеркальной. Но полученная поверхность не позволяет судить о строении зерен – на светлом фоне полированной поверхности образца выявляются только неметаллические включения и микродефекты. Для выявления микроструктуры полированную поверхность образца подвергают травлению, т. е. действию растворов кислот, щелочей, солей. Для травления шлифов наиболее распространенными являются следующие реактивы: · для сталей и чугунов – 4-процентный раствор азотной кислоты в этиловом спирте; · для алюминиевых сплавов – плавиковая кислота, едкий натр; · для меди и медных сплавов – соляно-кислый раствор хлорного железа. Различные составляющие структуры растворяются с различной скоростью, поэтому одни вытравляются больше, а другие − меньше. При освещении микрошлифа на микроскопе лучи света по-разному отражаются от различно протравившихся структурных составляющих. Места, протравленные сильнее, больше рассеивают отраженные лучи, поэтому в объективе микроскопа они получаются более темными. На рис. 1.2 показано, что вследствие более сильного травления границ зерен лучи, падающие на эти места, отражаются в стороны, не попадают в объектив микроскопа, поэтому границы зерен кажутся темными.
Рис. 1.2. Формирование изображения структуры однофазного сплава: При работе с микрошлифом следует помнить, что: · нельзя прикасаться пальцами к поверхности микроскопа; · нельзя протирать полированную поверхность; · при хранении микрошлиф ставят полированной поверхностью вверх; · на столик микроскопа шлиф ставят полированной поверхностью вниз, но при этом нельзя двигать его по столику, чтобы не нанести царапин.
Проведение испытаний Для определения средней величины зерна существует несколько методов, среди которых наиболее распространенным является метод площадей. Измерение этим методом величины зерна производится на предложенном для опыта микрошлифе с помощью металлографического микроскопа подсчетом количества зерен по вертикали и горизонтали. Диаметры зерна по вертикали и горизонтали рассчитываются по формуле
где К – количество делений шкалы окуляра-микрометра в данном опыте; Далее определяется средний диаметр зерна
Затем площадь среднего диаметра зерна
Для удобства классификации зерну в зависимости от его размера присваивается номер в соответствии с ГОСТ 5639–82 (табл. 1.1).
Таблица 1.1 Характеристики (параметры) структуры стали с разной
1.6. Влияние размера зерна поликристаллических материалов Механические свойства металлических сплавов в большой степени зависят от величины зерна. Так, зависимость предела текучести σт от размера (диаметра) зерна d описывается отношением
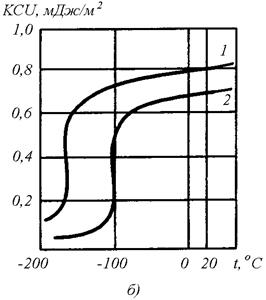
где σ0 и k − постоянные величины для данного металла. Влияние размера зерна d на условный предел текучести σ02 и предел выносливости σ-1 низкоуглеродистой стали показано на рис. 1.6а. Практическое значение этой закономерности определяется тем, что чем мельче зерно, тем труднее развивается хрупкая трещина. В то же время мелкое зерно понижает ударную вязкость (КCU) и порог хладноломкости
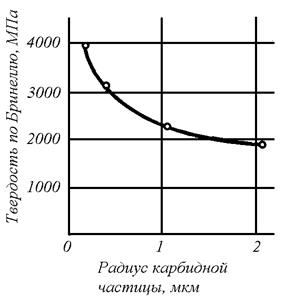
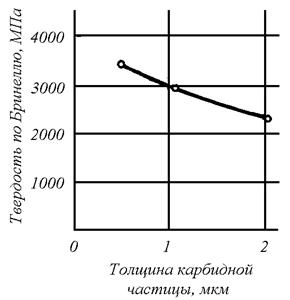
Зависимость твердости образцов из низкоуглеродистой стали с карбидными частицами различной степени дисперсности представлена на рис. 1.7. Характер зависимости показывает, что с увеличением размера частиц твердость значительно уменьшается.
Рис. 1.6. Влияние величины зерна d на условный предел текучести σ02, предел выносливости σ-1 (а) и ударную вязкость KCU (б) низкоуглеродистой стали: 1 − мелкое зерно (0,04 мм); 2 − крупное зерно (0,09 мм)
Рис. 1.7. Зависимость твердости от величины зерна: а – глобулярный карбид в ферритной матрице (сталь 0,8% С), б – пластинчатая фаза структур перлитного типа (сталь 0,8% С)
Порядок выполнения работы Подготовка микроскопа к визуальному наблюдению · Установить объектив и окуляр соответственно выбранному увеличению. · Винтами установить отверстие съёмной шайбы над объективом. · Над отверстием съемной шайбы установить микрошлиф полированной поверхностью вниз. · Поворотом стопорного винта освободить макрометрический винт. · Вертикальным перемещением предметного столика, вращая макрометрический винт, найти изображение микрошлифа и застопорить механизм грубой подачи. · С помощью микрометрического винта произвести фокусировку микроскопа на объект. Определение цены деления Для определения цены деления окуляра-микрометра необходимо: · подготовить микроскоп к наблюдению; · установить объект-микрометр на столик микроскопа таким образом, чтобы стекло со шкалой было направлено в сторону объектива, а пучок света проходил через центр стекла; ·изображение шкалы объекта-микрометра отыскать в поле зрения окуляра, для чего, удерживая рукоятки грубой подачи, освободить стопор этого механизма; непрерывно наблюдая в окуляр, плавно и медленно вращая рукоятку, добиться появления шкалы в поле зрения окуляра. Добившись изображения шкалы объекта-микрометра в поле зрения окуляра, необходимо: ·установить шкалы объекта-микрометра и окуляра-микрометра параллельно друг другу (поворотом окуляра вокруг оси); ·винтами предметного столика добиться частичного наложения шкал и совмещения в одну линию начальных или любых других штрихов обеих шкал; ·не меняя положения столика, отыскать другую пару штрихов, принадлежащих разным шкалам, совмещающихся в одну линию; ·подсчитать число делений шкалы объекта-микрометра М и окуляра-микрометра Н, находящихся между двумя парами совмещенных в линию штрихов; ·определить цену деления окуляра-микрометра по формуле (1.2). Лабораторная работа № 2 Содержание работы Кристаллизация солей В данной работе студенты изучают процесс кристаллизации четырёх солей: нитрата свинца Рb(NO3)2, хлорида аммония NH4Cl, дихромата калия К2Сr2O7 (хромпик), хлорида натрия NaCl (поваренная соль), вызванный испарением растворителя.
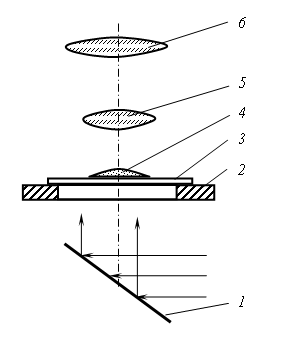
Водные растворы этих солей приготавливаются почти насыщенными с тем, чтобы незначительное испарение воды привело их к состоянию перенасыщения и выделению кристаллов. Наблюдение за процессом кристаллизации солей производится с помощью биологического микроскопа, работающего по принципу проходящего света (рис. 2.6). Лучи от естественного источника света, отразившись от зеркала микроскопа, проходят через отверстие предметного столика, предметное стекло, каплю соли и попадают в объектив. Полученное в объективе изображение капли увеличивается им и окуляром. Пройдя через окуляр, лучи попадают в глаз наблюдателя. Наблюдение за кристаллизацией капель в этой работе проводится при увеличении, но более чем
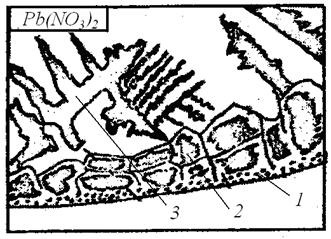
Рис. 2.6. Схема хода лучей в биологическом микроскопе: Порядок выполнения работы 1. Глядя в окуляр, вращать зеркало микроскопа, добиваясь яркого освещения (получить светлое поле). 2. Предметное стекло с нанесенной на него каплей соли установить на предметный столик так, чтобы капля была в центре отверстия предметного столика. 3. Произвести грубую настройку на фокус, для чего смотреть одним глазом в окуляр и, держа второй глаз открытым, вращать винт грубой подачи, поднимая тубус до тех пор, пока не появится изображение капли. 4. Вращением микрометрического винта произвести тонкую настройку на фокус. 5. Перемещать предметное стекло по предметному столику, наблюдая за кристаллизацией сначала у краёв капли, а затем в центре капли. 6. По мере появления кристаллов производить зарисовку в журнал, передавая при этом особенности их строения. 7. Исследование начинать с капли нитрата свинца, так как его кристаллизация идёт аналогично кристаллизации слитка спокойной стали. Наибольшее испарение возникает у краёв капли, так как тут уровень жидкости наименьший, а концентрация соли раньше, чем в других местах, достигает предела насыщения. Здесь образуются мелкие равноосные кристаллы. Они настолько мелкие, что при используемом в данной работе увеличении каждый кристалл невиден, и эта зона чаще всего просматривается в виде тонкой тёмной линии (рис. 2.7). Затем начинают образовываться крупные, вытянутые нормально к краям капли столбчатые кристаллы. Здесь кристаллизация идёт при большой скорости и ограниченном числе зародышей. В последнюю очередь кристаллизация идёт в центре капли, где образуются крупные кристаллы, имеющие форму дендритов.
Рис. 2.7. Строение затвердевшей капли раствора нитрата свинца:
3. Контрольные вопросы 1. На рис. 2.1 укажите: · теоретическую температуру кристаллизации (плавления) металла; · фактическую температуру кристаллизации (плавления) металла; · необходимое условие, при котором начнётся процесс кристаллизации (процесс плавления) металла; · а) жидком при охлаждении; б) твёрдом при охлаждении; в) твёрдом при нагреве; г) жидком при нагреве. 2. На рис. 2.3 укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (наиболее мелкозернистым). 3. Укажите среду закристаллизовавшегося раствора соли: а) Рb(NO3)2, 4. Укажите форму и схему строения закристаллизовавшейся капли водного раствора соли, схожую со структурой слитка спокойной стали. Объясните особенности ее строения.
Лабораторная работа № 3 Построение диаграммы состояния «Свинец – олово» Цель работы: нахождение термическим методом критических точек свинца, олова и трёх сплавов из свинца и олова и построение по полученным кривым охлаждения диаграммы состояния «Свинец – олово».
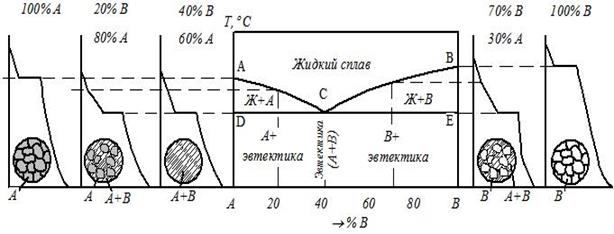
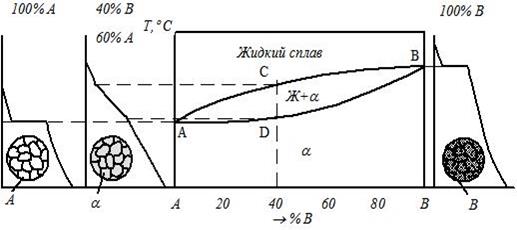
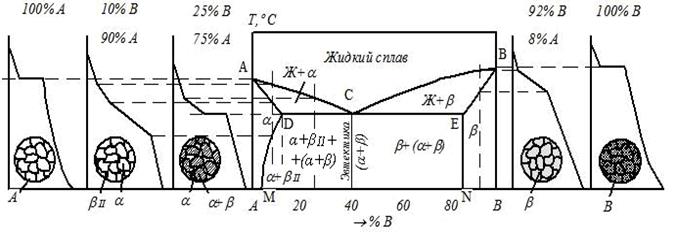
Содержание работы Общие сведения У кристаллических тел при переходе из одного состояния в другое, при протекании фазовых превращений выделяется или поглощается теплота и физические свойства при этом меняются скачкообразно. Температуры, при которых происходят те или иные физико-химические изменения в сплаве, называются критическими температурами, а соответствующие им точки на кривых охлаждения – критическими точками. Для определения критических точек сплава достаточно через короткие, но равные промежутки времени измерять температуру медленно охлаждающегося от жидкого состояния до комнатной температуры сплава, затем, построив по этим данным кривую охлаждения в координатах «Температура − время», отыскать на ней точки перегиба, которые и будут являться критическими точками данного сплава. В сплавах в зависимости от характера взаимодействия металлов друг с другом в твёрдом состоянии образуются твёрдые фазы и протекают различные фазовые превращения: образование твердых растворов, химических соединений, смесей. По критическим точкам чистых металлов и сплавов строятся диаграммы фазового равновесия. Эти диаграммы в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации компонентов и дают наглядное представление о процессах, происходящих в сплавах системы при нагреве и охлаждении. Различают следующие основные типы диаграмм состояния: · диаграмму для случая полной нерастворимости компонентов в твердом состоянии (образование смесей), рис. 3.1а; · диаграмму для случая неограниченной растворимости компонентов в твердом состоянии (неограниченные твердые растворы), рис. 3.1б; · диаграмму для случая ограниченной растворимости компонентов в твердом состоянии (ограниченные твердые растворы), рис. 3.1в; · диаграмму для случая, когда компоненты образуют химическое соединение, рис. 3.1г. Сплавы, образующие диаграмму первого типа (рис. 3.1а), в твердом состоянии представляют собой смеси из зерен чистых металлов А и В.
а) Рис. 3.1. Диаграммы состояния сплавов (начало)
б)
в)
г) Рис. 3.1. Диаграммы состояния сплавов (окончание)
В сплавах на рис. 3.1в металлы А и В образуют два типа растворов: твёрдый раствор компонента В в компоненте А – α -твёрдый раствор и твёрдый раствор компонента А в компоненте В – β -твёрдый раствор. Совокупность точек начала кристаллизации всех сплавов системы (линия АСВ в рис. 3.1а–в) называется ликвидус. Выше этой линии все сплавы находятся в жидком состоянии. Совокупность точек конца кристаллизации всех сплавов системы Сплавы, представленные на рис. 3.1б, ниже линии солидус при любой концентрации имеют только одну фазу – зерна твердого раствора компонента В в компоненте А. Сплав двух металлов А и В определенной концентрации, образующийся в точке С (рис. 3.1а, в), называется эвтектическим. Такой сплав кристаллизуется подобно чистому металлу при постоянной температуре, образуя смесь кристаллов двух твёрдых растворов, называемую эвтектикой. Сплавы с концентрацией металла В меньше эвтектической называются доэвтектическими, а с концентрацией металла В больше эвтектической − заэвтектическими сплавами. Рассмотрим кривую охлаждения доэвтектического сплава (рис. 3.2).
Рис. 3.2. Кривая охлаждения доэвтектического сплава
На участке 1 – 2 идет охлаждение жидкого сплава по физическим законам. В точке 1 начинается процесс кристаллизации, за счёт выделения скрытой теплоты кристаллизации уменьшается скорость охлаждения сплава и на кривой охлаждения образуется перегиб. Температура t1 – критическая точка начала кристаллизации из жидкости α -твёрдого раствора. Этот процесс продолжается до точки 3. В точке 3 начинается кристаллизация эвтектики – смеси двух фаз, выделяющихся из жидкого раствора эвтектической концентрации. Кристаллизация эвтектики происходит при постоянной температуре (участок 3 – 4) и заканчивается в точке 4 при температуре t2 по реакции Ж → (α + β). Температура t2 – критическая точка конца первичной кристаллизации сплава. На участке 4 – 5 при охлаждении сплава понижается растворимость компонента В в компоненте А. Это приводит к выпадению вторичных кристаллов βII из α-твёрдого раствора: α → βII. В результате описанных процессов в сплаве образуется конечная структура, состоящая из первичных кристаллов α -твёрдого раствора, эвтектики (α + β) и вторичных кристаллов βII -твёрдого раствора. Порядок выполнения работы 1. Перед началом измерений сплав находится в жидком состоянии. Когда печь выключают, сплав начинает охлаждаться. С момента начала охлаждения включить секундомер и фиксировать показания милливольтметра через каждые 60 секунд. Показания занести в табл. 3.1. Все измерения проводят в заданном интервале температур (указаны на подставке милливольтметра), в который попадают значения критических точек. 2. По полученным данным построить кривую охлаждения. Для более четкого выявления перегибов на кривой охлаждения в работе будет предложен масштаб для каждого сплава. 3. По перегибам на кривой охлаждения определить критические точки и соответствующую им ТЭДС перевести в градусы по градуировочной кривой. Результаты занести в табл. 3.2. 4. Найденные значения критических точек из табл. 3.2 перенести на поле диаграммы состояния «Свинец – олово», приняв левую вертикаль – 100 % свинца, а правую – 100 % олова. Для этого необходимо восстановить ординаты от точек, соответствующих составам исследуемых сплавов. На этих ординатах (не менее трех для сплавов и две оси ординат для чистых компонентов) нанести значения критических точек. Затем плавными кривыми соединить все точки начала и все точки конца кристаллизации. Все линии диаграммы необходимо обозначить буквами. 5. На поле диаграммы обозначить фазовый состав областей. Ниже поля диаграммы обозначить структуры сплавов. 3. Контрольные вопросы 1. На чём основан термический анализ? 2. Укажите на диаграмме «Свинец – олово» точки начала и конца первичной кристаллизации: а) доэвтектического сплава; б) эвтектического сплава; в) заэвтектического сплава; г) фазовый состав в областях, находящихся выше и ниже этих точек. 3. Укажите на диаграмме «Свинец – олово» точку конца вторичной кристаллизации: а) доэвтектического сплава; б) заэвтектического сплава. 4.Укажите линию начала кристаллизации жидкого раствора: а) в α -твёрдый раствор; б) в β -твёрдый раствор. 5. Укажите линию, показывающую предельную растворимость: 6. Укажите процессы кристаллизации, обусловленные понижающейся растворимостью олова и свинца при охлаждении. 7. Укажите на диаграмме «Свинец – олово» области существования: 8. Укажите структурный состав в различных областях диаграммы.
Лабораторная работа № 4 Микроструктура железоуглеродистых сплавов Цель работы: изучение микроструктуру сталей и чугунов в равновесном состоянии и установление связи между структурой и свойствами.
Содержание работы Порядок выполнения работы 1. Вычертить диаграмму «Fe − Fe3C» с указанием температур превращений и концентраций углерода для характерных точек. 2. Указать фазы и структурные составляющие в различных областях диаг-раммы. 3. Подготовить к работе металлографический микроскоп. Изучение микроструктуры железоуглеродистых сплавов производить при необходимых увеличениях металлографического микроскопа. 4. Просмотреть предложенные шлифы, выбрать наиболее характерные участки и зарисовать в отчете. Определить тип сплава, примерное или точное содержание углерода, основные механические свойства.
3. Контрольные вопросы 1. Определение феррита, аустенита, цементита, графита. 2. Определение перлита, ледебурита. 3.Что такое техническое железо, сталь, чугун? 4. Каково отличие в структуре белого чугуна от серого, высокопрочного, ковкого? 5. Как получают чугун серый, ковкий, высокопрочный? 6. Как и почему меняется твёрдость сплавов по мере увеличения концентрации углерода? 7. По микрофотографии, предложенной преподавателем, определите тип сплава (техническое железо, сталь, чугун), структурный и фазовый состав, пределы содержания углерода. 8. По диаграмме «Железо − цементит» опишите процессы, протекающие в сталях и белых чугунах при кристаллизации. Лабораторная работа № 5 Термическая обработка стали Цель работы: ознакомление с практикой выполнения отжига, нормализации, закалки и отпуска на примере конструкционной стали 40Х (0,4 % углерода, 1 % хрома). Изучение влияние режимов термической обработки на твёрдость стали. Содержание работы Свойства стали зависят от химического состава и структуры. Термической обработкой, изменяя структуру, можно получить требуемые свойства конкретной детали. Различают основные виды термической обработки стали: отжиг, нормализацию и закалку. Любая обработка стали состоит из нагрева, выдержки при температуре нагрева и охлаждения. Нагрев и выдержка необходимы для превращения исходной структуры в однородный аустенит. Охлаждение с различной скоростью от аустенитного состояния приводит к образованию различных структур и определяет получение требуемых свойств стали. 1.1. Основные виды термической обработки стали и их Отжиг – нагрев стали выше линии А3 (рис. 5.1) доэвтектоидной или А1 заэвтектоидной на 30–50 °С, выдержка при этой температуре и последующее охлаждение вместе с печью. Весьма медленное охлаждение приводит сталь в равновесное состояние, снижает её твёрдость. Выполняется для исправления структуры или улучшения обрабатываемости резанием конструкционных и инструментальных сталей. Нормализация – нагрев стали выше линии А3 (доэвтектоидной) или Аст (заэвтектоидной) на 30–50 °С, выдержка при этой температуре и последующее охлаждение – на спокойном воздухе. Более ускоренное охлаждение при нормализации несколько повышает прочность и твёрдость стали. Выполняется для исправления структуры или придания большей прочности и повышенной вязкости конструкционным и инструментальным сталям. Закалка – нагрев стали выше линии А3 (доэвтектоидной) или А1 (заэвтектоидной) на 30–50 °С, выдержка при этой температуре и последующее ускоренное охлаждение – в воде, масле или другом охладителе. Максимально повышается твёрдость и прочность конструкционных и инструментальных сталей.
Процессы нагрева стали Температура нагрева определяется положением критических точек А1 и А3 на диаграмме «Железо – цементит» (рис. 5.1а). Для правильного выполнения термической обработки сталей температуры нагрева должны соответствовать указанным областям, в которых основное фазовое состояние – аустенит. Если же по какой-либо причине температура нагрева окажется ниже линии А1, то исходная структура сохраняется и свойства сталей после охлаждения не изменяются.
а) б) Рис. 5.1. Стальной участок диаграммы «Железо – цементит» (а) и температурные области
В случае нагрева доэвтектоидных сталей выше А1, но ниже линии А3, не весь феррит превратится в аустенит. Присутствие в структуре нерастворенного феррита, имеющего низкую твердость, обуславливает пониженную твердость стали. Такая закалка считается неполной. У заэвтектоидных сталей при закалке растворение цементита вторичного в аустените нежелательно из-за охрупчивания стали, поэтому нагрев выполняется выше линии А1, но ниже линии Аст. Таблица 5.1 Нормы времени нагрева изделий различной формы в лабораторных печах
Время выдержки в печи складывается из времени прогрева изделия до заданной температуры и длительности выдержки при температуре, необходимой для превращения исходной структуры в аустенит. Время нагрева зависит от типа нагревающего устройства, способа укладки изделий, температуры нагрева, формы, размеров изделия и от других факторов. Нормы времени нагрева изделий различной формы в лабораторных печах приведены в табл. 5.1.
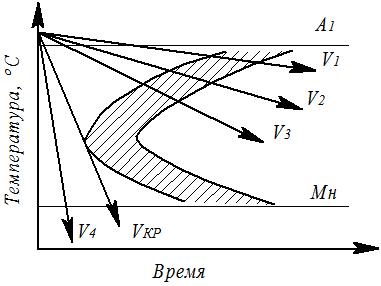
Процессы охлаждения стали Охлаждающая среда обеспечивает определённую скорость охлаждения и назначается исходя из требуемых структуры и свойств стали. Получаемую структуру можно определить при наложении векторов скоростей охлаждения на термокинетическую диаграмму (рис. 5.2) распада аустенита. В зависимости от скорости охлаждения превращение аустенита может быть диффузионным и бездиффузионным. Критерием превращения является критическая скорость закалки VКР. Это наименьшая скорость охлаждения, при которой подавляется диффузия атомов углерода. Для углеродистых и низколегированных сталей
Рис. 5.2. Термокинетическая диаграмма распада аустенита эвтектоидной стали:
Порядок выполнения работы 1. Получить образцы конструкционной стали 40Х. 2. Назначить режимы термической обработки: · закалку с недогревом; · закалку неполную; · закалку полную; · закалку в масло; · отжиг; · нормализацию; · закалку с низким отпуском; · закалку со средним отпуском; · закалку с высоким отпуском.
3. Под руководством лаборанта выполнить термическую обработку; зачистить торцы образцов на абразивном камне; замерить твёрдость на приборе ТК–2 по шкале «С» и их значения вписать в таблицу отчета. 4. Установить закономерности изменения твёрдости стали от температуры нагрева при закалке, скорости охлаждения, температуры отпуска. 5. Объяснить полученные закономерности фазовыми превращениями и свойствами фаз.
3. Контрольные вопросы 1. Определение отжига, нормализации, закалки, отпуска стали. 2. Цели выполнения этих видов термообработки. 3. Основные принципы выбора температуры нагрева, времени выдержки и скорости охлаждения для указанных видов термообработки 4. Физический смысл критической скорости закалки. 5. Основные превращения при выполнении указанных видов термообработки. 6. Как влияет температура отпуска на механические свойства сталей? 7. Объяснить зависимость твёрдости стали от температуры нагрева при закалке; от скорости охлаждения (вода, масло, воздух, охла
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1091; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.248.248 (0.018 с.) |




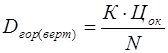 , (1.3)
, (1.3) . (1.4)
. (1.4)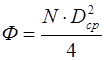 . (1.5)
. (1.5)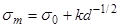 ,
,
 область температур, в которых металл будет находиться в агрегатных состояниях:
область температур, в которых металл будет находиться в агрегатных состояниях: