Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отчет по лабораторной работе №2Содержание книги
Поиск на нашем сайте
Изучение процесса кристаллизации 1. Цель работы. 2. Изменение свободной энергии жидкости и твердого тела в зависимости от температуры.
3. Принципиальная схема зависимости ЧЗ и СК от степени переохлаждения.
4. Схема хода лучей в биологическом микроскопе
5. Строение затвердевших капель:
6. Особенности строения затвердевших капель: 1 ________________________________________________________________ 2 ________________________________________________________________ 3 ________________________________________________________________ 4 _______________________________________________________________
Лабораторная работа № 3 Построение диаграммы состояния «Свинец – олово» Цель работы: нахождение термическим методом критических точек свинца, олова и трёх сплавов из свинца и олова и построение по полученным кривым охлаждения диаграммы состояния «Свинец – олово».
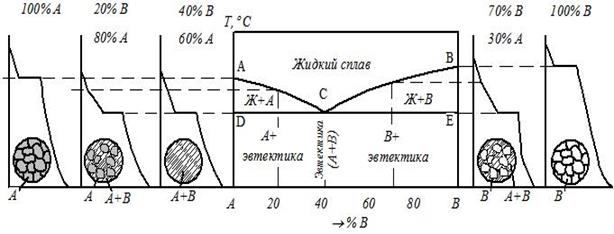
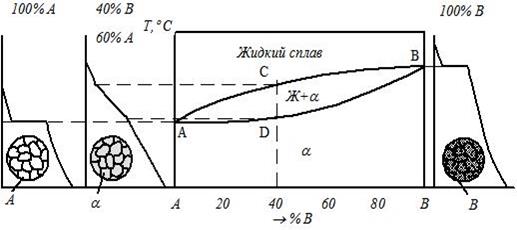
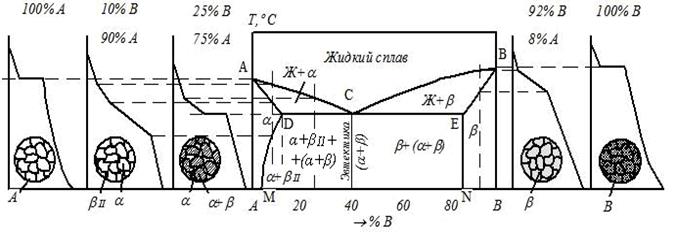
Содержание работы Общие сведения У кристаллических тел при переходе из одного состояния в другое, при протекании фазовых превращений выделяется или поглощается теплота и физические свойства при этом меняются скачкообразно. Температуры, при которых происходят те или иные физико-химические изменения в сплаве, называются критическими температурами, а соответствующие им точки на кривых охлаждения – критическими точками. Для определения критических точек сплава достаточно через короткие, но равные промежутки времени измерять температуру медленно охлаждающегося от жидкого состояния до комнатной температуры сплава, затем, построив по этим данным кривую охлаждения в координатах «Температура − время», отыскать на ней точки перегиба, которые и будут являться критическими точками данного сплава. В сплавах в зависимости от характера взаимодействия металлов друг с другом в твёрдом состоянии образуются твёрдые фазы и протекают различные фазовые превращения: образование твердых растворов, химических соединений, смесей. По критическим точкам чистых металлов и сплавов строятся диаграммы фазового равновесия. Эти диаграммы в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации компонентов и дают наглядное представление о процессах, происходящих в сплавах системы при нагреве и охлаждении. Различают следующие основные типы диаграмм состояния: · диаграмму для случая полной нерастворимости компонентов в твердом состоянии (образование смесей), рис. 3.1а; · диаграмму для случая неограниченной растворимости компонентов в твердом состоянии (неограниченные твердые растворы), рис. 3.1б; · диаграмму для случая ограниченной растворимости компонентов в твердом состоянии (ограниченные твердые растворы), рис. 3.1в; · диаграмму для случая, когда компоненты образуют химическое соединение, рис. 3.1г. Сплавы, образующие диаграмму первого типа (рис. 3.1а), в твердом состоянии представляют собой смеси из зерен чистых металлов А и В.
а) Рис. 3.1. Диаграммы состояния сплавов (начало)
б)
в)
г) Рис. 3.1. Диаграммы состояния сплавов (окончание)
В сплавах на рис. 3.1в металлы А и В образуют два типа растворов: твёрдый раствор компонента В в компоненте А – α -твёрдый раствор и твёрдый раствор компонента А в компоненте В – β -твёрдый раствор. Совокупность точек начала кристаллизации всех сплавов системы (линия АСВ в рис. 3.1а–в) называется ликвидус. Выше этой линии все сплавы находятся в жидком состоянии. Совокупность точек конца кристаллизации всех сплавов системы Сплавы, представленные на рис. 3.1б, ниже линии солидус при любой концентрации имеют только одну фазу – зерна твердого раствора компонента В в компоненте А. Сплав двух металлов А и В определенной концентрации, образующийся в точке С (рис. 3.1а, в), называется эвтектическим. Такой сплав кристаллизуется подобно чистому металлу при постоянной температуре, образуя смесь кристаллов двух твёрдых растворов, называемую эвтектикой. Сплавы с концентрацией металла В меньше эвтектической называются доэвтектическими, а с концентрацией металла В больше эвтектической − заэвтектическими сплавами. Рассмотрим кривую охлаждения доэвтектического сплава (рис. 3.2).
Рис. 3.2. Кривая охлаждения доэвтектического сплава
На участке 1 – 2 идет охлаждение жидкого сплава по физическим законам. В точке 1 начинается процесс кристаллизации, за счёт выделения скрытой теплоты кристаллизации уменьшается скорость охлаждения сплава и на кривой охлаждения образуется перегиб. Температура t1 – критическая точка начала кристаллизации из жидкости α -твёрдого раствора. Этот процесс продолжается до точки 3. В точке 3 начинается кристаллизация эвтектики – смеси двух фаз, выделяющихся из жидкого раствора эвтектической концентрации. Кристаллизация эвтектики происходит при постоянной температуре (участок 3 – 4) и заканчивается в точке 4 при температуре t2 по реакции Ж → (α + β). Температура t2 – критическая точка конца первичной кристаллизации сплава. На участке 4 – 5 при охлаждении сплава понижается растворимость компонента В в компоненте А. Это приводит к выпадению вторичных кристаллов βII из α-твёрдого раствора: α → βII. В результате описанных процессов в сплаве образуется конечная структура, состоящая из первичных кристаллов α -твёрдого раствора, эвтектики (α + β) и вторичных кристаллов βII -твёрдого раствора.
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 662; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.109.147 (0.009 с.) |