
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы процесса кристаллизации металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Процесс образования кристаллов называется кристаллизацией. Визуальное изучение кристаллизации металлов сопряжено с техническими трудностями. Поскольку законы кристаллизации растворов солей и расплавленных металлов сходны, изучение процесса кристаллизации можно проводить на растворах солей. Согласно законам термодинамики, устойчивым состоянием при определённых внешних условиях будет то состояние, которое обладает меньшим уровнем свободной энергии. Под свободной энергией понимают часть внутренней энергии, которая может быть превращена в работу. При изменении внешних условий (например, при понижении температуры) любая система самопроизвольно стремится к состоянию с наименьшим уровнем свободной энергии.
Рис. 2.1. Изменение свободной энергии жидкого Gж и твёрдого Gт состояния в зависимости
С изменением температуры свободная энергия жидкого Gж и твёрдого Gт состояния изменяется по разным законам (рис. 2.1). При высоких температурах жидкое состояние обладает меньшей свободной энергией, поэтому металл при этих температурах находится в жидком состоянии (области III, IV). При охлаждении металл достигнет температуры Т0, при которой свободные энергии жидкого и твёрдого состояния равны. Эта температура Т0 носит название теоретической (равновесной) температуры кристаллизации при охлаждении и температуры плавления при нагреве. При Т0 процесс кристаллизации протекать не может. Для развития процесса кристаллизации надо создать условия, при которых свободная энергия твёрдого состояния будет меньше, чем свободная энергия жидкого состояния. Это возможно лишь при охлаждении ниже Ткр, т. е. ниже теоретической температуры кристаллизации на некоторую величину ΔТ. В области II металл при охлаждении продолжает оставаться в жидком состоянии, поскольку разность (Gж – Gт) невелика и температура не достигла критического значения Ткр при котором твёрдое состояние обладает меньшей свободной энергией. При достижении Ткр разность (Gж – Gт) увеличивается, поэтому оставаться дальше в жидком состоянии металл не может, и при этой температуре в металле самопроизвольно начинается процесс кристаллизации.
В области I (рис. 2.1) металл будет находиться в твердом состоянии. Температура Ткр носит название фактической температуры кристаллизации, а разность между теоретической и фактической температурами Для развития процесса плавления необходима некоторая степень перегрева:
где Тпл – фактическая температура плавления. Д. К. Чернов ещё в 1878 году показал, что кристаллизация складывается из двух элементарных процессов (рис. 2.2). Первый процесс заключается в образовании из жидкого раствора мельчайших кристаллических частиц-зародышей или центров кристаллизации. Интенсивность этого процесса определяется числом зародышей ЧЗ, возникающих в единице объёма (1 мм3) за единицу времени (1 с). Второй процесс состоит в росте кристаллов из зародышей. Интенсивность этого процесса определяется скоростью кристаллизации (СК) – линейным перемещением грани кристалла (в миллиметрах) в единицу времени (1 с).
Рис. 2.2. Последовательные этапы процесса кристаллизации
Рост кристаллов заключается в том, что к их зародышам присоединяются все новые атомы жидкого металла. Сначала кристаллы растут свободно, сохраняя правильную геометрическую форму, но это происходит только до момента встречи растущих кристаллов. В месте соприкосновения кристаллов рост отдельных их граней прекращается и развиваются не все, а только некоторые грани кристаллов. В результате кристаллы не имеют правильной геометрической формы и называются кристаллитами или зернами. Процессы образования зародышей и роста кристаллов протекают одновременно, причём интенсивность их зависит от степени переохлаждения. При данной степени переохлаждения величины ЧЗ и СК – постоянные в течение всего времени процесса кристаллизации. Размер полученных кристаллов N зависит от соотношения ЧЗ и СК при данной степени переохлаждения и выражается формулой
где α − коэффициент пропорциональности. При малой степени переохлаждения ΔТ1 (рис. 2.3) кристаллы после затвердевания будут крупными, так как ЧЗ мало, а СК велика. При большой степени переохлаждения ΔТ2 кристаллы будут мелкими, так как кристаллизация в этом случае идёт при почти той же СК, что и в первом случае, но при значительно большем ЧЗ. Таким образом, изменяя степень переохлаждения, можно получить кристаллы разной величины.
Рис. 2.3. Зависимость ЧЗ и СК от степени переохлаждения при кристаллизации металлов
Степень переохлаждения зависит от скорости охлаждения. Чем больше скорость охлаждения, тем больше степень переохлаждения и мельче кристаллы. В реальных условиях затвердевания больших масс металла на процесс кристаллизации, размер и форму кристаллов оказывают влияние и другие факторы: твёрдые взвешенные тугоплавкие частицы примесей, инородные тела, газовые включения, теплоёмкость самого металла, направление отвода тепла, конвекционные потоки в жидком металле, температура заливаемого металла и формы, способы заливки, состояние поверхности изложницы (формы) и другие. Форма растущих кристаллов определяется не только условиями их столкновений между собой, но и составом сплава, наличием примесей и условиями охлаждения. В большинстве случаев при кристаллизации металлов механизм образования кристаллов носит так называемый дендритный характер. Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет главным образом в тех направлениях решетки, которые имеют наибольшую плотность упаковки атомов (минимальное межатомное расстояние). В этих направлениях образуются длинные ветви будущего кристалла − так называемые оси первого порядка (I на рис. 2.4).
Рис. 2.4. Схема дендритного роста кристалла
В дальнейшем от осей первого порядка под определенными углами начинают расти новые оси, которые называют осями второго порядка (II), от осей второго порядка растут оси третьего порядка (III) и т. д. По мере кристаллизации образуются оси более высокого порядка (четвертого, пятого, шестого и т. д.), которые постепенно заполняют все промежутки, ранее занятые жидким металлом. Если жидкого металла не хватает для заполнения межосных пустот, то древовидная форма кристаллов сохраняется. Такие дендриты можно обнаружить в усадочных раковинах и на свободной поверхности слитков. Если жидкого металла достаточно для заполнения межосного пространства, то образуются крупные кристаллы, вытянутые в направлении главного теплоотвода. Такие кристаллы называются столбчатыми. При равномерном теплоотводе, а также при большом числе зародышей, кристаллы растут с одинаковой скоростью по всем направлениям и вырастают равнооcными. Процесс кристаллизации слитка спокойной стали (рис. 2.5а) начинается у стенок изложницы и последовательно продвигается к центру слитка.
а)
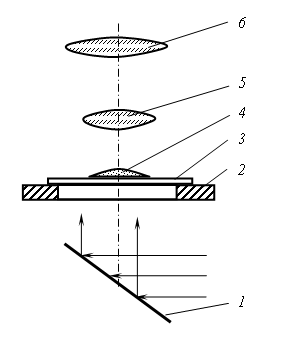
Рис. 2.5. Строение стального слитка: а – реальный слиток стали; Поэтому кристаллизация здесь идёт при большой степени переохлаждения, при большом числе зародышей. Кристаллы получаются равноосными, беспорядочно направленными, потому что оси первого порядка растут перпендикулярно неровностям внутренней поверхности изложницы. Растущие кристаллы сталкиваются между собой и образуют зону мелких дезориентированных кристаллов. Следующая зона 2 − зона столбчатых крупных кристаллов, главная ось которых перпендикулярна стенке изложницы. Кристаллы получаются крупными, так как в этой зоне скорость охлаждения меньше, чем в зоне 1, потому что тепло отводится не холодной стенкой, а через зону 1 и уже нагревшуюся стенку изложницы. Кристаллизация идёт с меньшей степенью переохлаждения и с меньшим числом зародышей. Кристаллы вытянуты главной осью перпендикулярно стенке изложницы, так как в этом направлении идет главный теплоотвод. В центре слитка образуется зона 3 − зона крупных равноосных кристаллов. В этой части слитка скорость охлаждения меньше, чем в зонах 1 и 2, поэтому кристаллизация идет при малой степени переохлаждения, при малом числе зародышей. Кристаллы этой зоны получаются равноосными, произвольно ориентированными, так как отвод тепла идет во всех направлениях с одинаковой скоростью. Скелетом этих крупных кристаллов являются дендриты (рис. 2.5а). Кристаллизация солей В данной работе студенты изучают процесс кристаллизации четырёх солей: нитрата свинца Рb(NO3)2, хлорида аммония NH4Cl, дихромата калия К2Сr2O7 (хромпик), хлорида натрия NaCl (поваренная соль), вызванный испарением растворителя. Водные растворы этих солей приготавливаются почти насыщенными с тем, чтобы незначительное испарение воды привело их к состоянию перенасыщения и выделению кристаллов. Наблюдение за процессом кристаллизации солей производится с помощью биологического микроскопа, работающего по принципу проходящего света (рис. 2.6). Лучи от естественного источника света, отразившись от зеркала микроскопа, проходят через отверстие предметного столика, предметное стекло, каплю соли и попадают в объектив. Полученное в объективе изображение капли увеличивается им и окуляром. Пройдя через окуляр, лучи попадают в глаз наблюдателя. Наблюдение за кристаллизацией капель в этой работе проводится при увеличении, но более чем
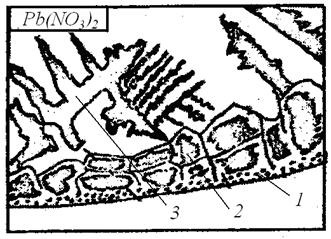
Рис. 2.6. Схема хода лучей в биологическом микроскопе: Порядок выполнения работы 1. Глядя в окуляр, вращать зеркало микроскопа, добиваясь яркого освещения (получить светлое поле). 2. Предметное стекло с нанесенной на него каплей соли установить на предметный столик так, чтобы капля была в центре отверстия предметного столика. 3. Произвести грубую настройку на фокус, для чего смотреть одним глазом в окуляр и, держа второй глаз открытым, вращать винт грубой подачи, поднимая тубус до тех пор, пока не появится изображение капли. 4. Вращением микрометрического винта произвести тонкую настройку на фокус. 5. Перемещать предметное стекло по предметному столику, наблюдая за кристаллизацией сначала у краёв капли, а затем в центре капли. 6. По мере появления кристаллов производить зарисовку в журнал, передавая при этом особенности их строения. 7. Исследование начинать с капли нитрата свинца, так как его кристаллизация идёт аналогично кристаллизации слитка спокойной стали. Наибольшее испарение возникает у краёв капли, так как тут уровень жидкости наименьший, а концентрация соли раньше, чем в других местах, достигает предела насыщения. Здесь образуются мелкие равноосные кристаллы. Они настолько мелкие, что при используемом в данной работе увеличении каждый кристалл невиден, и эта зона чаще всего просматривается в виде тонкой тёмной линии (рис. 2.7). Затем начинают образовываться крупные, вытянутые нормально к краям капли столбчатые кристаллы. Здесь кристаллизация идёт при большой скорости и ограниченном числе зародышей. В последнюю очередь кристаллизация идёт в центре капли, где образуются крупные кристаллы, имеющие форму дендритов.
Рис. 2.7. Строение затвердевшей капли раствора нитрата свинца:
3. Контрольные вопросы 1. На рис. 2.1 укажите: · теоретическую температуру кристаллизации (плавления) металла; · фактическую температуру кристаллизации (плавления) металла; · необходимое условие, при котором начнётся процесс кристаллизации (процесс плавления) металла; · а) жидком при охлаждении; б) твёрдом при охлаждении; в) твёрдом при нагреве; г) жидком при нагреве. 2. На рис. 2.3 укажите, при какой величине переохлаждения металл закристаллизуется наиболее крупнозернистым (наиболее мелкозернистым). 3. Укажите среду закристаллизовавшегося раствора соли: а) Рb(NO3)2, 4. Укажите форму и схему строения закристаллизовавшейся капли водного раствора соли, схожую со структурой слитка спокойной стали. Объясните особенности ее строения.
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1541; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.234.68 (0.009 с.) |


 называется степенью переохлаждения. Таким образом, кристаллизация может протекать лишь в условиях переохлаждения ниже теоретической температуры кристаллизации.
называется степенью переохлаждения. Таким образом, кристаллизация может протекать лишь в условиях переохлаждения ниже теоретической температуры кристаллизации. ,
,
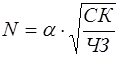 ,
,



 область температур, в которых металл будет находиться в агрегатных состояниях:
область температур, в которых металл будет находиться в агрегатных состояниях:


