
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методики анализа портландцементаСодержание книги Поиск на нашем сайте СОДЕРЖАНИЕ Введение………………………………………………………………………...…3 1 Аналитический обзор методов анализа силикатов…………………………...6 1.1 Отбор проб………………………….…………………………………..6 1.2 Выбор метода анализа…………………………………………………7 2 Методики анализа портландцемента………………………….……...…….13 2.1 Схемы систематического анализа цемента………………………….13 2.2 Определение влаги гравиметрическим методом……………………14 2.3 Определение оксида кремния………………………………………...15 2.4 Отделение гидроксидов железа и алюминия………………………..17 2.5 Определение оксида железа (III)……………………………......……18 2.6 Определение оксида алюминия комплексонометрическим методом………………………………………..………………………21 2.7 Определение оксидов кальция и магния комплексонометрическим методом……………………………………………………………….25 3 Обработка результатов………………………………………………………29 3.1 Определение влаги гравиметрическим методом……………………29 3.2 Определение оксида кремния……………………….………………..30 3.3 Определение оксида железа (III)……………………………......……31 3.4 Определение оксида алюминия………………………...……………32 3.5 Определение оксида кальция………………………………….……..32 3.6 Определение оксида магния…………………………..….…………..33 3.7 Сводная таблица результатов анализа……………………………….33 Заключение……………………………………………………………………….34 Литература……………………………………………………………………….35
ВВЕДЕНИЕ Силикаты – химические соединения, содержащие кремнезем SiO2. Природные силикаты важнейший класс минералов. Силикаты отличаются весьма разнообразным составом. В природных силикатах наряду с кремнеземом могут содержаться: Ti+4, Zr+3, Al+3, Cr+3, B+3, Fe+3, Fe+2, Ca+2, Mg+2, Ba+2, Mn+2, Na+, K+, Li+. В состав силикатов могут входить анионы О2-, OH-, F-, Cl-, CO32-, SO42-. Вода в силикатах содержится как в виде анионов OH, входящих в решетку (т.н. конституционная вода), так и в виде молекул H2O (кристаллизационная вода). Кроме того силикаты содержат адсорбированную на поверхности частиц воздух. Силикатные породы составляют 75% земной коры, а если учесть, что свободный кремнезем в виде кварца и опала составляет еще 12%, то окажется, что коло 87% земной коры слагают породы, которые являются сырьевым материалом для производства самой необходимой продукции. 1. Силикатные горные породы используются в технологических процессах, в которых применяются обжиг и плавка материала. Это производства: цемента (глины и мергели), шамота (глины и каолины), глазурей, стекол (полевые шпаты, нефелины, литиевые алюмосиликаты, циркон). При обжиге таких силикатов как вермикулиты, перлиты и ряда глинвозможно получить легковесные наполнители (керамзит, пенобетон). 2. Некоторые группы силикатов обрабатывают без отжига в таких областях техники как: в электроизоляционных производствах (слюды), при изготовлении термоизоляционных и кислостойких изделий (асбест), строительных материалов, труб (асбоцемент). Силикаты широко используются в качестве сорбентов для очистки технических и пищевых масс, осветления вин (бентонитов глины), очистки сточных вод, а также выхлопных газов от SO2 (цеолиты), в производстве резины (белая сажа, тальк), изготовления абразивов (твердые силикаты алюминия–гранаты). К силикатам относятся изумруд, топаз, турмалин, голубой аквамарин. 3. Силикатные твердые породы применяют как естественные строительные материалы (гранит). 4. Силикатные руды и материалы используются для извлечения материалов, оксидов солей: из лепидолита извлекается Li, из поллуцита – Cs, из бериллов – Be. Состав готовой продукции в зависимости от типа и назначения получаемых материалов различен. Однако в состав всех материалов входят одни и те же основные компоненты сырья – силикатные породы. Так в химический состав портландцемента (без добавок) входят следующие соединения (таблица 1). Таблица 1 – Химический состав портландцемента
Минералогический состав портландцемента представлен в таблице 2. Таблица 2 – минералогический состав портландцемента
Химический состав некоторых стекол приведен в таблице 3. Состав сырьевых материалов, поступающих на промышленные предприятия не постоянен. Содержание в них наиболее распространенных элементов кремния, железа, алюминия, кальция, магния колеблется в довольно широких пределах. Таблица 3 – Состав некоторых стекол (%)
Во избежание возможных нарушений технологического процесса и конечного химического состава готовых изделий все вновь поступающие партии сырьевых материалов на заводы, а также партии готовой продукции подвергаются химическому анализу. На основании аналитических определений корректируется состав различных шихт и оценивается качество готовой продукции. То есть, анализ является неотъемлемой частью технологического процесса. Аналитические определения обеспечиваются цеховыми и центральными лабораториями предприятия. Все анализы выполняются и документируются в соответствии с ГОСТом или ТУ. В области чистой науки целью анализа силикатов является получение данных о составе минералов, горных пород, магмы земной коры и даже химических тел. Развитие ряда геологических наук немыслимо без анализа силикатов. Это в первую очередь касается геохимии. Геохимию можно определить как науку, занимающуюся исследованием распространения элементов в земной коре, их миграцию во времени и пространстве. Отбор проб На предприятии силикаты в качестве сырьевого материала поступают большими партиями в несколько сотен тонн в год. Для проведения количественного определения необходимо иметь массу исследуемого материала не более грамма. Поэтому отбор проб следует осуществлять так, чтобы содержание определяемых в пробах компонентов действительно соответствовал среднему значению. Приемы и порядок отбора проб предписывается ГОСТ. Например, для партии железнодорожного состава может быть предписано, отбирать пробы через каждую платформу, причем в разных частях её объема. Отобранный материал измельчают обычно в шаровых мельницах. Чтобы при этом материал не загрязнялся размельчителем, последний должен быть более твердым по сравнению с измельчаемыми компонентами. Для уменьшения количества отобранного материала до величины навески необходимой для проведения анализа применяют различные приемы и приспособления. Простейший из них – метод квартования. В этом случае материал насыпают в виде конуса, из которого формируют усеченную пирамиду. Ее делят по диагонали. Два противоположных сектора отбрасывают и из оставшейся части материала формируют новую пирамиду. Так повторяют до тех пор, пока количество отобранного материала не будет соответствовать необходимой массе пробы. Пробу обычно используют для неоднократного проведения анализа и, следовательно, для неоднократного взятия навесок. Поэтому проба должна быть достаточно большой и соответствовать числу навесок. При этом еще должна оставаться часть пробы, сохраняемая для независимых арбитражных проверок правильности результатов анализа. Масса пробы составляет приблизительно 150 - 200 г. Ее хранят в стеклянном сосуде с плотно притертой пробкой. Выбор метода анализа Вскрытие (разложение) силикатов состоит во взаимодействии силикатных материалов с химическими реагентами, которые приводят к разрушению кристаллической структуры силикатов и образованию более простых соединений. Способы вскрытия силикатов делятся на две группы: 1) пробы обрабатывают щелочами или солями щелочных металлов при высокой температуре. Эти способы применяются при выполнении многокомпонентного анализа. Для вскрытия кислых пород требуется пятикратная масса плавня, а для основных пятнадцатикратная масса. Наибольшее распространение получил способ сплавления силикатов с карбонатом натрия при температуре 950 - 1000 °С. При сплавлении протекают следующие реакции: Fe2O3 + Na2CO3 = 2NaFeO2 + CO2↑; AI2O3 + Na2CO3 = 2NaAIO2 + CO2↑; SiO2 + 2Na2CO3 = Na4SiO4 + 2CO2↑. При последующем выщелачивании сплава водой соединения Mg, Ca, Fe, а также Ti, Zr переходят в малорастворимое состояние. Часть кремния в виде силикатов щелочи металлов перейдет в раствор. Распределение элементов между осадком и раствором неколичественное, т.е. элемент может одновременно находиться и в растворе и в осадке. При добавлении соляной кислоты осадки растворяются, например: NaFeO2 + 4HCI = NaCIFeCI3 + 2H2O; NaAIO2 + 4HCI = NaCI + AICI3 +2H2O; Na4SiO4 + 4HCI = H4SiO4 + 4NaCI. Кремневая кислота сначала образует коллоидный раствор, а затем по мере упаривания превращается в труднорастворимый гель. Эту двухфазную систему подвергают дальнейшему анализу; 2) пробу обрабатывают фтористой кислотой вместе с другими кислотами. В последнем случае кремневая кислота улетучивается, а оставшаяся часть компонентов силикатной горной породы подвергается анализу. После разложения плава переходят собственно к анализу. Наиболее старым методом анализа силикатов на содержание Si, AI, Fe, Ca, Mg, K, Na является классическим гравиметрическим методом. Он основан на осаждении, указанных элементов в виде тех или иных соединений, фильтрация осадка, их прокаливании, взвешивании, и расчете соединений элементов [1 - 5]. Обычно после осаждения и прокаливании осадки их переводят в оксиды металлов: SiO2, Fe2O3, AI2O3, K2O, Na2O, которые взвешивают и пересчитывают на содержание соответствующих элементов в навеске по формуле: ω(Ме) =
Диоксидкремния (SiO2) является ангидридом ортокремневой кислоты Si(OH)4 или H2[Si(OH)6]. Безводный диоксид кремния, особенно его кристаллические формы, при нормальной температуре являются довольно инертным веществом. Он не взаимодействует с водой, почти не реагирует с минеральными кислотами (кроме HF). При нагревании его активность значительно увеличивается. При сплавлении с карбонатами щелочных металлов выделяется CO2 и образуются соответствующие силикаты. Кремневая кислота слабый электролит (К1дис = 10 -10, К2дис=10-12, pHвод.р-ра составляет 4 - 4,5). В водных растворах гидратированный диоксид кремния при определенных условиях находится в форме истинного раствора мономера ортокремневой кислоты. Устойчивость ее зависит от pH. Наиболее устойчивы растворы с pH 2. При подкислении раствора происходит полимеризация, которая протекает вплоть до коагуляции и обезвоживании полимера. Растворимость кремневой кислоты также зависит от pH раствора. При pH 1 - 4 растворимость составляет 0,013 - 0,015%, а при pH 10,3 и 10,6 соответственно 0,049% и 0,112%. Эти особенности поведения кремневой кислоты необходимо учитывать при количественном определении кремния химическими методами. Особенно в тех случаях, когда всю кремневую кислоту необходимо перевести в нерастворимое состояние. В настоящее время гравиметрический метод широко применяется в практике заводских лабораторий. Это объясняется тем, что метод сравнительно прост, доступен и для его проведения не требуется сложной и дорогостоящей аппаратуры. Кроме того, метод обладает высокой точностью по сравнению со всеми остальными методами. Недостатком этого метода является трудоемкость и длительность выполнения анализа. В связи с этим в настоящее время применяют многочисленные варианты ускорения химических определений SiO2 и других компонентов. К этим методам относятся определения SiO2 методом весовой коагуляции, который проводят с помощью желатина и других коагуляторов. Другим методом является дегидратация кремневой кислоты с использованием различных минеральных кислот (HCl, H2SO4, HNO3, HClO4) [6 - 7]. Серная кислота является одним из наиболее активных водоотнимающих средств применяемых для дегидратации и используется в тех случаях, когда образуются летучие хлориды мышьяка, олова и сурьмы. Недостаток применения серной кислоты заключается в ее способности образовывать нерастворимые сульфаты Ba, Ca, Sr и Pb, которые выпадают в осадок вместе с SiO2. Азотную кислоту применяют редко, так как многие нитраты, например Fe2+, Fe3+ дают при нагревании основные труднорастворимые соли за счет гидролиза. Часто пробы обрабатывают плавиковой кислотой (HF) в присутствии H2SO4. В результате чего образуется летучий четырехфтористый H4SiO4 + 4HF = SiF4↑ +4H2O. Содержание оксида кремния определяют по убыли массы пробы. Этот метод применяется при содержании SiO2 свыше 90%. Хлористая кислота (HCIO4) является наилучшим реагентом для обезвоживания кремневой кислоты. При дымлении с HCIO4 в течении 20 минут достигается наиболее полное выделение кремневой кислоты в наиболее чистом виде, т.к. большинство перхлоратов металла растворимы за исключением KCIO4 и частично NaCIO4. Применяют хлористую кислоту с большой осторожностью, т.к. при нагревании с окисляющимися веществами она разлагается со взрывом. Определение Fe, AI, Ca и Mg ускоренным методом проводят титриметрически [7 - 8]. В этом случае также используют осаждение, однако осадки не прокаливают до постоянной массы и не взвешивают. Достаточно их растворить в определенном растворе реагента (кислоте) создать необходимые условия титрования и титровать соответствующим титрантом. Сущность титриметрического комплексонометрического метода определения AI, Fe, Ca, Mg с помощью комплексона III заключается в том, что комплексон образует в растворе с катионом очень прочное комплексное соединение. При создании определенных условий (pH, подбор соответствующего индикатора) проводят прямое или обратное титрование. Возможно применение для отдельных элементов, например кальций, других титрантов. Так кальций осаждают оксалатом аммония, растворяют его в H2SO4 и титруют перманганатом калия, выделившуюся щавелевую кислоту (заместительный способ титрования), а по результатам титрования определяют соединение Ca. В последнее время находят применение физико-химического и физического метода анализа, которые позволяют провести полный анализ силиката буквально за минуты. Однако, эти методы требуют очень дорогостоящего оборудования, высокой квалификации специалиста и является менее точными чем химические. Среди физико-химических для анализа силикатов используется главным способом спектрометрические методы: - молекулярно-адсорбционная спектроскопия; - атомно-эмиссионная спектроскопия (фотометрия пламени); - спектральный эмиссионный анализ; - атомно-адсорбционная спектроскопия. Методом молекулярно-адсорбционной спектроскопии основан на измерении интенсивности окраски растворов химических соединений, определяемых элементов с органическими реагентами. Этим методом в силикатных породах определяют Si, AI и Fe [8 - 9]. В пламенно-фотометрическом эмиссионном анализе раствор после разложения и выщелачивания силикатов вскрывают газовое пламя. Атомы элементом переходят в возбужденное состояние и при возвращении в основное состояние излучают квант энергии в виде фотона и окрашивают пламя в тот или иной цвет. По интенсивности излучения судят о количестве определенного элемента. В анализе силикатных пород этот метод применяется для определения K, Na, Li [10]. Атомно-адсорбционный метод основан на способности газообразных атомов поглощать электромагнитное излучение видимой и ультрафиолетовой части спектра. В этом методе измеряют интенсивность поглощения светового потока, которая пропорциональна концентрации элементов в растворе после вскрытия пробы [12]. Перечисленные методы применяют для определения в силикатах как в главных, так и сопутствующих элементов, таких как Si, Al, Fe, Mg, Ca, Na, K, Ti, Mn. Для атомизации в пламени используются растворы после вскрытия силикатов различными способами: а) фтористым водородом на воздухе и герметических сосудах б) смесью кислот в) сплавлением метаборатом лития Методы молекулярной атомно-адсорбционной и эмиссионной спектроскопии требуют приготовление стандартных растворов по составу близких к растворам, получаемым после разложения проб. Поэтому их применение предусматривает предварительный анализ того или иного силиката. Эти методы позволяют при наличии стандартных растворов после разложения проб, значительно сокращать продолжительность определения компонентов по сравнению с химическими методами на завершающих стадиях анализа [8 - 12]. Спектральный анализ силикатов один из первых физических методов, который стал применяться в заводских лабораториях. Сущность метода заключается в испарении твердых образцов силикатных пород в электрической дуге или искре. При этом атомы элементов дают линейчатые спектры с характерными длинами волн для каждого элемента. По интенсивности соответствующих спектральных линий судят о количестве определяемых элементов в силикатных породах [13]. Метод применим в том случае, когда требования к точности анализа не велики. Кроме того верхняя граница интервала кремния (50%) не позволяет применять его для анализа всех типов кислых пород, например по Fe2O3 (от 0,1 до 10%) и многих основных. В последнее время находят применения ренгено-флуоризцентный метод, который основан на облучении образцов рентгеновским излучением с последующей регистрации характеристических спектров флуоризценции элементов, входящих в состав силикатов. Этим методом можно одновременно определить около 10 элементов (Si, AI, Fe, Ti, Ca, Mg, Mn, K, P) в силикатных горных породах. В качестве стандартных образцов в этих случаях используются природные соединения близкого химического состава и строения. Для проведения практики выбраны химические методы: классический гравиметрический, для определения гидроскопической влаги и оксида кремния, и ускоренные титрометрические, для определения оксида AI, Fe, Ca, Mg. Определение оксида кремния Ошибка повторяемости и расхождение между результатами параллельных определений не должны превышать значений, указанных в таблице 4. Таблица 4 – Ошибка повторяемости и расхождение между результатами параллельных определений оксида кремния
2.3.1 Гравиметрический метод при массовой доле оксида кремния до 90% Метод основан на коагуляции желатином кремнекислоты, выделившийся при разложении анализируемой проба концентрированной соляной кислотой при нагревании, способствующем быстрому количественному переводу ее в нерастворимое состояние, последующем прокаливании выделенного осадка при температуре 1000 °С и нахождении массовой доли оксида кремния по изменению массы выделенного осадка. Аппаратура, материалы и реактивы Весы лабораторные общего назначения. Печь муфельная. Кислота соляная по ГОСТ 3118. Кислота фтористоводородная по ГОСТ 10184. Кислота серная по ГОСТ 4204. Кислота азотная по ГОСТ 4461. Желатин пищевой по ГОСТ 11293, раствор массовой концентрацией 10 г/дм3: 1,0 г желатина растворяют в 100 см3 воды, нагретой до 70 °С, раствор должен быть свежеприготовленным. Натрий углекислый по ГОСТ 83. Серебро азотнокислое по ГОСТ 1277, раствор массовой концентрацией 10 г/дм3.
2.3.2 Проведение анализа Клинкер, портландцемент, шлакопортландцемент и другие материалы, разлагаемые кислотами, переводят в раствор, обрабатывая их соляной кислотой. Для этого навеску пробы массой 0,5 г помещают в стакан вместимостью 50 см3 и осторожно добавляют 10 см3 соляной кислоты так, чтобы она стекла по стенке стакана, и накрывают часовым стеклом. Независимо от способа разложения навески стакан погружают в нагретую до температуры 60 - 70 °С водяную баню и выдерживают 10 мин. Затем прибавляют 10 см3 желатина, энергично перемешивают в течение 1 мин, не вынимая стакан из водяной бани и нагревают еще 10 мин. Раствор фильтруют в теплом виде через беззольный фильтр «белая лента», количественно перенося осадок на фильтр. Осадок промывают на фильтре 2.3.3 Обработка результатов Массовую долю оксида кремния (
где m1-масса тигля с осадком оксида кремния до обработки кислотами, г; m2-масса тигля с остатком после обработки кислотами, г; m-масса навески пробы, г. ОБРАБОТКА РЕЗУЛЬТАТОВ Определение оксида кремния mстакана на технических весах = 52,21 г. mстакана на аналитических весах = 52,25985 г.
mстакана с навеской на технических весах = 52,71 г. mстакана с навеской на аналитических весах = 52,7689 г.
mнавески = mстакана с навеской – mстакана = 52,7689 – 52,25985 = 0,50905 г. mтигля на технических весах = 16,60 г. mтигля на аналитических весах = 16,6143 г.
mтигля с навеской = 16,7067 г.
Определение оксида железа С (КIII) = 0,01335 моль/л; Т (КIII) = 0,0044885 г/см3.
3.3.1 Результаты титрования железа (III) 1) V (KIII) = 2,00 см3; 2) V (KIII) = 2,1см3; 3) V (KIII) = 2,2см3; Vср(KIII) = 2,1 см3. m(Fe2O3) = ω(Fe2O3) = Определение оксида алюминия ТТрБ = 0,0044885 г/см3; С(FeCl3) = 0.04382 моль/л; Т(FeCl3) =0,007108 г/см3; ТТрБ = 3.4.1 Результаты титрования алюминия (III) 1) V (FeCl3) = 5,2 см3; 2) V (FeCl3) = 5,3 см3; 3) V (FeCl3) = 5,2 см3; Vср (FeCl3) = 5,23 см3.
К =
Определение оксида кальция Результаты титрования кальция 1) V (KIII) = 1,7 см3; 2) V (KIII) = 1,65 см3; 3) V (KIII) = 1,7 см3; Vср (KIII) = 1,68 см3. M (CaO) = ω(СаО) =
Определение оксида магния
Результаты титрования магния 1) V (KIII) = 6,5 см3; 2) V (KIII) = 6,5 см3; 3) V (KIII) = 6,5 см3; Vср (KIII) = 6,5 см3. m(MgO) =
3.7 Сводная таблица результатов анализа Таблица – 9.
ЗАКЛЮЧЕНИЕ Для определения количественного содержания основных компонентов портландцемента были использованы следующие методы: гравиметрический для определения гигроскопической влаги и SiO2 и комплексонометрический для определения Fe2O3 , Al2O3 , MgO, CaO. В анализируемом образце Fe2O3, Al2O3, MgO попадают в интервалы содержания компонентов, а CaO и SiO2 имеют заниженные результаты. Это может быть связано со следующими причинами: Ca осадился в виде гидроксида вместе с Fe и Al, где и был обнаружен в последствии при титровании этого раствора (9%). Ошибка определения SiO2 могла быть допущена в момент осаждения и связана с недоосаждением кремния, либо с неполным переводом кремниевой кислоты в нерастворимое состояние. Это могло быть связано с плохим качеством желатина, недостаточным нагревом пробы, недостатком кислоты, что и привело к тому, что не вся кремниевая кислота перешла в нерастворимое состояниие – гель. Так как ГОСТированные методики требуют очень точного выполнения, это и могло сильно повлиять на конечный результат определений. Комплексонометрический метод аналаза является более удобным, чем гравиметрический для выполнения анализа из-за его простоты. Гравиметрический метод включает в себя такие операции как: осаждение, фильтрование, промывание осадка, высушивание, озоление, прокаливание до постоянной массы и поэтому он более трудоёмкий и требует высокой квалификации специалиста и навыков выполнения выше перечисленных операций, которые отсутствуют у студентов. ЛИТЕРАТУРА 1. Гровс А. Анализ силикатов – М.: Иностранная литература,1953.- 302 с. 2. ГОСТ 21216.3-81. Сырье глинистое. ГОСТ 22552.0-77.Песок кварцевый, молотый песчаник, кварцит и жильный кварц для стекольной промышленности. Общие требования к методам анализам (SiO2, Fe2O3, Al2O3, TiO2). 3. ГОСТ 21216.0 - 81.Сырье глинистое. Метод определения минерального состава. 4. Егорова Е.Н. Методы выделения кремниевой кислоты и аналитическое применение кремнезема. М., Наука, 1959.- 201 с. 5.Ивасаки И. Иосида, Ямая К. Так называемая «минус вода» в вулканических породах.- Кадзаи. BullVolconol, Soc.Japan.1968.-v. 13, 6. Методические основы исследования химического состава горных пород, руд и минералов. Под ред. Г.В. Остроумова М: Недра. 1979.- 250 с. 7. ГОСТы 2642.1 – 86, 2642.3 - 97, 2642.4 - 97, 2642.5 - 97, 2642.7, 8. Хализова В. А., Столярова И. А., Хитров В. Г., Сорокин И. В. Определения кремния и алюминия в минеральном сырье. М. Недра 1982 - 278с. 9. ГОСТ19609.0 - 89. Каолин обогащенный. Методы испытаний. Фотометрическое определение Fe2O3. 10. ГОСТ 19609.15 - 89. Каолин обогащенный. Пламенно-фотометрическое определение K2O, Na2O. 11. ГОСТ 23673.4 - 79. Доломиты для стекольной промышленности. Методы определения SiO2. 12. Воробьева В. С., Вонкова М. А., Пятова В. Н. Атомно-абсорбционное определение кремния, титана, алюминия, железа, кальция, магния и марганца и силикатных горных породах и боксите. В кн.: Методы химического анализа минерального сырья. М. ВИИС. - 1977. - № 15. - С. 72 - 78. 13. Русаонов А.К. Основы количественного спектрального анализа руд и минералов. М.: Недра, 1978. СОДЕРЖАНИЕ Введение………………………………………………………………………...…3 1 Аналитический обзор методов анализа силикатов…………………………...6 1.1 Отбор проб………………………….…………………………………..6 1.2 Выбор метода анализа…………………………………………………7 2 Методики анализа портландцемента………………………….……...…….13 2.1 Схемы систематического анализа цемента………………………….13 2.2 Определение влаги гравиметрическим методом……………………14 2.3 Определение оксида кремния………………………………………...15 2.4 Отделение гидроксидов железа и алюминия………………………..17 2.5 Определение оксида железа (III)……………………………......……18 2.6 Определение оксида алюминия комплексонометрическим методом………………………………………..………………………21 2.7 Определение оксидов кальция и магния комплексонометрическим методом……………………………………………………………….25 3 Обработка результатов………………………………………………………29 3.1 Определение влаги гравиметрическим методом……………………29 3.2 Определение оксида кремния……………………….………………..30 3.3 Определение оксида железа (III)……………………………......……31 3.4 Определение оксида алюминия………………………...……………32 3.5 Определение оксида кальция………………………………….……..32 3.6 Определение оксида магния…………………………..….…………..33 3.7 Сводная таблица результатов анализа……………………………….33 Заключение……………………………………………………………………….34 Литература……………………………………………………………………….35
ВВЕДЕНИЕ Силикаты – химические соединения, содержащие кремнезем SiO2. Природные силикаты важнейший класс минералов. Силикаты отличаются весьма разнообразным составом. В природных силикатах наряду с кремнеземом могут содержаться: Ti+4, Zr+3, Al+3, Cr+3, B+3, Fe+3, Fe+2, Ca+2, Mg+2, Ba+2, Mn+2, Na+, K+, Li+. В состав силикатов могут входить анионы О2-, OH-, F-, Cl-, CO32-, SO42-. Вода в силикатах содержится как в виде анионов OH, входящих в решетку (т.н. конституционная вода), так и в виде молекул H2O (кристаллизационная вода). Кроме того силикаты содержат адсорбированную на поверхности частиц воздух. Силикатные породы составляют 75% земной коры, а если учесть, что свободный кремнезем в виде кварца и опала составляет еще 12%, то окажется, что коло 87% земной коры слагают породы, которые являются сырьевым материалом для производства самой необходимой продукции. 1. Силикатные горные породы используются в технологических процессах, в которых применяются обжиг и плавка материала. Это производства: цемента (глины и мергели), шамота (глины и каолины), глазурей, стекол (полевые шпаты, нефелины, литиевые алюмосиликаты, циркон). При обжиге таких силикатов как вермикулиты, перлиты и ряда глинвозможно получить легковесные наполнители (керамзит, пенобетон). 2. Некоторые группы силикатов обрабатывают без отжига в таких областях техники как: в электроизоляционных производствах (слюды), при изготовлении термоизоляционных и кислостойких изделий (асбест), строительных материалов, труб (асбоцемент). Силикаты широко используются в качестве сорбентов для очистки технических и пищевых масс, осветления вин (бентонитов глины), очистки сточных вод, а также выхлопных газов от SO2 (цеолиты), в производстве резины (белая сажа, тальк), изготовления абразивов (твердые силикаты алюминия–гранаты). К силикатам относятся изумруд, топаз, турмалин, голубой аквамарин. 3. Силикатные твердые породы применяют как естественные строительные материалы (гранит). 4. Силикатные руды и материалы используются для извлечения материалов, оксидов солей: из лепидолита извлекается Li, из поллуцита – Cs, из бериллов – Be. Состав готовой продукции в зависимости от типа и назначения получаемых материалов различен. Однако в состав всех материалов входят одни и те же основные компоненты сырья – силикатные породы. Так в химический состав портландцемента (без добавок) входят следующие соединения (таблица 1). Таблица 1 – Химический состав портландцемента
Минералогический состав портландцемента представлен в таблице 2. Таблица 2 – минералогический состав портландцемента
Химический состав некоторых стекол приведен в таблице 3. Состав сырьевых материалов, поступающих на промышленные предприятия не постоянен. Содержание в них наиболее распространенных элементов кремния, железа, алюминия, кальция, магния колеблется в довольно широких пределах. Таблица 3 – Состав некоторых стекол (%)
Во избежание возможных нарушений технологического процесса и конечного химического состава готовых изделий все вновь поступающие партии сырьевых материалов на заводы, а также партии готовой продукции подвергаются химическому анализу. На основании аналит
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1427; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.013 с.) |

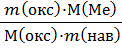 · 100. (1)
· 100. (1)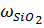 ) в процентах вычисляют по формуле
) в процентах вычисляют по формуле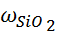 =
= 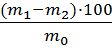 , (3)
, (3)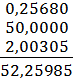
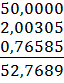
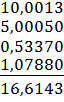

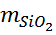 = 16,7067 – 16,6143 = 0,0924 г.
= 16,7067 – 16,6143 = 0,0924 г.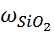 =
= 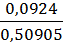 = 18,15 %.
= 18,15 %.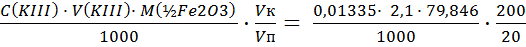 = 0,0223 г,
= 0,0223 г,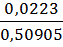 · 100 = 4,39 %.
· 100 = 4,39 %.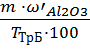 + 10 =
+ 10 = 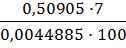 = 17,94 см3.
= 17,94 см3.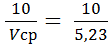 = 1,91
= 1,91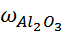 =
= 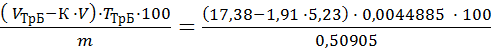 = 7,00%.
= 7,00%.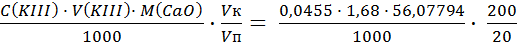 =0,0429 г.
=0,0429 г.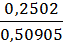 · 100 = 49,15 %.
· 100 = 49,15 %.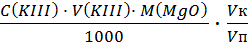 =
= 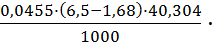
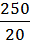 = 0,1105 г,
= 0,1105 г,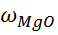 =
= 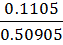
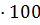 = 2,17 %.
= 2,17 %.


