
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекарственные средства, производные пиримидина
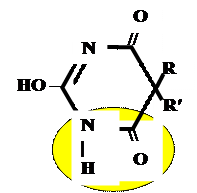
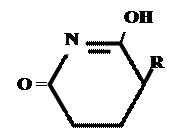
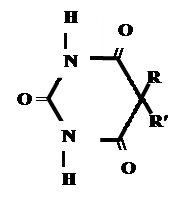
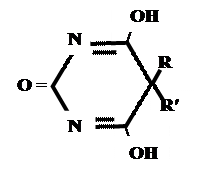
Лекарственные средства, производные барбитуровой кислоты. Общая характеристика Из синтетических соединений пиримидина в качестве ЛС широко применяются производные барбитуровой кислоты (гидроксипроизводного пиримидина), обладающие снотворным, противоэпилептическим и наркотическим действием. Барбитуровая кислота может существовать в нескольких таутомерных формах (характерна лактим-лактамная и кето-енольная таутомерия. 1. кетонный енольный фрагмент фрагмент
↔ \\ O
барбитуровая кислота Лактим-лактамная таутомерия
   
 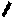 
 
↨ ↨
    
 фрагмент фрагмент фрагмент фрагмент фрагмент фрагмент
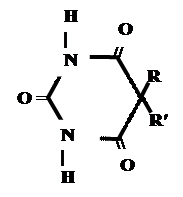
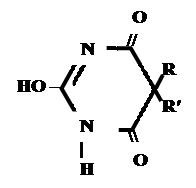
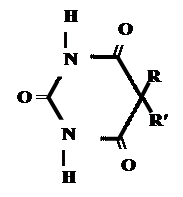
Для барбитуровой кислоты характерны кислотные свойства за счет подвижного атома водорода в 5-ом положении, а также в 1-ом и в 3-ем положениях. Производные барбитуровой кислоты содержат заместители при атоме углерода в 5-ом положении. Для них кето-енольная таутомерия невозможна, т.к. отсутствуют атомы водорода при атоме углерода в 5-ом положении.
 

 

 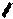 
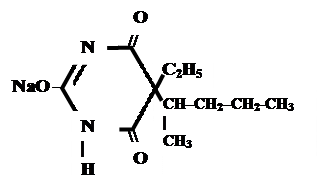
В медицине широко применяются барбитураты-кислоты (барбитал, фенобарбитал, бензонал и др.) и барбитураты-соли (барбитал-натрий, этаминал-натрий, гексенат, тиопентал-натрий и др.).
Физические свойства
Барбитураты-кислоты – Барбитал, Фенобарбитал- белые кристаллические порошки без запаха, нерастворимы в воде, р-рах щелочей, органических растворителях. Возгоняются при нагревании. Барбитураты-соли – Барбитал Na, Этаминал Na- растворяются в воде, плохо в органических растворителях. Разлагаются под действием влаги и углекислоты. Подлинность 1. сплавление с NaOH → выделяется NH3, который определяют по запаху или по посинению красной лакмусовой бумажки
to \ // + 5 NaOH → 2 NH3↑ + 2 Na2CO3 + CH – C / \ R′ ONa
Na2CO3 + 2 HCl → CO2↑ + 2 NaCl + H2O Пузырьки газа R O R O \ // \ // CH – C + HCl → NaCl + CH – C / \ / \ R′ ONa R′ OH 2. с солями тяжелых металлов
↔ + NaOH →
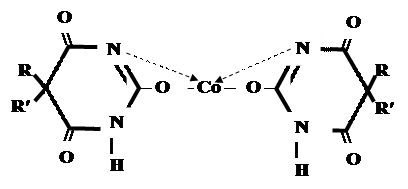
CaCl2 → + Co (NO 3)2 →
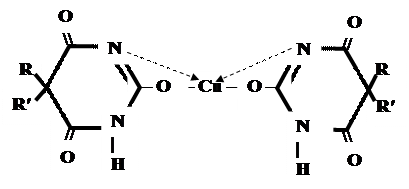
Б) Р-ция Романовой(выполняется в слабощелочной среде, т.к. в кислой среде комплекс разрушается). Р-ция отличия одного барбитурата от другого!
↔ + NaOH →
K2CO3 + KHCO3 → + CuSO 4 →
→
Барбитал – синее окрашивание, при стоянии красно-сиреневый осадок Фенобарбитал - бледно-сиреневый осадок Барбитал Na - синее окрашивание, при стоянии красно- сиреневый осадок Этаминал Na - голубой осадок В) с AgNO3 → серебряная соль
« + Na 2 CO 3 ®
+ AgNO 3 → + AgNO 3 → ↓ Однозамещенная соль Двузамещенная соль 3. выделение кислотной формы (барбитураты- соли)
toпл. 4. УФ спектр, ИК спектр 5. t плавления у барбитуратов- кислот 6. р-ции на Na для барбитуратов- солей
Количественное определение 1. Метод неводное титрование (для барбитуратов-кислот) Метод основан на усилении слабых кислотных св-в пр-та при растворении его в растворителе протогенного характера. Методика: Тн пр-та растворяют в ДМФА (диметилформамид) + индикатор тимоловый синий и титруют 0,1 н р-ром NaOH в смеси бензола и этанола до синего окрашивания
R R ДМФА O = ↔ + NaOH →
1 моль 1 экв. → + H 2 O fэкв. = 1 M1/z = М 2. Метод алкалиметрии, прямое титрование (д ля барбитуратов-кислот)
Метод основан на кислотных св-вах препарата за счет ациформы Методика: Тн пр-та растворяют в спирте + индикатор тимолфталеин и титруют 0,1 н р-ром NaOH до голубого окрашивания
↔ + NaOH → 1 моль 1 экв. → + H 2 O fэкв. = 1 M1/z = Mm 3. Метод ацидиметрии, способ прямого титрования (для барбитуратов-солей) Метод основан на гидролизе водных р-ров натриевых солей с выделением эквивалентного кол-ва Na, которое оттитровывают HCI. Методика: Тн пр-та растворяют в воде + м/о и титруют 0,1 н р-ром HCI до розового окрашивания.
+ HOH → ↓ + NaOH
NaOH + HCl → NaCl + H 2 O 1 моль 1 экв. fэкв. = 1 M1/z = М 4. Метод аргентометрии Метод основан на способности барбитуратов образовывать однозамещенные и двузамещенные серебряные соли.
+ Na2CO3 + А gNO3 ® - 2 NaNO3 - CO2 - H2O
1 моль 1 экв.
 + Na2CO3 + Na2CO3
+ AgNO3 → ↓ - 2 NaNO3 - CO2 - H2O
fэкв. = 1 M1/z = М
Б) с индикатором –хроматом калия – выполняют в присутствии буры и титруют АgNO3 до желто-оранжевого осадка
+ 2 А gNO 3 ® ↓ 2 AgNO 3 + K 2 CrO 4 → Ag 2 CrO 4 ↓ + 2 KNO 3 fэкв. = 1/2 M1/z = М/2
ФЭК, СФК, Гравиметрия БАРБИТУРАТЫ – КИСЛОТЫ
Свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Белые кристаллические порошки, б/з, слабо горького вкуса. Нерастворимы в воде, хорошо растворимы в спирте, в гидроксидах щелочных металлов, трудно растворимы в спирте, хлороформе. При нагревании возгоняются. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворим в кипящей воде | Трудно растворим в кипящей воде | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Подлинность | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. сплавление с NaOH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. растворение в спирте + NaOH 1% + CaCI2 + нитрат кобальта → сине-фиолетовое окрашивание | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. р-ция Романовой - NaOH 1% + KHCO3 + K2CO3 + CuSO4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| → синее окрашивание, при стоянии → красновато- сиреневый осадок | → бледно- сиреневый осадок | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. t плавления | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. УФ, ИК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. с вазелином и конц. H2SO4 при нагревании → вишневое →фиолетовое окрашивание | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. со смесью концентрированных кислот H2SO4 + HCI → желтое окрашивание | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Количественное определение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Метод неводного титрования (ГФ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Метод алкалиметрии, вариант вытеснения (экспресс) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Метод аргентометрии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Метод ФЭК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Метод СФК | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Применение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В больших дозах – снотворное, в малых - успокаивающее. | Обладает противосудорожной активностью за счет фенильного радикала | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Форма выпуска: субстанция | Субстанция, таблетки 50 и 100 мг, норма отпуска- 50 таблеток. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Хранение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Список Б | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В ХУТ | В ХУТ темного стекла | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
БАРБИТУРАТЫ – СОЛИ
| Барбитал-натрий Мединал | Этаминал-натрий Нембутал |
| Barbitalum-natrium Medinalum Barbital Sodium* | Aethaminalum-natrium Nembutalum |
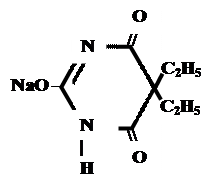
| 
|
| 5,5-диэтилбарбитурат натрия | 5-этил-5-(2-амил)-барбитурат натрия |
Свойства
Белые кристаллические порошки, без запаха, горького вкуса. Гигроскопичны, легко растворимы в воде. Водные растворы имеют щелочную среду 9-11. Не растворимы в органических растворителях.
Подлинность
1. р-ция сплавления с NaOH
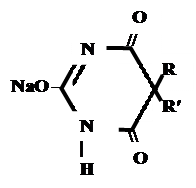
2. с солями тяжелых металлов, с Ca(NO)3 – общая р-ция – сине- фиолетовое окрашивание
3. р-ция Романовой- NaOH 1% + KHCO3 + K2CO3 + CuSO4
4. р-ция выделения кислотной формы с HCI
5. р-ции на катион Na
Количественное определение
1. Метод ацидиметрии, способ прямого титрования (ГФ и экспресс). Индикатор - м/о
Метод ФЭК
Метод аргентометрии
Применение
ФВ: инъекционные растворы, клизмы
Хранение
Список II. В ХУТ, в сухом месте, т. к гигроскопичны.
|
|
|
| Поделиться: |
Последнее изменение этой страницы: 2021-07-18; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.218.230 (0.106 с.)
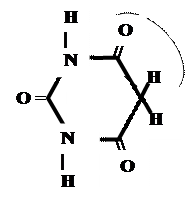
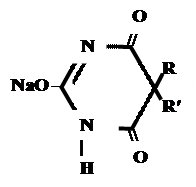
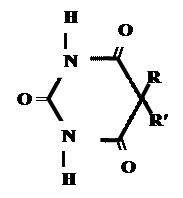
 Кето-енольная таутомерия
Кето-енольная таутомерия
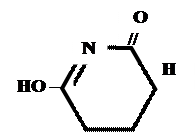
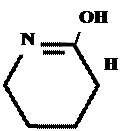


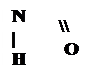

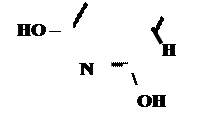
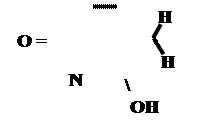


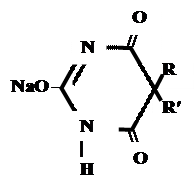
 Производные барбитуровой кислоты проявляют слабые кислотные свойства за счет лактимной формы.
Производные барбитуровой кислоты проявляют слабые кислотные свойства за счет лактимной формы.




 R O
R O А) Если барбитурат-кислота – сине-фиолетовое окрашивание
А) Если барбитурат-кислота – сине-фиолетовое окрашивание

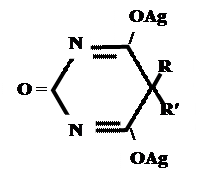
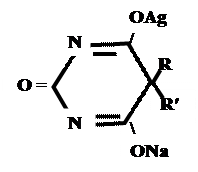


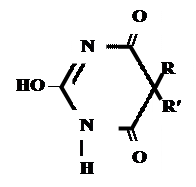
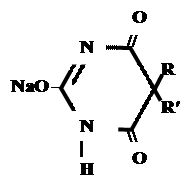


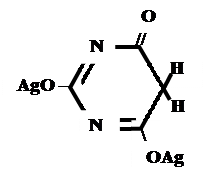
 А) без индикатора – выполняют в присутствии Na2CO3 и титруют АgNO3 до появления устойчивой мути
А) без индикатора – выполняют в присутствии Na2CO3 и титруют АgNO3 до появления устойчивой мути

 Barbital*
Barbital*
 Phenobarbital*
Phenobarbital*



