
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекарственные средства, производные пиразолаСодержание книги
Поиск на нашем сайте
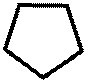
Для медицины представляют интерес кето-произодные пиразолина и пиразолидина O
N - H N - H // // O N O N | | H H пиразолон -5 пиразолидиндион -3,5
К 1-ой группе относятся антипирин и анальгин, оказывающие жаропонижающее и болеутоляющее действие. Ко 2-ой группе относится бутадион, оказывающий противовоспалительное действие.
Антипирин Antipirynum Phenazone *
N – CH 3 // O N | C 6 H 5 1-фенил-2,3-диметилпиразолон-5 Свойства Бесцветные кристаллы или белый кристаллический порошок, без запаха. Легко растворим в воде, спирте, хлороформе. Трудно растворим в эфире. Получают синтетически.
Подлинность 1. с FeCl3 → комплекс Феррипирин, Феррифеназол красного цвета
3 Ant • 2 FeCl 3 2. с NaNO2 и H2SO4 → нитроантипирин изумрудно- зеленого окрашивания 2 NaNO2 + H2SO4 → 2 HNO2 + Na2SO4
N –CH3 + HNO2 → N – CH3 + H2O // // O N O N | | C6H5 C6H5
3. с α- нафтолом → индофеноловый краситель красно- фиолетового цвета 4. t плав 5. УФ
Количественное определение Метод йодометрии, способ обратного титрования. Метод основан на способности атома водорода в 4 положении замещаться на галоген. Методика: Тн пр-та растворяют в воде + избыток 0,1 н р-ра йода + ацетат натрия (для связывания HI, т.к в ней растворяют осадок йодопирина) + разведенную уксусную к-ту (для подавления гидролиза ацетата натрия, т.к гидролизная щелочь может взаимодействовать с йодом) + хлороформ (для растворения осадка йодопирина, т.к он может адсорбировать на себе йод из раствора). Остаток йода оттитровывают 0,1 н р-ром тиосульфата натрия с индикатором крахмалом до обесцвечивания.
N –CH3 + I2 → N – CH3 + HI // // O N O N | | C6H5 C6H5 1 моль 2 экв.
HI + CH3COONa → CH3COOH + NaI I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 f экв. = 1/2 M 1/ z = М/2
Применение Жаропонижающее, болеутоляющее, противовоспалительное. Форма выпуска: таблетки, субстанция.
Хранение Список Б. В ХУТ темного стекла, т.к светочувствителен из-за фенильного радикала. N. B.! При приготовлении ЛФ по рецептам необходимо учитывать способность антипирина реагировать с кислотами, фенолами, альдегидами, солями ртути, реагируя с которыми антипирин может переходить в жидкое состояние. Анальгин Analginum Metamizol Sodium*
NaO 3 S – CH 2 N – CH 3 // 1-фенил-2,3-диметил-4-метиламинопиразолон- O N -5- N -метансульфонат натрия | C 6 H 5 Свойства Получают синтетически. Белый или белый с едва заметным желтым оттенком, без запаха, горьковатого вкуса. Легко растворим в воде, трудно в спирте, нерастворим в органических растворителях. Водные растворы при стоянии желтеют (т.к. есть сера в 4 положении). Обладает восстановительными свойствами (окисляется).
Подлинность 1. Ионы натрия – «сухим путем» → окрашивание пламя горелки в желтый цвет; с пикриновой к-той → желтые игольчатые кристаллы. 2. Специфическая реакция на остаток метансульфоната натрия (не ГФ)
/ to / NaO3S – CH2 N –CH3 + HCl → H N – CH3 + // // O N O N | | C6H5 C6H5 О // + SO2 ↑ + H – C = Н ↑ + NaCl
HOOC – – H || H – – COOH H2SO4 + H – C – H + → HO – – OH
→ → HO – – OH
→ HO – = O
Красное окрашивание
3. по ГФ - с KIO3 (с йодатом калия) вода + спирт + НСI + KIO3, добавляем по каплям → малиновое окрашивание + бурый осадок перйодина
4. с р-ром пероксида водорода → слегка голубоватый р-р, который исчезает и через некоторое время буреет.
5. t плавления, УФ, ИК спектр
Экспресс-анализ 1. с FeCI 3 → синее, исчезающее окрашивание 2. с NaNO 2 → зеленовато- синее, исчезающее окрашивание 3. с р-ром хлорной извести → голубое, зеленое, желтое.
Количественное определение Метод йодометрии, способ прямого титрования Метод основан на восстановительных свойствах препарата, за счет атома серы со степенью окисления +4.
H \ +
/ / NaO3S – CH2 N –CH3 + I2 +2 H2O→ H N – CH3 I + // // O N O N | | C6H5 C6H5 1 моль 2 экв. О // + NaHSO4 + H – C = O + HI
f экв. = 1/2 M 1/ z = М/2
Применение Жаропонижающее, противовоспалительное, болеутоляющее. ФВ: субстанция, ампульные растворы, таблетки, комбинированные препараты.
Хранение Список Б. В ХУТ темного стекла, в защищенном от света и влаги месте. Препарат светочувствителен, гидролизуется. Бутадион Butadionum Phenylbutazone *
C 4 H 9 – = O
N – C 6 H 5 // 1,2-дифенил -4-бутилпиразолидиндион- 3,5 O N | C 6 H 5
Свойства Белый или белый со слегка желтоватым оттенком порошок. Практически нерастворим в воде, легко растворим в хлороформе, эфире, ацетоне. Препарат обладает кислотными свойствами, хорошо растворяется в щелочах за счет подвижного атома водорода в 4 положении, образуя ациформу (енольную форму).
C4H9 – = O C4H9 – – OH
N – C6H5 ↔ N – C6H5 // // O N O N | | C6H5 C6H5
N – C6H5 + NaOH → N – C6H5 + H2O // // O N O N | | C 6 H 5 C 6 H 5 Подлинность 1. с 0,1 н р-ром NaOH → сероватый → бледно- голубой
C4H9 – – O C4H9 – – ONa
N – C6H5 + NaOH → N – C6H5 + H2O // // O N O N | | C6H5 C6H5
C4H9 – – ONa C4H9 – – O-
2 N – C6H5 + CuSO4 → N – C6H5 Cu ↓ // - Na2SO4 // O N O N | | 2 C6H5 C6H5 2.р - ция окисления после гидролитического разложения пр-та с кристаллическим нитритом натрия и концентрированной серной кислотой → вишнево- красное окрашивание
C4H9 – = O + H2SO4 + NaNO2 [O] N – C6H5 → NH – NH → N = N // | | | | O N C6H5 C6H5 C6H5 C6H5 | C 6 H 5
3. t плавления, УФ спектр.
Экспресс-анализ 1. с AgNO3 → белый осадок 2. с FeCI3 → бурый осадок 3. с р-ром хлорамина → розовато- фиолетовое окрашивание 4. с K2Cr2O7 + H2SO4 → темно- красное окрашивание
Количественное определение
|
||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.009 с.) |

 //
//  1. 2.
1. 2.  Н – - CH 3
Н – - CH 3  Н – -CH3 O = N – – CH3
Н – -CH3 O = N – – CH3  Н – -CH3 I – – CH3
Н – -CH3 I – – CH3  CH3 – N – -CH3
CH3 – N – -CH3  /
/  CH3 – N – -CH3 CH3 – N – – CH3
CH3 – N – -CH3 CH3 – N – – CH3  O
O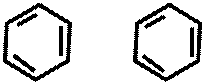 HOOC – – CH2 – – COOH H2SO4
HOOC – – CH2 – – COOH H2SO4  HOOC – – CH = – COOH
HOOC – – CH = – COOH  Методика: Тн пр-та растворяют в спирте (подавление гидролиза натриевой соли) + разведенную НСI до полного растворения навески и титруют 0,1 н р-ром йода без индикатора до появления желтой окраски, неисчезающей в течении 30 секунд.
Методика: Тн пр-та растворяют в спирте (подавление гидролиза натриевой соли) + разведенную НСI до полного растворения навески и титруют 0,1 н р-ром йода без индикатора до появления желтой окраски, неисчезающей в течении 30 секунд. CH3 – N – -CH3 CH3 – N – – CH3
CH3 – N – -CH3 CH3 – N – – CH3 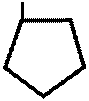 H
H H
H C4H9 – – OH C4H9 – – ONa
C4H9 – – OH C4H9 – – ONa H
H
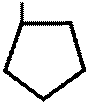 H
H


