
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекарственные средства, производные лактонов ненасыщенных полиоксикарбоновых кислот
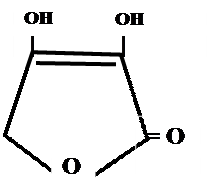
Кислота аскорбиновая Acidum ascorbinicum Vitaminum C Ascorbic acid *
H | HO – CH | CH 2 - OH γ-лактон-2,3-дегидро-L-гулоновой кислоты Свойства Белый кристаллический порошок, без запаха, кислого вкуса. Легко растворим в воде, спирте, нерастворим в эфире, хлороформе, бензоле. Водные растворы имеют кислую реакцию. На свету легко окисляются и желтеют в присутствии металлов.
1. кислотные св-ва → замещение на металл
+ NaOH → + Н2О
→
ендиольная форма кето-форма аскорбиновая к-та дегидроаскорбиновая к-та Подлинность 1. t плавления 2. УФ спектр 3. ИК 4. окисление с AgNO3
+ 2 AgNO3 → + 2 Ag↓ + 2 HNO3
5. обесцвечивание р-ра йода
+ I2 → + HI
Экспресс-анализ 1. с FeCl3 → обесцвечивание
+ 2 FeCl3 → + 2 FeCl2 + 2 HCl
2. с KMnO4 → обесцвечивание
+ KMnO4 → + Mn2+
3. образование индофенолового красителя → бесцветный
+ O N OH→ + Cl синий
+ HO NH OH Cl Бесцветный
4. с р-вом Фелинга → кирпично- красный
t0 + 2 HC – O → + Cu2O↓ + HC - OH \ | Cu HC -OH / |
HC – O COOK | COOK
5. с р-вом Толленса → серебряный налет
6. с р-вом Несслера → осадок ртути.
+ K2[HgI4] + 2 KOH → + Hg↓ + 4 KI + 2 H2O
(Реакции 5,6,7 – их нельзя использовать, если есть глюкоза) 7. р-ция образования берлинской лазури → синее окрашивание. Эту реакцию следует выполнять в присутствии рибофлавина.
2 + 4 K3[Fe(CN)6] → 2 + 3 К4[Fe(CN)6] + H4[Fe(CN)6]
3 К4[Fe(CN)6] + 4 FeCl3 → Fe4[Fe(CN)6]3 + 12 КCl
Количественное определение По ГФ Метод йодатометрии, способ прямого титрования Метод основан на восстановительных свойствах пр-та за счет ендиольной группировки. Методика: Тн пр-та растворяют в воде + разведенная HCI + р-р KI + крахмал, титруют 0,1 н р-ром КIО3 до слабо синего окрашивания.
3 + КIО3 → 3 + КI + 3 Н2О 1 моль 1 экв.
KIO3 + 5 KI + 6 HCl → I2 + 6 KCl + 3 H2O fэкв = 1 М1/z = М Экспресс-анализ Метод йодометрии, способ прямого титрования Метод основан на восстановительных свойствах препарата за счет ендиольной группировки. Методика: Тн пр-та растворяют в воде + разведенная HCI и титруют 0,1 н р-ром йода до желтого окрашивания.
(NB! При титровании растворов аскорбиновой кислоты для инъекций следует учитывать восстановительную способность стабилизатора – гидросульфита натрия – поэтому перед началом титрования к такому раствору добавляют формалин, который будет связывать стабилизатор.) (NaHSO3 + HCOH → HO-CH2- O-SO2Na)
+ I2 → + HI 1 моль 1 экв. fэкв = 1 М1/z = М
Метод алкалиметрии, прямое титрование Метод основан на кислотных свойствах препарата за счет подвижного атома водорода в третьем положении. Методика: Тн пр-та раств в воде + ф/ф и титруют 0,1 н р-ром NaOH до слабо розового окрашивания.
моль экв.
fэкв = 1 М1/z = М Применение Профилактика, лечение цинги, инфекционные заболевания, интоксикации, авитаминоз.
Хранение В ХУТ, в защищенном от света месте.
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 61; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.214.215 (0.013 с.) |
 ОН ОН ОNa ОН
ОН ОН ОNa ОН ОН ОН [O] О О
ОН ОН [O] О О ОН ОН О О
ОН ОН О О ОН ОН О О
ОН ОН О О ОН ОН Cl О О
ОН ОН Cl О О Cl
Cl ОН ОН COONa О О COONa
ОН ОН COONa О О COONa






 + 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O
+ 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O  ОН ОН О О
ОН ОН О О


 + NaOH → + Н2О
+ NaOH → + Н2О


