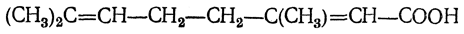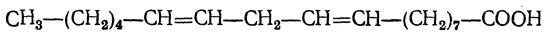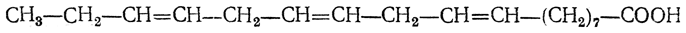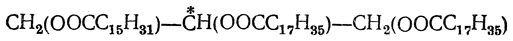Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислоты с двумя и тремя двойными связямиСодержание книги
Поиск на нашем сайте
Из кислот этого ряда уже была упомянута гераниевая кислота
Эта кислота при действии 65—70%-ной серной кислоты легко переходит в циклическую циклогераниевую кислоту. Наибольший интерес и здесь представляют кислоты с 18 атомами углерода, которые в виде эфиров глицерина находятся в так называемых высыхающих маслах, например в льняном, конопляном, маковом. Из таких кислот в конопляном, а также в льняном масле содержится линолевая кислота С17Н31СООН с двумя изолированными двойными связями:
Эта кислота присоединяет две молекулы брома, при окислении перманганатом в щелочной среде дает тетраоксистеариновую кислоту, а при восстановлении переходит в стеариновую кислоту. Линолевая кислота имеет т. пл. —11° С, т. кип. 230° С (при 16 мм рт. ст.), d 420 =0,9025. В льняном масле содержится много линоленовой кислоты (более 50% от общего количества жирных кислот). Это — кислота с тремя изолированными двойными связями:
Природная линоленовая кислота представляет собой смесь цис - транс -изомеров. Главную ее массу составляет цис-цис-цис- кислота (α-линоленовая кислота, т. пл. —11° С, т. кип. 232° С, d 420=0,905); выделить из льняного масла другие геометрические изомеры в чистом виде пока не удалось. Синтетическая транс-транс-транс-линоленовая кислота плавится при 29—30° С. Жиры Природные животные и растительные жиры и масла состоят главным образом из глицеридов (сложные эфиры глицерина и различных органических кислот). При этом все жиры (в отличие от восков) содержат в качестве непременной составной части глицерин, входящие же в их состав жирные кислоты весьма разнообразны. Так, в состав разных жиров входят предельные жирные кислоты от С4 до С24, ненасыщенные кислоты с одной двойной связью, с тройной связью (см. таририновая кислота); в состав высыхающих масел и ворваней входят также кислоты с несколькими двойными связями. Из предельных кислот, кроме главнейших — пальмитиновой С15Н31СООН и стеариновой С17Н35СООН, в состав жиров и масел наиболее часто входят кислоты: лауриновая C11H23COOH (особенно много в лавровом масле), миристиновая С13Н27СООН (в мускатном масле) и бегеновая С21Н43СООН (в масле репы и в масле земляного ореха). Из кислот с этиленовой связью, кроме олеиновой С17Н33СООН, содержатся также гексадеценовая С21Н43СООН, гадолеиновая C19H37COOH и эруковая С21Н41СООН В касторовом масле содержится ненасыщенная оксикислота С17Н32(ОН)СООН — рицинолевая (рицинолеиновая)и насыщенная диоксистеариновая кислота С17Н33(ОН)2СООН. В качестве составных частей некоторых жиров были найдены и ненасыщенные циклические кислоты. Интересно, что в жирах содержатся преимущественно высшие жирные кислоты с четным числом атомов углерода в молекуле. Кислоты с нечетным числом атомов углерода содержатся в жирах лишь в незначительных количествах и в редких случаях. Большая часть глицеридов в природных жирах представляет собой полные эфиры (трипальмитин, тристеарин, триолеин и т. д.). Однако, например, в масле репы найден диглицерид эруковой кислоты — диэруцин С3Н5(ОН)(OOCC21H41)2. Главную составную часть жиров, по-видимому, составляют простые триглицериды, но из некоторых жиров были выделены в чистом виде и смешанные триглицериды, например олеодистеарин C3H5(OOCC17H33)(OOCC17H35)2. Наличием смешанных глицеридов объясняется оптическая деятельность некоторых природных жиров. В оптически изомерных формах могут существовать такие полные глицериды, в состав которых входит не менее двух различных кислотных остатков, как, например:
Для многих глицеридов характерно наличие двух температур плавления, т. е. они плавятся при определенной температуре, а при дальнейшем нагревании затвердевают и затем снова плавятся. Так, трипальмитин плавится при 45 и 65° С, а тристеарин — при 55 и 72° С. Жиры были впервые получены синтетически Бертело (1854) нагреванием глицерина с жировыми кислотами. Позднее их получил Вюрц (1859), нагревая трибромпропан с серебряными солями (мылами) жировых кислот:
Аналогичным образом из моно- и дигалоидгидринов глицерина были получены моно- и диглицериды. Омылением жиров получаются глицерин и органические кислоты. Практически омыление жиров производят или перегретым паром, или же нагревая их в присутствии серной кислоты или щелочей (едких щелочей или гашеной извести). В последнем случае получаются не свободные кислоты, а их соли (мыла). Превосходными катализаторами омыления жиров являются сульфокислоты, получаемые сульфированием смеси непредельных жирных кислот с ароматическими углеводородами (так называемый реактив Твитчела), а также при очистке нефти концентрированной серной кислотой (контакт Петрова). Действие этих реактивов основано, в частности, на том, что они эмульгируют жиры, благодаря чему получается большая поверхность соприкосновения с омыляющей водной жидкостью. В семенах клещевины находится особый энзим — рициназа, обладающий способностью сильно ускорять каталитически омыление жиров (и вообще сложных эфиров). Применение рициназы для омыления жиров также нашло применение в технике. Омыление жиров идет не сразу, а постепенно, так что, например, при омылении тристеарина получается сначала дистеарин, затем моностеарин, и наконец, глицерин и стеариновая кислота. Классические исследования процесса омыления жиров (1811—1823) принадлежат Шеврёлю. При переваривании жиров в пищеварительном тракте животных жиры омыляются под влиянием энзима поджелудочной железы, причем образуются глицерин и кислоты. В организме животных из этих веществ снова синтезируются жиры. При продолжительном хранении многие природные жиры под влиянием воздуха и света приобретают неприятный вкус и запах — «прогоркают». При этом из ненасыщенных кислот получаются кетоны и летучие кислоты (масляная кислота) и их альдегиды. Кроме употребления в пищу, жиры в значительном количестве применяются в мыловарении, а также в медицине и для приготовления косметических средств. Так называемые «высыхающие» масла, содержащие глицериды ненасыщенных кислот с двумя или тремя этиленовыми связями, служат для приготовления олифы и масляных красок. Для приготовления олифы к маслам прибавляют «сиккативы», т. е. вещества, каталитически ускоряющие окисление ненасыщенных жиров. Обычно это соединения свинца (глет, сурик) или марганца (пиролюзит и др.). Ввиду недостатка твердых жиров для мыловарения большое техническое значение приобрело превращение жидких масел и ворвани в твердые жиры, известные под различными названиями (салолин, саломас и др.). Это превращение осуществляется путем присоединения водорода к этиленовым связям (гидрогенизация жиров)под влиянием таких катализаторов, как металлический никель или окись никеля, причем олеин и другие ненасыщенные жиры переходят в насыщенный твердый стеарин. Способ каталитической гидрогенизации жиров впервые разработал (1906) и осуществил в промышленном масштабе (1909) русский ученый С. А. Фокин. В природных жирах часто содержатся примеси одноатомных высокомолекулярных спиртов и почти всегда в качестве примесей имеются циклические ненасыщенные спирты С27Н45ОН — холестерины и фитостерины. Иногда встречаются также и примеси ненасыщенных и насыщенных углеводородов. В некоторых жирах содержится примесь лецитинов. Вопросы для самоконтроля: 1. Номенклатура непредельных алкилгалогенидов, кислот жирного ряда. 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
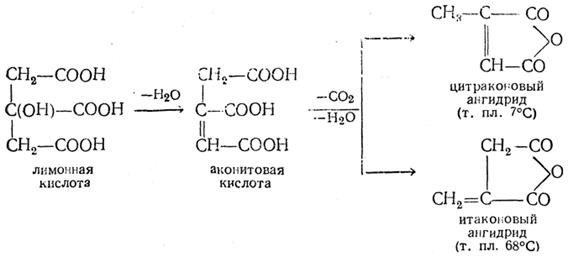
Лекция № 27-28. Дикарбоновые кислоты. Оксикарбоновые кислоты и оптическая изомерия. Цель: ознакомиться с номенклатурой, методами получения, физическими и химическими свойствами, механизмом реакций дикарбоновых кислот, оксикарбоновых кислот Основные вопросы: 1. Предельные дикарбоновые кислоты 2. Непредельные дикарбоновые кислоты 3. Изомерия и номенклатура оксикарбоновых кислот 4. Оптическая изомерия Краткое содержание. Двухосновные кислоты При быстром нагревании лимонной кислоты С5Н6О4 перегоняется смесь ангидридов итаконовой и цитраконовой кислот. Реакция объясняется промежуточным образованием аконитовой кислоты:
Итаконовая кислота плавится при 163° С. Цитраконовая кислота (т. пл. 91° С) легко превращается в мезаконовую (т. пл. 240,5°С), отношения которой к цитраконовой вполне тождественны отношениям малеиновой кислоты к фумаровой. Поэтому цитраконовой кислоте приписывают конфигурацию цис -кислоты (метилмалеиновой), а мезаконовой — конфигурацию транс -кислоты (метилфумаровой):
|
||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.153.110 (0.006 с.) |