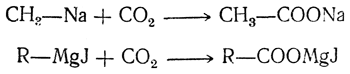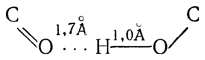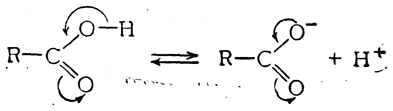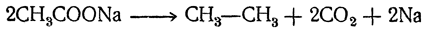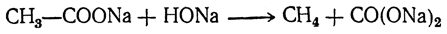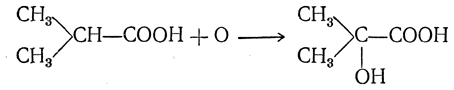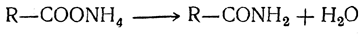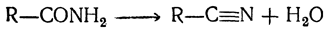Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
VII. Качественные реакции на альдегиды
Для открытия альдегидов имеются очень чувствительные цветные реакции. Наиболее употребительным реактивом на альдегиды является «фуксинсернистая кислота» (раствор фуксина, обесцвеченный прибавлением сернистой кислоты), дающая даже с небольшими количествами альдегидов красное или фиолетовое окрашивание. Для этой же цели применяют диазобензолсульфокислоту, дающую с альдегидами в щелочном растворе при прибавлении нескольких зерен амальгамы натрия фиолетово-красное окрашивание. При действии на альдегиды натриевой соли нитрогидроксиламина в водных растворах получаются гидроксамовые кислоты
дающие с хлорным железом интенсивное красное окрашивание (реакция Анджели на альдегиды). Вопросы для самоконтроля: 1. Номенклатура альдегидов и кетонов 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
Лекция № 22-23. Монокарбоновые кислоты Цель: ознакомиться с номенклатурой, методами получения, физическими и химическими свойствами, механизмом реакций монокарбоновых кислот. Основные вопросы: 1. Электронное строение карбоксильной группы. 2. Изомерия, номенклатура 3. Лабораторные и промышленные методы получения 4. Физические и химические свойства Краткое содержание. Органические кислоты, кислотные свойства которых связаны с присутствием в молекуле одновалентного радикала карбоксила
называются карбоновыми кислотами. По числу карбоксилов в молекуле различают кислоты одноосновные, двухосновные и многоосновные. Предельные жирные кислоты можно рассматривать как производные парафиновых углеводородов, происшедшие в результате замещения атома водорода на карбоксил. Таким образом, общая формула этих кислот C n' H2 n' +1—СООН, или C n H2 n O2 (принимая п = п' + 1). Следовательно, число изомеров жирных кислот (как и альдегидов) будет совпадать с числом изомеров, например, галоидных соединений и спиртов, содержащих в молекуле на один атом углерода меньше, чем кислота.
Если производить кислоты от парафиновых углеводородов, то первым членом этого ряда являлась бы кислота строения СН3—СООН, т. е. метанкарбоновая, или уксусная, кислота. Однако аналогично некоторым другим случаям в качестве первого члена этого ряда рассматривают муравьиную кислоту Н—СООН, представляющую собой соединение карбоксила с водородом. Высшие кислоты можно также рассматривать как производные уксусной кислоты — продукты замещения атомов водорода в метиле на алкильные группы. Тогда пропионовую, или этанкарбоновую, кислоту СН3—СН2—СООН можно назвать метилуксусной кислотой, изомасляную (СН3)2СН—СООН — диметилуксусной кислотой и т. д. По женевской номенклатуре, названия кислот производятся от названий углеводородов с тем же числом атомов углерода, с прибавлением слова кислота, обозначающего наличие в молекуле карбоксила. Таким образом, муравьиная кислота называется метановой кислотой, уксусная — этановой кислотой, кислота строения
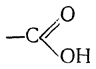
3 -метилбутановой кислотой и т. д. Наиболее употребительными являются более или менее случайные названия кислот, связанные с каким-либо из источников их получения или с местонахождением в природе; эти названия приведены в табл. 10. При действии щелочей карбоновые кислоты образуют соли, причем экспериментально установлено, что в карбоксильной группе соли, как и в карбоксильной группе кислоты, оба кислородных атома равноценны; так, например, в формиате натрия угол между связями О—С—О равен 124 ±4°, а оба расстояния С—О равны и составляют 1,27 Å. Поэтому строение солей карбоновых кислот может быть изображено формулой:
(кривыми стрелками показано направление смещения электронной плотности в результате взаимного влияния атомов). Способы получения 1. Окисление органических веществ. Одноосновные жирные кислоты получаются в результате окисления всевозможных органических веществ. В большинстве случаев при этом происходит расщепление молекулы, и получающиеся кислоты содержат в молекуле меньше атомов углерода, чем исходное окисляемое вещество. Лишь при окислении производных с первичными радикалами (например, первичных спиртов, стр. 209), а также при окислении альдегидов получаются кислоты с тем же числом атомов углерода в молекуле.
2. Действие двуокиси углерода на металлоорганические соединения (реакция карбонирования). Чаще всего для этой реакции применяются натрийорганические соединения (Ванклин) и смешанные магнийорганические соединения (Гриньяр):
В первом случае получаются натриевые соли органических кислот, во втором — смешанные магниевые соли органической и галоидоводородной кислот; при действии на последние водой и минеральной кислотой получаются жирные кислоты:
3. Омыление цианистых соединений, или нитрилов кислот. Например:
Приведенные три способа получения карбоновых кислот являются хорошим доказательством строения радикала карбоксила. 4. Декарбоксилирование двух- и трехосновных кислот. Одноосновные карбоновые кислоты получаются нагреванием двухосновных (и трехосновных) кислот, у которых два (или три) карбоксила находятся при одном и том же атоме углерода:
Этим способом можно из малоновой кислоты СН2(СООН)2 и ее гомологов
получить уксусную кислоту и ее высшие гомологи (кроме гомологов, являющихся продуктами замещения всех трех атомов водорода метильной группы уксусной кислоты на углеводородные радикалы). Аналогичным образом может декарбоксилироваться также и щавелевая кислота НООС—СООН, образуя муравьиную кислоту. 5. Обмен заместителей в предельных кислотах на водород. Жирные кислоты могут быть получены, например, восстановлением галоидзамещенных кислот:
6-7. Синтез одноосновных кислот при помощиацетоуксусного эфира. Получение из производных. Карбоновые кислоты могут быть получены из органических веществ всех тех классов, которые объединяются под общим названием «производные органических кислот». Физические свойства Низшие члены ряда жирных кислот представляют собой при обыкновенной температуре подвижные жидкости с острым кислотным запахом, способные кристаллизоваться при охлаждении; с водой они смешиваются во всех отношениях. Начиная с масляной (также изомасляной) кислоты, это — ограниченно растворимые в воде маслянистые жидкости с неприятным запахом. Высшие кислоты — вещества твердые, в воде нерастворимые. Все жирные кислоты растворимы в спирте и эфире. Плотности низших членов ряда больше единицы; с повышением молекулярного веса плотность уменьшается. Низшие кислоты легко перегоняются как сами, так и вместес водяным паром, и называются поэтому летучими жирными кислотами. Правильности в повышении температур кипения кислот те же, что и в других гомологических рядах. У средних гомологов нормального строения соблюдается своеобразная правильность в отношении температуры плавления, наблюдаемая и для некоторых других классов органических веществ: при общем повышении температуры плавления с увеличением молекулярного веса температуры плавления четных гомологов выше, чем температуры плавления ближайших нечетных гомологов, содержащих в молекуле на один атом углерода больше и меньше (см. табл. 10). Определения молекулярного веса кислот криоскопическим методом в некоторых растворителях (в бензоле или хлороформе), а также определение плотности паров, например уксусной кислоты, показывают, что кислоты образуют молекулы состава (С n Н2 n О2)2 с удвоенным против формулы строения молекулярным весом.
Образование ассоциированных молекул, наблюдаемое у многих гидроксилсодержащих соединений, объясняется возникновением так называемых водородных связей, причем образуются лабильные циклические или линейные (главным образом димерные) структуры. Например, для уксусной кислоты:
Энергия такой водородной связи составляет ~7 ккал/моль (энергия ковалентной связи О—Н составляет 110 ккал/моль). При сочетании двух молекул кислоты, например уксусной, в циклический димер образуются две такие связи и выделяется ~14 ккал/моль. Расстояния между атомами кислорода и атомом водорода составляют:
Из этого можно сделать вывод, что водород преимущественно связан с одним атомом кислорода. Аналогичным образом осуществляется ассоциация молекул и других гидроксилсодержащих соединений. Жирные кислоты
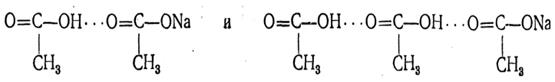
При солеобразовании водородные связи, как правило, разрываются, но иногда часть из них сохраняется; тогда получаются кислые соли, например:
Химические свойства 1. Кислотные свойства. Уже в спиртах гидроксильный (т. е. связанный с кислородом) атом водорода обладает способностью замещаться такими энергичными металлами, как калий и натрий. Однако кислотные свойства спиртового гидроксила слишком слабы, и алкоголяты разлагаются водой на спирт и едкую щелочь. Алкоголи являются настолько слабыми кислотами, что даже с самыми чувствительными индикаторами не показывают кислой реакции. В карбоксиле кислотные свойства гидроксильного водорода чрезвычайно усиливаются, и карбоксильная группировка сообщает веществу отчетливо выраженные кислотные свойства (монокарбоновые кислоты имеют обычно константу диссоциации порядка 10–4—10–5). Это обусловливается двумя причинами. С одной стороны, электронная плотность смещается в направлении обладающего большим электроносродством электрофильного заместителя — кислорода карбонильной группы. Тем самым ослабляется связь между водородом и гидроксильным кислородом и облегчается удаление атома водорода в виде протона, т. е. равновесие диссоциации
смещается вправо. В алифатических спиртах нет электрофильного заместителя, подобного карбонильному кислороду. Поэтому, хотя в спиртах водород гидроксильной группы может замещаться на металл, они все же являются даже более слабыми кислотами, чем вода (константы диссоциации спиртов меньше 10–14).
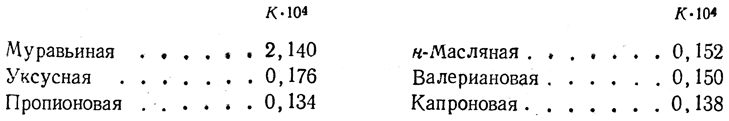
Таким образом, на примере кислот обнаруживается влияние на атом водорода кислородного атома, связанного с ним не непосредственно, а лишь через посредство атома углерода. Однако, с другой стороны, на кислотность карбоксильной группы оказывают влияние также и радикалы, с ней связанные. Так, константы электролитической диссоциации, которые являются мерой силы кислот, для первых членов ряда жирных кислот имеют следующие величины:
Эти данные показывают, что все жирные кислоты, за исключением муравьиной, которая является кислотой средней силы, представляют собой довольно слабые кислоты. Соли их со щелочными металлами в водных растворах сильно гидролизованы и имеют щелочную реакцию. 2. Электролиз жирных кислот и их солей. В водных растворах кислоты и их соли диссоциируют на катионы водорода или металла и анионы жирных кислот R—СОО–. Последние, теряя на аноде заряд, могут распадаться на СО2 и алкил R, после чего благодаря соединению двух алкилов обычно образуются углеводороды парафинового ряда R—R (реакции Кольбе), например:
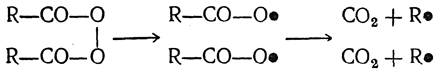
Как показал Фихтер, при электролизе солей органических кислот на аноде промежуточно образуются перекиси кислот:
которые при подходящих условиях могут быть обнаружены. Эти перекиси расщепляются на радикалы, в свою очередь распадающиеся далее на СО2 и алифатические радикалы:
При достаточно большой плотности тока на аноде образовавшиеся алифатические радикалы димеризуются в предельные углеводороды R—R, а при малых плотностях тока стабилизуются с образованием, наряду с другими продуктами, углеводородов R—Н и непредельных углеводородов. Эта схема не объясняет, однако, всех особенностей электролиза солей жирных кислот. Так, если при электролизе на аноде выделяется кислород (например, при прибавлении к электролиту сульфата натрия), то алкилы окисляются в соответствующие спирты:
3. Образование предельных углеводородов при сплавлении солей со шелочами. Сплавлением соли щелочного металла с едкой щелочью можно получить па- рафиновый углеводород с меньшим числом атомов углерода в молекуле:
4. Образование альдегидов и кето нов. Перегонкой кальциевых солей жирных кислот получаются кетоны, а из смесей, содержащих муравьинокислый кальций, — альдегиды. Альдегиды и кетоны получаются также при пропускании паров жирной кислоты или смеси жирной кислоты с муравьиной кислотой над некоторыми солями или окислами металлов. 5. Действие галоидов. При действии галоидов на кислоты происходит замещение на галоид водорода в алкилах и получаются галоидзамещенные кислоты, например:
Полученная монохлорзамещенная кислота реагирует дальше с хлором вплоть до образования кислоты СCl3—СООН. Очень часто действуют галоидом не на кислоту, а на ее галоидангидрид или ангидрид (способ Зелинского—Геля—Фольгарда), например:
При этом легко замещаются на галоид лишь те атомы водорода, которые связаны с атомом углерода, соседним с карбоксильной группой. Это объясняется смещением электронной плотности под влиянием карбоксильной группы:
В результате происходит ослабление связей С—Н и α-атомы водорода становятся более подвижными. 6. Действие галоидных соединений фосфора. При действии галоидных соединений фосфора на кислоты происходит замена гидроксила на галоид и получаются галоидангидриды кислот. Как и при замещении на галоид спиртового гидроксила, можно действовать пятигалоидными или трехгалоидными соединениями фосфора, а также соединениями типа хлорокиси фосфора:
Аналогично реагируют с кислотами некоторые галоидные соединения серы (SOCl2, SO2Cl2). 7. Действие окислителей. Окислители в большинстве случаев лишь с трудом реагируют с жирными кислотами, причем под их действием происходит разрушение молекулы кислоты. Однако разбавленная перекись водорода медленно окисляет жирные кислоты с образованием сначала оксикислот, а при дальнейшем окислении — кетонокислот. Окисление происходит в (β-положении (Дэкин):
Кетонокислоты неустойчивы и тут же декарбоксилируются:
Если в молекуле исходной жирной кислоты имеется третичный атом углерода, т. е. группа СН, реакция окисления останавливается на стадии образования оксикислоты с тем же числом атомов углерода в молекуле:
Сходные конечные продукты образуются при окислении жирных кислот в живом организме. В этом случае первой стадией является отщепление двух атомов водорода в α,β-положении, после чего происходит присоединение воды:
Далее получается β-кетокислота и т. д. В живом организме кислоты могут окисляться и в ω-положении (так обозначается положение, наиболее удаленное от функциональной группы, в данном случае — от карбоксильной) с образованием двухосновных кислот (Веркаде):
8. Восстановление. Восстановлением кислот можно получить соответствующий альдегид и затем первичный спирт. Очень энергичным восстановлением можно превратить карбоксил в метил, так что окончательным продуктом реакции будет парафиновый углеводород с тем же числом атомов углерода в молекуле. 9. Образование амидов и нитрилов. При нагревании аммонийных солей жирных кислот выделяется молекула воды и получается амид кислоты:
При дальнейшем нагревании с водоотнимающими средствами, например с фосфорным ангидридом, выделяется вторая молекула воды и получается нитрил кислоты (цианистое соединение):
10. Образование сложных эф и ров. Действием кислот на спирты получаются сложные эфиры жирных кислот. Вопросы для самоконтроля: 1. Номенклатура карбоновых кислот 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
Лекция № 24-25. Производные карбоновых кислот. Цель: ознакомиться с номенклатурой, методами получения, физическими и химическими свойствами, механизмом реакций производных монокарбоновых кислот. Основные вопросы:
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 156; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.140 (0.066 с.) |