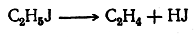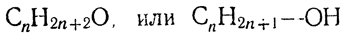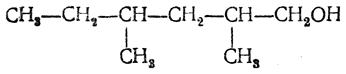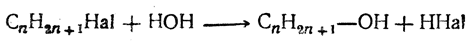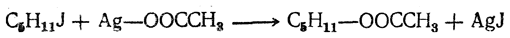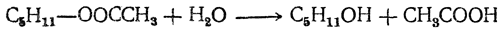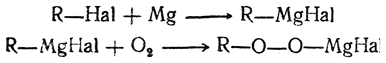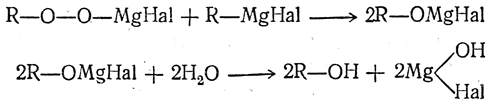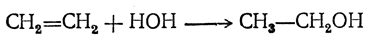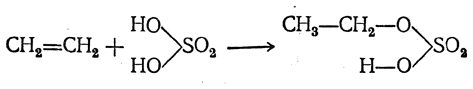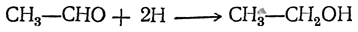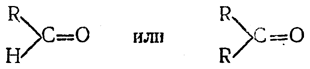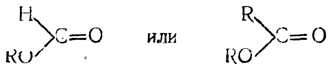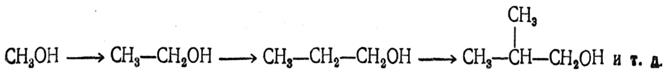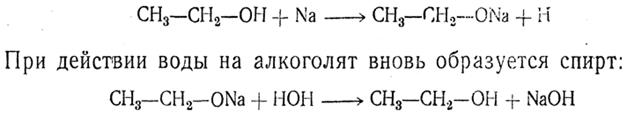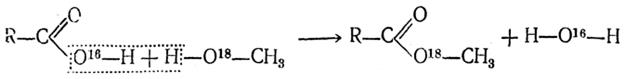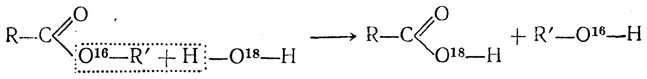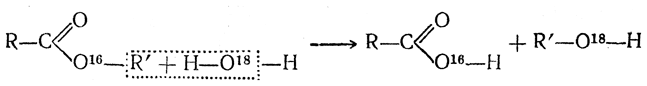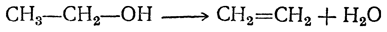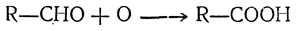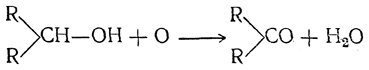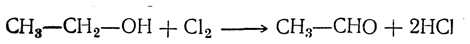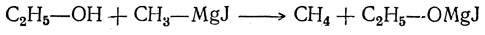Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отщепление галоидоводо родов
При действии концентрированных растворов едких щелочей от молекулы галоидного алкила (за исключением галоидных метилов) может отщепляться молекула галоидоводорода, причем образуются этиленовые углеводороды:
Указанные выше реакции являются лишь немногими примерами огромного числа реакций галоидных соединений, приводящих к образованию органических соединений всевозможных классов. Из галоидных алкилов наиболее реакционноспособны-ми являются йодистые соединения, труднее всех вступают в реакции соединения хлора. Вопросы для самоконтроля: 1. Номенклатура галогеналканов 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
Лекция №16-17 Алканолы (одноатомные спирты). Двух-, трёхатомные спирты. Цель: ознакомиться с номенклатурой, методами получения, физическими и химическими свойствами, механизмом реакций спиртов. Основные вопросы: 1. Классификация и номенклатура 2. Изомерия 3. Лабораторные и промышленные методы получения 4. Физические и химические свойства
Краткое содержание: При замещении в углеводородах ряда метана одного атома водорода на одновалентный радикал гидроксил (водный остаток) ОН получается гомологический ряд одноатомных предельных спиртов, или алкоголей, имеющих следующую общую формулу:
Число изомеров, равно как и характер изомерии, для спиртов совершенно такие же, как и для моногалоидных производных углеводородов. Номенклатура Названия спиртов производятся от названий радикалов. Соответственно этому СН3—ОН называется метиловым спиртом, С2Н5—ОН — этиловым, С3Н7—ОН— пропиловыми, С5Н11—ОН—амиловыми спиртами и т. д. Из двух изомерных алкоголей С3Н7—ОН спирт строения СН3—СН2—СН2—ОН есть первичный пропиловый, спирт СН3—СН(ОН)—СН3 — вторичный пропиловый, или изопропиловый. Спирт С4Н9—-ОН строения (СН3)3С—ОН представляет собой третичный бутиловый спирт. Спирты первичные, вторичные и третичные можно рассматривать как происшедшие от метилового спирта, или карбинола, СН3—ОН замещением в его молекуле одного, двух или трех атомов водорода на один, два или три углеводородных остатка, или алкила. Поэтому по старой рациональной номенклатуре спиртов их названия производились от «карбинола» с указанием на замещающие алкилы. Таким образом, этиловый спирт по этой номенклатуре называется метилкарбинолом, первичный пропиловый — этилкарбинолом, изопропиловый — диметилкарбинолом, третичный бутиловый — триметилкарбинолом.
Названия спиртов, имеющих разветвленное строение, производят от названий спиртов нормального строения, указывая положение боковой цепи греческой буквой: атом углерода, при котором находится гидроксил, отмечается буквой α, соседний с ним — буквой β, следующий — буквой γ и т. д. Таким образом, спирт
может быть назван β,δ-диметилгексиловым спиртом. Женевская номенклатура производит названия спиртов от названий углеводородов с присоединением окончания ол и с приставкой в конце цифры, обозначающей тот атом углерода, при котором находится гидроксил. Таким образом возникают названия: для метилового спирта — метанол, для этилового — этанол, для первичного пропилового — пропанол- 1, для вторичного пропилового — пропанол- 2, для третичного бутилового — 2 -метилпропанол- 2и т. д. Способы получения 1. Получение из галоидных алкилов Наиболее общим способом является получение спиртов из галоидных соединений обменом атомат галоида на гидроксил:
Этим способом можно получать спирты первичные, вторичные и третичные в зависимости от строения радикала С n Н2 n +1 Иногда для получения спирта из галоидного алкила сначала получают сложный эфир уксусной кислоты взаимодействием галоидного алкила с уксуснокислым серебром, например
а затем омылением сложного эфира получают спирт:
Можно получать спирты, исходя из галоидных алкилов, окислением магнийорганических соединений. Промежуточно образуются перекисные соединения
далее превращающиеся в спирты:
2. Присоединение элементов воды к этиленовым углеводородам (гидратация) Например:
Реакция происходит при нагревании этиленовых углеводородов с водой или водяным паром в присутствии таких веществ, как минеральные кислоты (в первую очередь серная и фосфорная), окись алюминия, хлористый цинк и др. Эти вещества действуют как катализаторы, т. е. они оказываются в конце реакции неизменными. Однако с серной кислотой образуется вполне определенный промежуточный продукт, называемый э тилсерной, или серновинной, кислотой:
Этилсерная кислота реагирует с водой, образуя спирт и серную кислоту:
Лишь сам этилен дает при этом первичный спирт. Гомологи этилена образуют вторичные или третичные спирты. 3. Действие азотистой кислоты на амины Спирты можно получить действием азотистой кислоты на первичные амины, причем в зависимости от строения радикала получается первичный, вторичный или третичный спирт. Иногда наряду со спиртами получаются непредельные углеводороды в значительном или даже преобладающем количестве. 4. Восстановление альдегидов или органических кислот При этом получаются первичные спирты, например:
или
Чаще восстанавливают не самые кислоты, а их хлорангидриды, ангидриды или сложные эфиры. Особенно часто применяется восстановление сложных эфиров, причем для получения водорода в момент выделения используют кипящий спирт и металлический натрий (Буво). В последнее время вместо натрия для этой цели широко применяется литийалюминийгидрид LiAlH4. В технике большие количества первичных спиртов готовят восстановлением альдегидов, получаемых путем оксосинтеза. 5. Восстановлением кетонов получаются вторичные спирты, например:
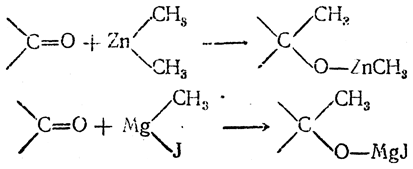
6. Действие металлоорганических соединений на карбонилсодержащие соединения Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Подбирая карбонилсодержащие вещества соответствующего строения, можно получать как первичные спирты, так и вторичные и третичные. Получение спиртов действием цинкдиалкилов на разные карбонилсодержащие соединения открыли и разработали А. М. Бутлеров и его ученики. Поэтому такие реакции называют их именами. Эти реакции имели большое историческое значение. Именно таким путем А. М. Бутлеров впервые получил третичные спирты
строение которых он разъяснил на основании созданной им теории строения. Позднее Барбье, и особенно его ученик — Гриньяр, показали, что гораздо легче получать и удобнее использовать смешанные магнийорганические соединения (реакции Гриньяра). Общая схема реакций состоит в присоединении карбонильной группой >С=О молекулы металлоорганического соединения так, что радикал (алкил) присоединяется к атому углерода, а остальная часть молекулы металлоорганического соединения — к атому кислорода:
При разложении водой образовавшихся продуктов получаются спирты:
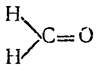
Карбонильная группа содержится в альдегидах, кетонах, кислотах и в различных производных кислот. Так как простейший альдегид — муравьиный, или формальдегид, имеет строение
а в остальных альдегидах и в кетонах атомы водорода замещены на углеводородные радикалы (один — у альдегидов, два — у кетонов)
то в качестве окончательного продукта приведенных выше реакций из муравьиного альдегида получаются первичные спирты (В. Е. Тищенко), из остальных альдегидов — вторичные спирты (реакция Е. Е. Вагнера), из кетонов — третичные спирты (реакция А. М. Зайцева).
Если взять сложные эфиры муравьиной или какой-либо иной карбоновой кислоты
то действие на них металлоорганических соединений протекает в две фазы, из которых первая тождественна изображенной выше, например:
Во второй фазе происходит обмен остатка RO на алкил металлоорганического соединения:
При разложении водой получающихся соединений в случае эфиров уксусной и высших кислот, а также при использовании в качестве исходных веществ хлорангидридов этих кислот образуются третичные спирты (реакция А. М. Бутлерова). В случае эфиров муравьиной кислоты получается вторичный спирт (реакция А. М. Зайцева). 7. Синтез высших спиртов из низших При нагревании спиртовых растворов алкоголятов щелочных металлов происходит синтез высших спиртов из низших. Так, например, из алкоголята пропилового спирта получается так называемый дипропиловый алкоголь. Реакция выражается уравнением:
Как показал В. В, Марковников, эта реакция происходит и при нагревании спиртов с твердым едким кали. По-видимому, протеканием аналогичных реакций объясняется получение высших спиртов из смеси окиси углерода с водородом в присутствии катализаторов — металлов группы железа. Первым продуктом здесь является метиловый спирт, из которого затем образуются высшие спирты:
Получающаяся таким образом смесь (синтол)содержит, кроме большого количества предельных спиртов, также альдегиды, кетоны и кислоты, являющиеся, вероятно, продуктами дальнейшего превращения спиртов (Ф. Фишер). При определенных условиях из окиси углерода и водорода этим путем получают н -пропиловый и изобутиловый спирты. Недавно предложен метод синтеза высших спиртов (С8 и выше) при помощи алюминийорганических соединений (К. Циглер):
Алюминийорганические соединения могут быть легко получены из олефинов в присутствии водорода. Методом Циглера можно получать чистые первичные спирты. Физические свойства Низшие гомологи спиртов — жидкости, высшие — твердые вещества. Гомологическая разность температур кипения низших нормальных первичных спиртов довольно постоянна и приблизительно равна 20° С Низшие спирты, до пропилового включительно, смешиваются с водой во всех отношениях; следующие гомологи ограниченно растворимы в воде; с повышением молекулярного веса растворимость спиртов уменьшается и для высших гомологов практически равна нулю. Однако третичные спирты растворяются в воде лучше других спиртов: трет -бутиловый спирт смешивается с водой во всех отношениях.
Запах низших спиртов слабый, характерный алкогольный; запах средних гомологов сильный, иногда неприятный. Высшие спирты не имеют запаха. Из изомерных спиртов (табл. 5) первичные имеют более высокую температуру кипения, чем вторичные, а вторичные — более высокую, чем третичные; нормальные кипят выше, чем имеющие разветвленную цепь атомов углерода. Плотность всех спиртов меньше единицы. Третичные спирты обладают особым характерным запахом плесени; из всех изомеров они имеют наивысшую температуру плавления. Так, из бутиловых спиртов только триметилкарбинол при обыкновенной температуре твердое вещество (плавится при 25,5°С). Химические свойства 1. Образование алкоголятов Водородный атом гидроксильной группы при действии щелочных металлов способен заменяться на атомы этих металлов, причем получаются твердые, растворимые в спирте соединения, называемые алкоголятами: Последняя реакция обратима. Кроме алкоголятов щелочных металлов, известны также алкоголяты щелочноземельных металлов, алюминия и других металлов. 2-3. Действие галоидных соединений фосфора и действие кислот (этерификация) 2. Действие галоидных соединений фосфора. Эта реакция приводит к получению галоидных алкилов. 3. Действие кислот (этерификация) При действии на спирты кислот происходит выделение воды и образуются вещества, называемые сложными эфирами:
Эта важная реакция, называемая реакцией этерификации, имеет внешнюю аналогию с реакцией нейтрализации кислоты щелочью (хотя сложные эфиры по свойствам нисколько не напоминают соли). Аналогично образованию кислых и средних солей при нейтрализации двухосновных кислот, при этерификации двухосновной, например серной, кислоты возможно образование кислого сложного эфира, называемого алкилсерной кислотой
или же — среднего эфира Сопоставляя реакцию этерификации с реакцией образования алкоголятов, можно видеть, что в спирте, как и в воде, очень слабые основные свойства сочетаются с еще более слабыми кислотными свойствами. В отличие от реакции нейтрализации, которая, как известно, представляет собой ионную реакцию, т. е. сводится к соединению ионов водорода и гидроксила, а потому идет моментально, реакция этерификации, как и громадное большинство реакций органических веществ, не является ионной реакцией и протекает медленно. Реакции этерификации обратимы, а следовательно, ограничены состоянием равновесия. Реакции, обратные этерификации, состоящие в том, что сложный эфир, присоединяя воду, превращается в спирт и кислоту, называются реакциями омыления или гидролиза. Этерификация спиртов органическими, а также слабыми минеральными кислотами идет очень медленно. Эта реакция ускоряется в присутствии сильных минеральных кислот, так как в растворах таких кислот создается высокая концентрация ионов водорода, являющихся катализаторами реакции этерификации. По этой же причине этерификация спиртов сильными минеральными кислотами идет быстро.
Как показали классические исследования Н. А. Меншуткина, скорость и предел этерификации (равновесная степень этерификации) для разных спиртов различны. Они — наибольшие для первичных спиртов и наименьшие для третичных. Однако это правило не всегда соблюдается, а потому изучение скоростей и пределов этерификации дает лишь ограниченную возможность устанавливать, является ли спирт первичным, вторичным или третичным. Исследования Н. А. Меншуткина представляли собой фундаментальные физико-химические исследования динамики химических процессов в области органических соединений. Они послужили отправным пунктом для многих последующих работ в этом направлении. Реакции этерификации являются типичными обратимыми превращениями например, для этерификации этилового спирта уксусной кислотой можно написать такое уравнение:
Для объяснения каталитического действия ионов водорода, поставляемых сильными кислотами, предложена следующая схема:
По этой схеме кислород карбонильной группы карбоновой кислоты, захватывая протон (катион минеральной кислоты), дает начало карбоний-иону I, который присоединяет молекулу спирта и образует сложный промежуточный оксониевый комплекс II, способный обратимо распадаться с отщеплением воды. и образованием карбоний-иона сложного эфира III. Последний, регенерируя минеральную кислоту (катализатор), дает молекулу сложного эфира. Пользуясь методом «меченых атомов», удалось показать, что при этерификации кислоты спиртом молекула выделяющейся при этом воды образуется из гидроксила кислоты и водорода спирта (как это и следует из приведенной выше схемы), а не из гидроксила спирта и водорода карбоксильной группы. При этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18, был получен сложный эфир, содержавший в своем составе этот изотоп кислорода:
Аналогичное исследование процесса омыления сложных эфиров водой, содержащей тяжелый изотоп кислорода, показало, что омыление эфиров идет по схеме
а не по схеме
потому, что образовавшаяся при омылении кислота содержала О18, а соответствующий спирт его не содержал. Присутствие или отсутствие О18 устанавливалось сжиганием образца вещества и анализом образующихся продуктов сгорания (СО2 и Н2О) на присутствие тяжелого изотопа кислорода О18. Как показывает приведенный пример, в настоящее время, пользуясь методом «меченых атомов», удается глубже проникнуть в механизм химических процессов. В качестве «меченых атомов» используют тяжелые изотопы водорода Н2, кислорода О18 и т. п. или радиоактивные изотопы других элементов. Как реакцию, аналогичную этерификации, можно рассматривать и действие на спирты галоидоводородных кислот, приводящее к образованию галоидных алкилов. Эта реакция идет легче всего с третичными спиртами. 4. Отнятие воды (дегидратация) Реакции, идущие с отнятием воды, могут в конечном результате приводить к образованию или этиленовых углеводородов, или простых эфиров. В первом случае молекула воды выделяется из одной молекулы спирта (за исключением метилового)
во втором случае — из двух молекул спирта:
Образование этиленового углеводорода может происходить при нагревании спирта, чаще всего в присутствии катализаторов или водоотнимающих средств. Легче всего идет дегидратация третичных, затем вторичных и труднее всего — первичных спиртов. Третичные спирты иногда дегидратируются уже при простом нагревании, но чаще требуется применение добавок (серная, борная, щавелевая кислоты, иод, хлористый цинк, кислый сульфат натрия и др.). Для дегидратации вторичных и первичных спиртов нужна высокая температура (200 — 350° С) и гетерогенные катализаторы, например Аl2О3, ThO2. Простые эфиры образуются при нагревании избытка спирта с серной кислотой, а также при пропускании паров спирта через нагретый безводный сульфат алюминия или безводные квасцы. 5. Окисление Реакции окисления имеют большое значение для установления строения органических веществ, так как они протекают по-разному для первичных, вторичных и третичных спиртов. Действие окислителей, как и во многих других случаях, направляется прежде всего на уже «окисленный», т. е. связанный с кислородом, атом углерода. При этом из первичных и вторичных спиртов получаются главным образом продукты, содержащие в молекуле столько же атомов углерода, сколько их было в исходном спирте. В случае первичных спиртов первыми продуктами окисления являются альдегиды
могущие при дальнейшем окислении переходить в кислоты:
Вторичные спирты при окислении дают кетоны:
Окисление третичных спиртов, так же как и дальнейшее окисление кетонов и кислот, может происходить лишь с разрывом связей между атомами углерода, т. е. с расщеплением углеродного скелета. Обыкновенно и здесь окисление направляется, в первую очередь, на «окисленный» атом углерода и приводит к разрыву связей между ним и соединенными с ним радикалами. 6. Действие галоидов Действие галоидов на первичные и вторичные спирты приводит прежде всего также к образованию альдегидов из первичных спиртов и кетонов из вторичных спиртов, например:
При дальнейшем действии галоидов происходит замещение на галоид атомов водорода в альдегидах и кетонах, 254). 7-8. Отщепление водорода. Превращение первичных и вторичных спиртов в альдегиды и кетоны может происходить и при пропускании паров спирта над накаленными металлами — никелем, железом, цинком и пр., причем спирт распадается на альдегид (соответственно — кетон) и водород:
Особенно хорошо, и к тому же при более низких температурах, эта реакция идет с мелко раздробленной медью (Сабатье). 8. Действие магнийорганических соединений При действии на спирты магнийорганических соединений из радикала магнийорганического соединения и водорода гидроксильной группы получается предельный углеводород. Вместо водорода гидроксильной группы в молекулу спирта вступает остаток металлоорганического соединения, например:
Образующийся при реакции метан можно собрать и измерить, чем пользуются для количественного определения гидроксильных групп в спиртах (Л. А. Чугаев, Ф. В. Церевитинов).
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.72.224 (0.054 с.) |