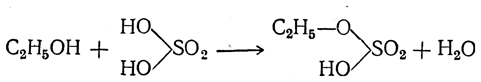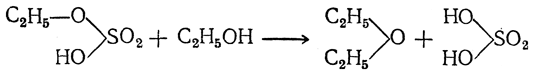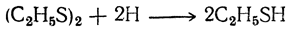Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Высшие жидкие и твердые спирты
Нормальные первичные спирты, содержащие 6—10 атомов углерода, и многие разветвленные спирты с гораздо большим молекулярным весом представляют собой жидкости. Большинство этих спиртов может быть получено только синтетически, но некоторые из них встречаются в природе в эфирных маслах в виде сложных эфиров. Со сравнительно недавнего времени некоторые высшие спирты стали получать в промышленном масштабе. Они нашли значительное применение как промежуточные продукты в производстве моющих средств, пластификаторов, флотореагентов и др., а также в качестве растворителей в фармацевтической и парфюмерной промышленности. В голове китообразного морского животного — кашалота находится особое жироподобное вещество, называемое спермацетом. Это вещество, применяемое для приготовления медицинских мазей, содержит твердый спирт C16H33OH, называемый цетиловым, а также сложный эфир этого спирта и пальмитиновой кислоты. Пчелиный воск и другие воскообразные вещества содержат сложные эфиры еще более высокомолекулярных спиртов, а также и самые спирты. Из пчелиного воска выделены: цериловый спирт С26Н53ОН с т. пл, 78—79° С и мирициловый спирт C30H61OH с т. пл. 85,5° С. В различных восках содержатся также спирты с 28, 32 и 34 атомами углерода. Вопросы для самоконтроля: 1. Номенклатура спиртов 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
Лекция № 18. Простые эфиры. Тиоспирты. Тиоэфиры и другие соединения серы. Цель: ознакомиться с номенклатурой, методами получения, физическими и химическими свойствами, механизмом реакций простых эфиров, органических соединений серы. Основные вопросы: 1. Номенклатура и изомерия простых эфиров 2. Лабораторные и промышленные методы получения 3. Физические и химические свойства
Краткое содержание: Простые эфиры Простыми эфирами называются вещества, которые представляют собой соединение двух одновалентных углеводородных радикалов с атомом кислорода. Их можно рассматривать также как продукты замещения в молекуле воды обоих атомов водорода на одновалентные углеводородные радикалы.
От простейшего из эфиров — диметилового эфира, или просто метилового эфира, СН3—О—СН3 последовательным замещением атомов водорода в одной из метальных групп на остаток метил можно произвести гомологический ряд:
Для простых эфиров возможна такая же изомерия радикалов, какая существует для спиртов и вообще для одноатомных производных парафиновых углеводородов. От каждого из членов этого ряда можно, кроме того, произвести гомологический ряд, заменяя второй метил на высшие радикалы. Благодаря этому для класса простых эфиров, кроме обычной изомерии радикалов, возможна также особая изомерия, вызванная тем, что с кислородным атомом могут быть связаны радикалы различного состава. Так, эфир С2Н5—О—С2Н5 изомерен эфиру СН3—О—С3Н7, поскольку оба эфира имеют эмпирическую формулу С4Н10О. Изомерия этого рода носит название метамерии. Простые эфиры, содержащие два разных радикала, называются смешанными эфирами. Названия эфиров производятся от названий радикалов. Так, мы имеем диметиловый (метиловый) эфир, метилэтиловый эфир, диэтиловый (этиловый), метилпропиловый, метилизопропиловый эфиры и т. д. Способы получения 1. Действие водоотнимающих средств Классическим способом получения простых эфиров является действие на спирты серной кислоты. При этом, например, из этилового спирта сначала получается этилсерная, или серновинная, кислота (Вильямсон)
которая при нагревании с избытком спирта образует простой эфир, причем выделяется молекула серной кислоты:
Таким образом, серная кислота в конце процесса оказывается неизмененной и может снова войти в реакцию со спиртом, т. е. она играет роль катализатора. Во второй фазе реакции можно взять другой спирт. Тогда получается смешанный эфир:
Так как образующаяся при реакции вода может отгоняться с эфиром (вместе с небольшим количеством спирта), то теоретически было бы достаточно небольшого количества серной кислоты, чтобы превратить в эфир неограниченные количества спирта. Однако наряду с образованием эфира идет также и окисление спирта серной кислотой с восстановлением последней до сернистого ангидрида. Поэтому на заводах, где процесс ведется непрерывно, серную кислоту приходится периодически добавлять. Добавка к серной кислоте некоторых сернокислых солей (например, сернокислого алюминия) благоприятствует образованию эфира. Диэтиловый эфир образуется также при водоотнимающем действии некоторых других кислот (фосфорная кислота, органические сульфокислоты и пр.) и некоторых безводных солей (хлористый цинк, сернокислая медь и пр.). Было предложено получать его сухим путем, пропуская пары спирта через нагретые до 150—200° С обезвоженные квасцы.
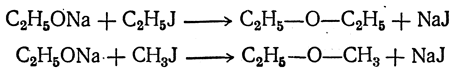
Простые эфиры образуются также как промежуточные продукты при получении олефинов пропусканием паров спирта над глиноземом, окисью тория и т. п. 2. Действие галоидных алкилов на алкоголяты. Второй способ получения простых эфиров состоит в действии галоидных алкилов на алкоголяты (Вильямсон). И в этом случае можно получать как симметричные простые эфиры, так и смешанные:
При этом наряду с эфирами, а иногда почти исключительно, образуются этиленовые углеводороды. Свойства Простые эфиры, получаемые из низших спиртов, кипят при более низкой температуре, чем соответствующие спирты. Диметиловый эфир и метилэтиловый эфир при обыкновенной температуре — газы. Первый имеет т. кип. —23,7° С, а второй +10,8° С. Даже низшие эфиры не смешиваются с водой, но несколько в ней растворяются и сами ее несколько растворяют. Простые эфиры — нейтральные вещества. Они довольно трудно вступают в реакции, но с концентрированной и особенно с дымящей серной кислотой реагируют с образованием сложных эфиров серной кислоты — кислых и средних. Соответственно строению простых эфиров, атомы водорода в них не могут заменяться на металл, но довольно легко замещаются на атомы хлора. Иодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и иодистый алкил:
Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров за счет окисления в α-положении к эфирному кислороду, например:
Эти вещества чрезвычайно взрывчаты и являлись причиной сильных взрывов в лабораториях. Взрывы происходили в конце перегонки эфира, не очищенного предварительно от перекисей. Натрий при низких температурах не действует на простые эфиры. При более высоких температурах простые эфиры (особенно их высшие гомологи) расщепляются по уравнению R—О—R + 2Na→ R—ONa + R—Na Еще легче реагирует калий и особенно легко — литий. Как показал П. П. Шорыгин, образующиеся металлоорганические соединения легко подвергаются дальнейшим превращениям.
Физические свойства Простые эфиры, получаемые из низших спиртов, кипят при более низкой температуре, чем соответствующие спирты. Диметиловый эфир и метилэтиловый эфир при обыкновенной температуре — газы. Первый имеет т. кип. —23,7° С, а второй +10,8° С. Даже низшие эфиры не смешиваются с водой, но несколько в ней растворяются и сами ее несколько растворяют. Простые эфиры — нейтральные вещества. Они довольно трудно вступают в реакции, но с концентрированной и особенно с дымящей серной кислотой реагируют с образованием сложных эфиров серной кислоты — кислых и средних.
Соответственно строению простых эфиров, атомы водорода в них не могут заменяться на металл, но довольно легко замещаются на атомы хлора. Иодистоводородная кислота может реагировать с простым эфиром, превращая его в спирт и иодистый алкил:
Простые эфиры при стоянии медленно окисляются кислородом воздуха. При этом образуются гидроперекиси эфиров за счет окисления в α-положении к эфирному кислороду, например:
Эти вещества чрезвычайно взрывчаты и являлись причиной сильных взрывов в лабораториях. Взрывы происходили в конце перегонки эфира, не очищенного предварительно от перекисей. Натрий при низких температурах не действует на простые эфиры. При более высоких температурах простые эфиры (особенно их высшие гомологи) расщепляются по уравнению R—О—R + 2Na→ R—ONa + R—Na Еще легче реагирует калий и особенно легко — литий. Как показал П. П. Шорыгин, образующиеся металлоорганические соединения легко подвергаются дальнейшим превращениям.
Тиоспирты (меркаптаны) Тиоспирты могут быть получены действием галоидных алкилов, солей алкилсерных кислот или диалкилсульфатов на кислый сернистый калий или натрий:
Кроме того, они могут быть получены энергичным восстановлением сульфокислот или их хлорангидридов:
В настоящее время меркаптаны очень просто получаются действием хлористых или бромистых алкилов или диалкилсульфатов на тиомочевину
с последующим расщеплением щелочью полученного продукта: Физические свойства Вода представляет собой жидкость, сероводород при комнатной температуре — газ; вода не имеет запаха, сероводород сильно и неприятно пахнет. В соответствии с этим меркаптаны кипят значительно ниже спиртов, и запах меркаптанов — один из самых отвратительных и сильных запахов, какие встречаются у органических веществ. Метилмеркаптан кипит уже при 6° С. Этилмеркаптан кипит при 37° С, его относительная плотность 0,839 при 20° С. Меркаптаны, даже низшие, мало растворимы в воде, но хорошо растворимы в спирте и эфире. Химические свойства 1. Образование меркаптидов. Сероводород является слабой кислотой, и меркаптаны в отличие от спиртов могут растворяться в едких щелочах, давая соединения типа R—S—Na, в которых водород сульфгидрила замещен на металл. Эти соединения называются меркаптидами.
Меркаптаны легко дают соли (меркаптиды) также и с окислами тяжелых металлов. Особенно легко образуются хорошо кристаллизующиеся из спирта бесцветные ртутные меркаптиды:
От названий этих ртутных соединений (corpus mercurio aptum) и произошло название меркаптанов. Свинцовые и медные меркаптиды имеют желтый цвет. Поведение меркаптидов по отношению к кислотам очень напоминает поведение сернистых металлов. Соляная кислота легко вытесняет меркаптан из натриевого меркаптида и трудно — из ртутного и из меркаптидов некоторых других тяжелых металлов. 2. Действие окислителей. Слабые окислители, такие, как гидроксиламин, серная кислота и даже кислород воздуха в присутствии аммиака, окисляют меркаптаны в дисульфиды:
Сильные окислители, как, например, азотная кислота, окисляют меркаптаны в сульфокислоты:
Дисульфиды можно получить также действием иода на меркаптиды
и перегонкой солей алкилсерных кислот с двусернистым калием:
Дисульфиды представляют собой тяжелые жидкости с неприятным запахом, имеющие значительно более высокие температуры кипения, чем меркаптаны (диэтилдисульфид кипит при 112° С; относительная плотность 1,064 при 0°С). Под действием восстановителей дисульфиды превращаются в меркаптаны:
3. Образование тиоэфиров карбоновы х кислот. При действии на меркаптаны карбоновых кислот или их хлорангидридов получаются тиоэфиры карбоновых кислот:
Метилмеркаптан CH3SH образуется при гидролизе кератина шерсти и гниении белковых веществ, содержащих серу. Он находится также в человеческих испражнениях, являясь вместе со скатолом причиной их неприятного запаха. Высшие меркаптаны обладают сравнительно слабым запахом. За последнее время стали получать в довольно значительных количествах додецил-, или лаурилмеркаптан, C12H25SH, применяемый в производстве синтетического каучука как регулятор эмульсионной полимеризации. Это — жидкость, кипящая при 153—155° С при 24 мм; относительная плотность 0,845 при 20° С.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.029 с.) |