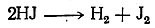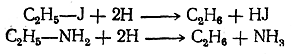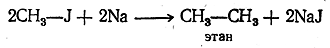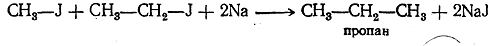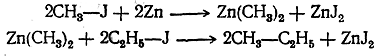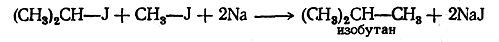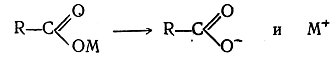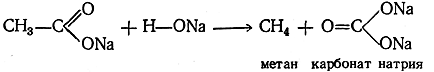Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рациональная номенклатура предельных углеводородовСодержание книги
Поиск на нашем сайте
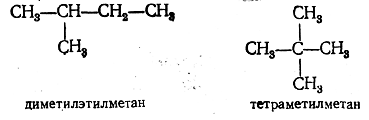
Каждый член ряда метана (со всеми возможными изомерами) имеет особое наименование, оканчивающееся на ан. Корни названий первых четырех гомологов являются случайными. Так, углеводород СН4 называется метаном, С2Н6 — этаном, C3H8— пропаном, С4Н10—бутаном. Названия следующих гомологов производятся от греческих названий чисел: С5Н12 — пентан, С6Н14—гексан, C7H16 — гептан и т. д., с тем исключением, что название углеводорода С9Н20 — нонан производится от латинского числительного, а в названии углеводорода С11Н24 — ундекан имеются латинский и греческий корни (в части иностранной литературы его называют хендекан, чтобы оба корня были греческими). Чтобы отличить по названию отдельные изомеры, употребляются различные приемы. Прежде всего отличают «нормальные углеводороды», или углеводороды с «нормальными» углеродными цепями, т. е. с такими цепями, в которых ни один атом углерода не связан более чем с двумя другими атомами углерода. Строение нормальных углеводородов можно выразить общей формулой СН3—(СН2)m—СН3. Остальные изомеры называются «изоуглеводородами» или углеводородами с «разветвленными» углеродными цепями. Так, из двух изомерных бута-нов один называется нормальным бутаном (обычно пишут н-бу-тан), другой — изобутаном. Чтобы различить изомерные углеводороды, рационально применять названия, включающие наименования углеводородных остатков (радикалов), входящих в состав молекулы данного углеводорода. Названия радикалов производятся от названий соответствующих углеводородов с изменением окончания ан на ил, например СН3—метил, C2H5—этил и т. п. Исключение составляет радикал С5Н11, для которого принято название амил (а не пентил). Для всех радикалов этого рода принято общее наименование алкилы. Пользуясь такой номенклатурой, один из изомерных пен-танов называют диметилэтилметаном, а другой — тетраметилме-таном
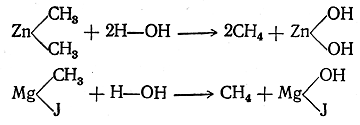
так как первый углеводород можно рассматривать как метан, в котором два атома водорода замещены на метилы и один — на этил, второй углеводород — как метан, в котором все четыре атома водорода замещены на метилы. Женевская (IUPAC) номенклатура предельных углеводородов Весьма целесообразной номенклатурой органических соединений является номенклатура, выработанная специальным международным совещанием представителей химических обществ, происходившим в 1892 г. в Женеве, отчего она получила название женевской (или научной) номенклатуры. В этой номенклатуре для нормальных углеводородов оставлены обычные названия; названия же изомерных углеводородов с разветвленными цепями производятся от названия нормального углеводорода, которому в рассматриваемой молекуле соответствует наиболее длинная цепь атомов углерода. Называя радикалы, замещающие в таком нормальном углеводороде атомы водорода, обозначают атомы углерода, при которых находятся замещающие радикалы, цифрами, считая от начала нормальной углеродной цепи. Так, например, из двух изомерных пентанов диметилэтилметан по женевской номенклатуре называется 2-метилбутаном, а тетраметилметан называется 2,2-диметилпропаном; гексан строения называется 2,3-диметилбутаном. При еще более разветвленном строении, например в тридекане рассматривают разветвленную боковую цепь как радикал пропил, в котором атом водорода замещен метилом, что выражается названием «метопропил»; таким образом, этот тридекан должен быть назван 51-мето-5-пропилнонаном. Способы получения предельных углеводородов (алканов) Как было уже сказано, каждый класс органических соединений характеризуется определенными особенностями строения. Мы знаем также, что от строения зависят физические и химические свойства веществ. Следовательно, вещества, принадлежащие к одному классу соединений, должны обладать многими общими или правильно изменяющимися при изменении состава физическими и химическими свойствами. Но не только физические свойства и химически-е реакции, т. е. настоящее и будущее веществ близкого строения, должны иметь много общего; в прошлом таких веществ, т. е. в способах их образования из веществ других классов, также должно быть много общего. Общие способы получения предельных алифатических углеводородов можно разбить на три группы: I. Получение из соединений, содержащих в молекуле столько же атомов углерода, сколько их имеется в получаемом углеводороде. II. Получение из соединений с меньшим числом атомов углерода в молекуле; эти способы можно назвать синтетическими. III. Получение из соединений с большим числом атомов углерода в молекуле; эти способы относятся к реакциям расщепления молекул. I. Получение из соединений с тем же числом атомов углерода в молекуле: 1. Получение из производных введением водорода вместо заместителя. Получение углеводородов из соединений с тем же числом атомов углерода, но содержащих, кроме углерода и водорода, другие атомы или группы, т. е. получение углеводородов из их производных, очевидно, должно состоять в замене этих атомов или групп на атомы водорода (элиминирование заместителя). Иначе говоря, реакции этого рода можно рассматривать как реакции восстановления. Замена указанных атомов или групп на водород в различных органических веществах происходит с различной степенью трудности. Например, в таких металлоорганических соединениях, как цинкорганические или магнийорганические, атомы металла легко заменяются на атомы водорода уже при действии воды:
Для других органических соединений требуется действие сильных восстановителей. Как показал Вертело (1868), особенно энергично восстанавливает органические вещества иодистоводородная кислота (при нагревании) вследствие ее способности диссоциировать на водород и иод:
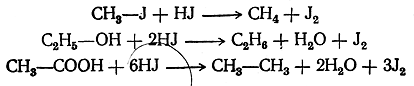
При этом водород в момент выделения (in statu nascendi) действует чрезвычайно энергично как восстановитель. Таким образом, можно различные вещества, даже столь трудно восстанавливающиеся, как органические кислоты, восстановить до углеводородов, согласно следующим примерным уравнениям:
Газообразный водород является при обыкновенной температуре веществом инертным. Чтобы водород вступал в реакции восстановления, нужно действовать им в момент его выделения из соединений, пользуясь, например, цинком или амальгамой натрия и соляной кислотой или литийалюминийгидридом LiAlH. В этом случае реакции сводятся к прямому замещению различных атомов и остатков на водород, например:
2. Получение из непредельных углеводородов. К реакциям восстановления относят и реакции получения предельных углеводородов из непредельных, т. е. содержащих двойные и тройные связи. Здесь речь идет о непосредственном присоединении атомов водорода (реакции гидрирования), например:
Эти реакции также протекают при действии таких восстановителей, как иодистоводородная кислота, но могут идти и с газообразным водородом. Однако в последнем случае, вследствие инертности водорода при обыкновенной температуре, приходится прибегать к помощи катализаторов. Наиболее сильными катализаторами для реакции восстановления водородом являются металлы группы платины в мелко раздробленном состоянии, особенно сама платина, палладий и осмий. В присутствии этих металлов водород легко вступает в реакции даже при обычной температуре (С. А. Фокин; Вильштеттер). Чрезвычайно важное значение имело открытие, сделанное французскими учеными Сабатье и Сандераном. Ими было найдено (1905), что очень активным катализатором для реакций присоединения водорода является мелко раздробленный никель при температуре выше 100 °С. Кроме металлического никеля, для этой цели теперь применяют также окись никеля, мелко раздробленную медь и ряд других катализаторов. Очень активным катализатором реакций восстановления водородом являет- ся так называемый скелетный никелевый катализатор («никель Ренея»); он получается из сплава никеля с алюминием — в остатке после выщелачивания большей части алюминия рас-твором едкого натра. 3. Получение из кетонов. Большое значение имеет реакция Н. М. Кижнера, позволяющая получать углеводороды из соответствующих альдегидов и кетонов. Получение из соединений с меньшим числом атомов углерода в молекуле: 1. Получение из галоидных алкилов. Одной из важнейших синтетических реакций получения предельных углеводородов является действие натрия на галоидные алкилы (реакция Вюрца). Механизм этой реакции подробно изучен П. П. Шорыгиным. При действии натрия на галоидное соединение галоид отщепляется, а два углеводородных остатка соединяются, образуя молекулу углеводорода:
При этом можно взять два различных галоидных алкила:
Аналогично галоидные алкилы реагируют и с некоторыми другими металлами. Реакцию можно разделить на две фазы: а) образование металлоорганических соединений и б) действие на них галоидных соединений, приводящее к синтетическому образованию углеводородов, например:
Реакция Вюрца имеет большое значение не только для синтеза углеводородов, но и для доказательства их строения, Подбирая галоидные соединения с соответствующими радикалами, можно получить углеводород любого строения, например.
Обозначая одновалентные углеводородные остатки, или радикалы, буквой R, можно изобразить уравнение реакции Вюр-да в самой общей форме: R — J + R'— J + 2Na-----> R — R' + 2NaJ 2. Электролиз солей одноосновных органических кислот (реакция Кольбе). В растворах соли одноосновных органических кислот распадаются на ионы:
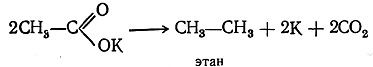
При электролизе ион металла, теряя на электроде заряд, действует на воду с выделением водорода и образованием едкой щелочи, а ион кислотного остатка, потеряв свой заряд, распадается на радикал R· и двуокись углерода СО2. Два радикала R· соединяются в молекулу R—R. Согласно сказанному, при пропускании электрического тока через раствор уксуснокислого калия происходит реакция:
Получение из соединений с большим числом атомов углерода в молекуле (реакции расщепления): Из реакций получения индивидуальных предельных углеводородов, происходящих с расщеплением углеродной цепи, важнейшей является сплавление солей одноосновных предельных кислот с едкими щелочами. Реакция идет по уравнению
Физические свойства предельных углеводородов (алканов) Согласно теории химического строения, физические свойства веществ зависят от их состава и строения. На примере предельных углеводородов мы впервые встречаемся с изменениями физических свойств в одном гомологическом ряду. Четыре первых члена гомологического ряда предельных углеводородов, начиная с метана, являются веществами газообразными. Сам метан является постоянным газом, сгущающимся в жидкость лишь при температуре —161,5° С. У последующих членов ряда температура кипения возрастает от гомолога к гомологу. Начиная с пентана и выше, нормальные углеводороды представляют собой жидкости, причем у средних гомологов с увеличением молекулярного веса температура кипения при переходе к следующему гомологу возрастает приблизительно на 25—30° С. Эта гомологическая разность температур кипения медленно уменьшается с увеличением молекулярного веса. Закономерности в изменении температуры плавления нормальных углеводородов с нарастанием молекулярного веса (числа атомов углерода в молекуле) видны из рис. 15. Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно.. Относительная плотность углеводородов при их температурах кипения увеличивается сначала быстро, а затем все медленнее — от 0,416 у метана до величины несколько большей 0,78. Начиная с углеводорода C16H34, высшие гомологи при обычной температуре — вещества твердые. Правильности в изменении некоторых свойств выступают особенно четко, если эти свойства относить не к грамму, а к грамм-молекуле вещества. Так, молярный объем, получающийся при умножении молекулярного веса М на удельный объем 1/плотность, т. е. величина M/d при переходе от каждого предыдущего гомолога к последующему правильно изменяется на величину, в среднем близкую к 17. Аналогично молярную теплоту горения предельных углеводородов можно вычислить, исходя из молярной теплоты горения метана, равной 212 ккал, прибавляя 158 ккал на каждую группу СН2. Температуры кипения всех изоалканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы, как видно, например, из сравнения температур кипения трех изомерных пентанов. Наоборот, температура плавления оказывается самой высокой у изомеров с максимально разветвленной, в особенности симметрично разветвленной, углеродной цепью. Так, из всех изомерных октанов лишь гексаметилэтан (СН3)3С—С(СН3)3 является веществом твердым уже при обыкновенной температуре (т. пл. 100,7°С). Химические свойства предельных углеводородов (алканов) Углеводороды ряда метана при обыкновенной температуре химически весьма инертны, почему они и получили название парафинов (от латинских слов parum affinis — обладающий малым сродством). С большинством химических реагентов эти углеводороды в указанных условиях или вовсе не реагируют, или реагируют чрезвычайно медленно. При сравнительно невысоких температурах протекает лишь небольшое число реакций, при которых происходит замена атомов водорода на различные атомы и группы (реакции металепcuu). Эти реакции ведут к получению производных соответствующих углеводородов. К реакциям присоединения парафины вообще неспособны в силу насыщенности всех связей атомов углерода. 1. Действие галогенов Важной реакцией парафиновых углеводородов является взаимодействие их с галоидами На свету эти углеводороды могут последовательно замещать атомы водорода на атомы галоида. При этих реакциях хлор действует энергичнее других галоидов. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с иодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и иода (обратимая реакция). Чтобы реакция дошла до конца, необходимо образующийся йодистый водород все время удалять из сферы реакции (па-пример, добавлением окиси ртути или йодноватой кислоты). 2. Действие азотной кислоты Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды; при нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением т. е. один из атомов водорода заменяется на остаток NO2 (нитрогруппа) и выделяется вода. Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН2 и еще труднее — в остатке СН3.Парафины довольно легко нитруются в газовой фазе при 150—475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан. Последующие гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН3—СН2—NO2 и нитрометан СН3—NO2. Из пропана образуется смесь нитропарафинов. Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе. 3. Действие серной кислоты Серная кислота при обыкновенной температуре не действует на парафины; при высокой температуре действует как окислитель. При слабом нагревании дымящая серная кислота может действовать на парафиновые углеводороды (особенно на углеводороды изострое-ния, содержащие группу СН), образуя сульфокислоту и воду (реакция сульфирования). 4. Одновременное действие сернистого ангидрида и кислорода При совместном действии сернистого ангидрида и кислорода воздуха под влиянием ультрафиолетовых лучей или добавок перекисей парафиновые углеводороды, даже нормального строения, реагируют с образованием сульфокислот (реакция сульфоокисления). 5. Одновременное действие сернистого ангидрида и хлора При совместном действии сернистого ангидрида и хлора при освещении ультрафиолетовым излучением или под влиянием некоторых катализаторов происходит замещение атома водорода с образованием так называемых сульфохлори-дов (реакция сульфохлорирования). Вместо смеси SO2 и Cl2 можно пользоваться хлористым сульфурилом. 6. Действие кислорода и окислителей Кислород и окислители, даже такие сильные, как хромовая кислота и пер-манганат, при обыкновенной температуре почти не действуют на парафиновые углеводороды. При повышенной температуре сильные окислители медленно действуют на предельные углеводороды таким образом, что в каком-нибудь месте молекулы разрывается связь между атомами углерода и молекула распадается на отдельные осколки, окисляющиеся при этом в органические кислоты. Эти кислоты всегда содержат в молекуле меньшее число атомов углерода, чем исходный углеводород, т. е. реакции окисления являются всегда реакциями распада (расщепления) молекулы углеводорода. Газообразный кислород при обыкновенной температуре вовсе или почти не действует на парафины. При высокой температуре углеводороды воспламеняются и горят, причем происходит полное разрушение органической молекулы, ведущее к образованию углекислого газа и воды. Лишь сравнительно недавно было исследовано действие кислорода и воздуха на алканы (преимущественно твердые) при средних температурах, когда окисление протекает довольно энергично, но не приводит к воспламенению. Оказалось, что и в этом случае происходит частичное расщепление молекул углеводородов с образованием кислородсодержащих веществ, главным образом органических кислот. В настоящее время окисление смеси высших твердых предельных углеводородов — окисление парафина - проводится в крупных промышленных масштабах для получения жирных кислот. В последнее время промышленное значение получает так называемое регулируемое (проводимое при сравнительно низких температурах) окисление кислородом или воздухом также и низших предельных углеводородов: метана, этана, пропана и бутана. При этом получаются смеси спиртов, альдегидов, ке-тонов и кислот, причем промежуточно образуются, очевидно, простейшие перекисные соединения. Обычно окисление пропана в промышленных условиях проводят таким образом, чтобы получить возможно больше ацетальдегида. 7. Действие высоких температур При высоких температурах все парафиновые углеводороды подвергаются более или менее глубокому распаду с разрывом связей С—С или С—Н. При этом образуются продукты, состав которых зависит от условий термического воздействия (температура, давление, продолжительность нагревания) и от природы углеводорода. Так как осуществление этих процессов в принципе несложно, а получающиеся продукты являются ценным топливом и важным сырьем для химической промышленности, этот путь использования парафиновых углеводородов интенсивно изучался и широко распространен. Метан лучше всех других углеводородов выдерживает нагревание: он начинает заметно разлагаться лишь около 800° С. Важнейшим продуктом превращения метана является ацетилен, который получается с хорошим выходом только в специальных условиях. Одновременно получаются этилен к водород. При понижении температуры содержание ацетилена в продуктах распада понижается, а этилена — увеличивается; понижение давления способствует увеличению выхода обоих углеводородов. Выше 1600° С, а также при длительном нагревании до 800—1600° С метан распадается главным образом на углерод и водород. Этан при температуре 575—1000 С распадается преимущественно на этилен, ацетилен и водород; при дальнейшем нагревании происходит обугливание и вместе с тем образование ароматических углеводородов. Термический распад более сложных углеводородов происходит по-разному в зависимости от температуры. Чем длиннее и разветвленнее углеродный скелет молекулы парафина, тем легче происходит термическое разложение. Так, одинаковая степень термического распада достигается у пропана при 700— 800° С, а у бутана при 650—750° С. Следующие гомологи начинают распадаться при еще более низких температурах. Химические реакции, происходящие при термическом распаде углеводородов, обычно называют крекингом (англ. — растрескивание, разламывание). Механизм процесса крекинга довольно сложен. Первичными продуктами реакции являются свободные радикалы, вступающие затем во взаимодействие между собой и с другими молекулами. Конечными продуктами крекинга, проводимого при 450—550 °С, являются смеси более низкомолекулярных углеводородов (насыщенных, ненасыщенных и циклических). При 550—650°С происходит более глубокий крекинг: получается много углистого остатка (кокса), простейших газообразных углеводородов (насыщенных и ненасыщенных), а также смесь жидких углеводородов, в которой преобладают ароматические углеводороды. При более длительном нагревании образуется больше циклических углеводородов и меньше ненасыщенных. Выше 1000° С распад идет уже главным образом до углерода (кокс) и водорода. Крекинг высших углеводородов в атмосфере водорода, особенно под давлением и в присутствии катализаторов (например, окиси железа), приводит к смеси, в которой преобладают парафиновые углеводороды. Вопросы для самоконтроля: 1. Номенклатура алканов 2. Изомерия 3. Способы получения 4. Физические свойства 5. Химические свойства Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974 4. Ю. А. Жданова «Очерки методологии органической химии», Изд. «Высшая школа»., М., 1960.
|
||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 114; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.014 с.) |