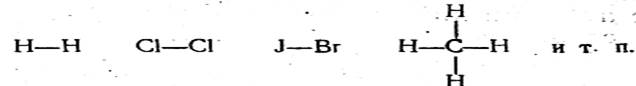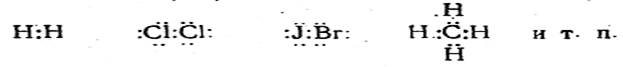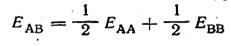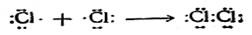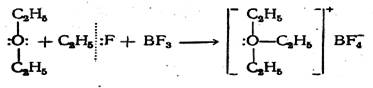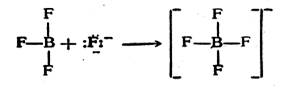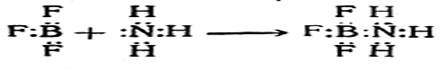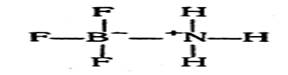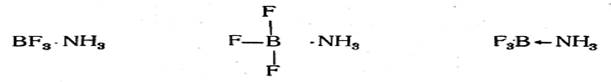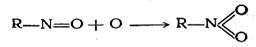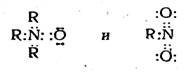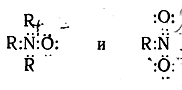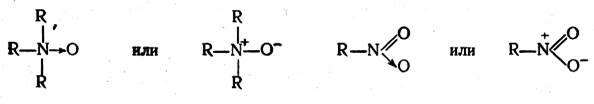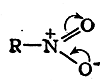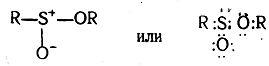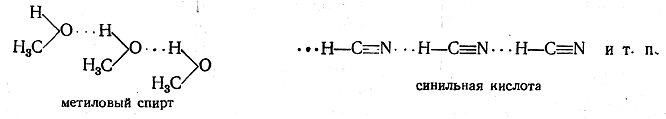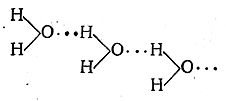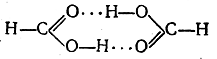Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гомеополярная (ковалентная) связь
При соединении друг с другом одинаковых атомов или атомов, обладающих близким по своему значению сродством к электрону, между ними образуется гомеополярная, или ковалентная, связь. Последний термин в настоящее время употребляется чаще. Ковалентная связь между атомами в химических соединениях
осуществляется общей парой электронов (электроны обычно. изображаются точками):
Вопрос об отличии ковалентных связей от ионных можно решить, пользуясь несколькими критериями. Важным критерием является полярность связи, т. е. наличие постоянного дипольного момента. Дипольный момент гомеополярных связей в огромном боль шинстве случаев не превышает 1,0 D а для гомеополярных связей между одинаковыми атомами он близок или равен нулю. Ионная связь, напротив, обладает очень большой полярностью, так как результирующие положительный и отрицательный заряды сосредоточены в центрах ионов и находятся на сравнительно большом расстоянии друг от друга. Дипольный момент ионной связи равен примерно 9—12 D так как заряд электрона равен 4,8 · 10-10 электростатических единиц, а длина ионной связи составляет 2—3 A. Опытные данные соответствуют этой величине (для КСl — 8 D для КВr — 9,07 D для CsJ — 10,2 D). Одним из наиболее характерных и важных свойств кова-лентной связи, в отличие от ионной связи, является ее неизменная пространственная направленность. Так, в ковалентно построенных симметричных молекулах СН4, ССl4, С(СН3)4 угол между направлениями связей равен 109°28'. Ковалентные связи кислорода, серы, азота, фосфора, мышьяка и некоторых других элементов также имеют определенное направление в пространстве. Гетерополярные соединения склонны образовывать ионные кристаллические решетки, строение которых определяется размерами ионов, величиной сил отталкивания и другими факторами. Характерной особенностью таких решеток является то, что связи иона с каждым из ближайших соседей одинаково прочны. Гомеополярные соединения дают в твердом состоянии молекулярные кристаллические решетки, построенные из отдельных молекул, удерживаемых в кристалле небольшими ван-дер-ваальсовыми силами. Наличие в узлах решетки молекул как дискретных единиц объясняется присущим ковалентным связям свойством насыщаемости, т. е. тем, что ковалентно связанные атомы одной молекулы уже не могут дополнительно связываться с атомами другой молекулы.
Отличия в строении ионных и молекулярных решеток внешне проявляются в различных физических свойствах твердых ионных и твердых ковалентных соединений. Так, энергии сублимации ионных соединений (переход из твердого состояния в газообразное) обычно велики, например 50—60 ккал/моль для солей типа NaCl. Энергия сублимации кристаллических ковалентных соединений меньше (примерно 10 ккал/моль). Ионные соединения имеют высокие точки плавления, в то время как несложные ковалентные соединения (Н2, Cl2, CH4, SiH4, CF4, SiF4) при обычных условиях — газообразные вещества. Отличия ионных соединений от ковалентных в известной мере проявляются также при растворении их в воде. Водные растворы ионных соединений способны проводить электрический ток вследствие наличия в таких растворах свободных (точнее — гидратирован-ных) ионов. Ковалентные соединения зачастую вовсе нерастворимы в воде. Если же они растворяются в воде, то их растворы не содержат ионов, а потому не проводят электрического тока. Следует, впрочем, применять этот критерий с осторожностью. Так, например, молекула хлористого водорода, построенная ко-валентно, распадается в воде на ионы вследствие громадного сродства воды к протону (180 ккал/моль); здесь происходит уже не простое растворение, а химическая реакция: НСl + Н2О ------> Н3О+ + Сl- Критерием ковалентности или ионности связи может также служить ее энергия. Если принять, что энергия ковалентной связи А—В равна полусумме энергии связей А—А и В—В (формула Л. Полинга)
то для ковалентно построенных соединений удается получить хорошее совпадение вычисленной энергии связи с экспериментальной. Так, например, для молекул BrCl, JCl, JBr, NaK вычисленные энергии связи (в ккал) составляют 51, 46, 40 и 14,5, а определенные экспериментальным путем—соответственно 52, 49, 42 и 14,5. Резкое же расхождение величины вычисленной таким образом энергии с найденной опытным путем указывает на то, что мы имеем дело не с ковалентной, а с ионной связью. Так, для молекулы NaCl вычисленная энергия составляет 37 ккал, а найденная экспериментально 98 ккал.
Как и во всякой классификации вообще, при делении химических связей на ионные и ковалентные оказывается, что имеется ряд случаев промежуточных форм связи между ионной и ковалентной. Поэтому целесообразно подразделить ковалентные связи на полярные (с дипольным моментом μ = 1—2 D) и гомео-полярные (μ ≈ 0). Однако качественные отличия электронного строения типично ионных и типично ковалентных связей, а также некоторые типичные отличия в свойствах ионно и ковалентно построенных соединений являются подтверждением правильности и законности такой классификации. Координационная связь Наиболее часто ковалентная связь образуется за счет обобщения электронов, ранее принадлежавших двум отдельным атомам, например:
Однако возможен и иной механизм образования ковалент-ной связи. Так, при присоединении протона к аммиаку образуется ион аммония, в котором вновь образовавшаяся связь N—Н ковалентна и ничем не отличается от трех остальных, имевшихся в исходной молекуле аммиака. Эта четвертая связь N—Н могла образоваться только за счет неподеленной, или свободной, электронной пары азота аммиака:
Вновь образовавшаяся ковалентная связь N—Н ничем не отличается от трех остальных связей, кроме своего происхождения. Сходным путем, при взаимодействии смеси фтористого этила и трехфтористого бора с простым эфиром за счет свободной электронной пары кислорода образуется ковалентная связь О—С2Н5 в ионе триэтилоксония:
При реакции трехфтористого бора с анионом фтора четвертая ковалентная связь В—F в анионе BF4- образуется за счет неподеленной электронной пары иона фтора:
И здесь вновь образовавшаяся ковалентная связь В—F ничем не отличается от трех других, как и в случае симметрично построенного катиона аммония. Ковалентную связь, образующуюся за счет электронной пары только одной из реагирующих частиц, по предложению Льюиса и Сиджвика называют координационной (иначе — донорно-акцепторной) связью. Атом или ион, отдающий свою электронную пару для образования такой связи, называется донором (атом азота — в первой реакции, атом кислорода — во второй и анион фгора — в третьей). Атом или ион с незаполненной внешней электронной оболочкой, обобщающий чужую электронную пару, называется акцептором (протон — в первой реакции, этил-катион — во второй, атом бора — в третьей). Координационная связь может образовываться также при соединении двух молекул, например:
В этой реакции BF3, как и протон в реакции (1) и этил-катион в реакции (2), образует новую связь за счет электронной пары реагирующего с ним вещества. Такие реагенты (BF3, Н+) называются электрофильными или электроноакцепторными (реже— катионоидными). Аммиак в реакциях (1) и (4), диэтило-вый эфир в реакции (2) и анион фтора в реакции (3) образуют новую связь за счет своей неподеленной электронной пары. Такие реагенты называются нуклеофильными или электронодонорными (реже—анионоидными). Так как связь В—N в реакции (4) образуется путем обобщения электронной пары, ранее принадлежавшей азоту, простой арифметический подсчет показывает, что на атоме азота должен появиться положительный, а на атоме бора — отрицательный заряд (так называемые формальные заряды). Поэтому соединение BF3 с NH3 можно также изобразить следующим образом:
При таком написании соединения BF3 с NH3 становится понятным, что координационная связь В—N может быть названа также семиполярной (полуполярной), так как она представляет собой как бы сочетание ковалентной и электровалентной связей. Координационная связь, образующаяся при соединении двух указанных молекул, несколько отличается от ковалентных связей в симметричных ионах NH4 и BF4- вследствие отсутствия полной симметричности образовавшейся молекулы. Это отличие выражается, например, в повышенном дипольном моменте (2,4—3,5D). Поэтому для изображения такой связи часто применяют другие графические приемы, чем приизображении остальных типов ковалентных связей. Так, соединение BF3 с NH3 может быть изображено следующими способами:
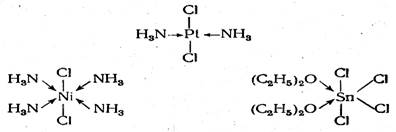
Последний способ изображения отражает донорно-акцепторный механизм образования координационной связи (предоставление атомом азота электронной пары для образования связи). Огромное число примеров координационной связи дает химия комплексных соединений. Таковы, например, комплексы:
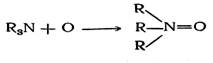
Примерами весьма распространенных в органической химии семиполярных связей могут служить связи азота с кислородом в окисях аминов инитросоединениях. Для того чтобы выяснить их строение, рассмотрим две химические реакции, применяя вначале обычные, неэлектронные структурные формулы. Одна реакция — окисление третичного амина перекисью водорода вокись амина
вторая — окисление нитрозосоединения в нитросоединение:
Если теперь изобразить электронное строение полученных соединений, заменив валентные черточки электронными парами
то легко видеть, что в каждом из этих соединений атом азота окружен не восемью, а десятью электронами, и, следовательно, изображенные нами электронные и соответствующие им классические структурные формулы с точки зрения октетной теории неверны. Для того чтобы выполнялось правило октета, необходимо иное распределение электронов, например:
Арифметический подсчет электронов в этом случае показывает, что в окиси амина азот заряжен положительно, а кислород— отрицательно; в нитросоединении азот заряжен положительно, а один из атомов кислорода — отрицательно. Обычно сокращенная запись таких формул производится следующим образом:
В приведенных формулах нитросоединения связи азота с кислородом неравноценны. В действительности же, как показывают результаты физических исследований, эти связи энергетически совершенно одинаковы и, следовательно, электронная пара, обусловливающая отрицательный заряд, не сосредоточена целиком на каком-либо одном кислородном атоме, а несколько смещена к азоту при одновременном смещении от азота ко второму кислородному атому одной из электронных пар (π-элек-тронной пары) двойной связи.
Эти смещения электронных пар ограничены требованиями, согласно которым вокруг каждого из трех рассматриваемых атомов должно быть внешнее электронное облако с зарядом, равным заряду восьми электронов, и, кроме того, обе связи N—О должны быть равноценны по электронной плотности. Эти требования обычно отражаются следующим образом:
Изогнутыми стрелками, показывающими направления смещения электронов, исправляется несимметричная формула нитрогруппы, которую мывывели, опираясь только на правило октета. Примером соединений с семиполярными связями могут также служить эфиры сульфоновых (сульфиновых) кислот
и сульфоокиси:
Эфиры сульфоновых кислот и несимметричные сульфоокиси могут быть расщеплены на оптические антиподы. Этот факт вполне согласуется с предположением о наличии у этих соединений семиполярных связей, так как только в таком случае атом серы имеет свободную электронную пару, облако которой направлено в пространстве совершенно определенным образом, играя роль четвертого, отличного от трех других заместителя; это и приводит, аналогично соединениям с асимметрическим атомом углерода, к появлению оптической изомерии у эфиров сульфоновых кислот и несимметричных сульфоокисей. Вопрос о том, имеются ли семиполярные связи у высших окислов и кислородных кислот серы, фосфора и галоидов, например
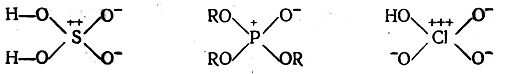
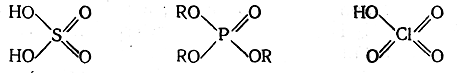
или же такие соединения содержат двойные связи
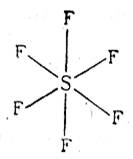
в настоящее время еще окончательно не решен. Против наличия в таких молекулах семиполярных связей свидетельствует то, что длина связей приближается к длине обычных двойных связей, в то время как длина семиполярных связей близка к длине простых связей; дипольные моменты рассматриваемых соединений значительно меньше дипольных моментов, рассчитанных при допущении семиполярных связей; связи серы, фосфора и хлора с кислородом в рассматриваемых соединениях прочнее, чем типичные семиполярные связи. Существование семиполярных связей вытекает из необходимости соблюдения правила октета. Однако, по-видимому, для элементов третьего и высших периодов периодической системы Д. И. Менделеева правило октета может и не выполняться. Так, например, сера в соединении SF6 является шестиковалентной:
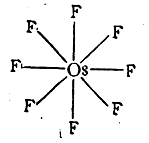
Об этом свидетельствует большая прочность SF6 по отношению кхимическим реагентам (не гидролизуется крепкой щелочью при нагревании). Шестиковалентен кремний в кремнефторидах типа Na2SiF6, восьмиковалентен осмий ввосьмифтористом осмии:
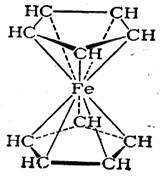
В молекуле дициклопентадиенилжелеза (ферроцена) все шесть π-электронов каждого циклопентадиенильного кольца (в виде аниона С5Н5-) образуют с электронами на внутренних орбитах иона металла Fe++ приблизительно октаэдрически направленные координационные ковалентные связи;
Вокруг атома железа создается устойчивая 36-электронная оболочка благородного газа (криптона), обусловливающая большую прочность соединения. Такие же связи существуют в молекулах всех циклопентадиенильных и бензольных производных других переходных металлов. Атомы металлов в молекулах этих веществ находятся в таком же состоянии, как атом железа в гексацианоферрат-ионе. Указанные представления о природе связей в соединениях типа ферроцена (ценах) развиты в работах Э. О. Фишера. Водородная связь Помимо различных гетерополярных и го-меополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водородная связь. Оказалось, что атом водорода может образовывать связь между двумя электроотрицательными атомами (F, О, N, реже Сl и S). Известны случаи, когда эту связь образует водородный атом, связанный с атомом углерода в соединениях типа НСХ3, где X — электроотрицательный атом или группа (например, в HCN, фторуглеводородах). Хотя в настоящее время природа водородной связи еще до конца не выяснена, одна.ко определен-ное представление о ней уже можно составить. Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:
(водородная связь обозначается пунктиром из трех точек). Таким образом, водородная связь по своему характеру является, по-видимому, электростатической; она образуется вследствие притяжения ковалентно связанного протона свободными электронами атома другой молекулы. При этом протон находится не посредине между связываемыми им атомами (даже если они одинаковы), а ближе к тому атому, с которым он связан ковалентно. Так, в случае воды
одно расстояние О—Н равно 0,99 А, а другое 1,76 А. Вопрос о том, находится ли водород в фиксированном положении или он совершает колебания между двумя положениями равновесия, в общем случае еще неясен, хотя исследование хингидрона методом меченых атомов свидетельствует о фиксированном положении водорода водородной связи в этом соединении. Энергия водородной связи мала; она имеет порядок 5—10 ккал/моль, в то время как, например, энергия нормальной связи О—Н равна 109 ккал/моль, а связи Н—F 148 ккал/моль. При плавлении льда рвется около 15% всех водородных связей, при нагревании воды до 40° С рвется около половины водородных связей. В парах воды водородных связей практически нет. При плавлении спиртов водородные связи почти не разрываются, однако они полностью рвутся при их испарении. В кар-боновых кислотах водородные связи не разрываются и при: испарении, благодаря чему, например, муравьиная кислота и в паровой фазе существует в виде димера
Однако и в этом случае энергия водородной связи составляет всего около 7 ккал/моль. Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде вызвана образованием водородных связей с молекулами воды. Некоторые соединения, подобно енольной форме ацетоуксус-ного эфира, о-нитрофенолу и др., образуют внутримолекулярные водородные связи с замыканием цикла. Изучение водородных связей должно пролить дополнительный свет на строение и свойства многих органических веществ. Вопросы для самоконтроля:
Рекомендуемая литература: 1. Перекалин В.В., Зонис С.А. Органическая химия. М.,1982 2. Терней А. Современная органическая химия. М.,1979 3. Петров Е.Е., Бальян Х.В., Трощенко А.Т. Органическая химия. М, 1974
Лекция №3-4.Теория электронных смещений. Изомерия. Цель: ознакомиться с индуктивным, мезомерным эффектом, структурной изомерией, геометрической, оптической изомерией. Основные вопросы: Индуктивный, мезомерный эффекты. Структурная изомерия, стереоизомерия 3. Геометрическая изомерия 4. Оптическая изомерия, конформационная изомерия.
Краткое содержание:
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.178 (0.044 с.) |