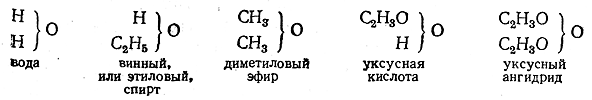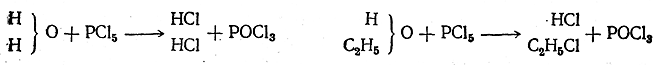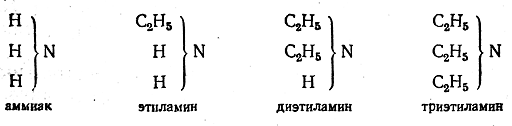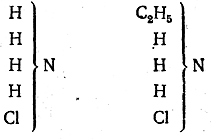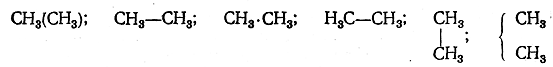Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правило замещения и теория типов
Правило замещения было сформулировано Дюма и Лораном (1807—1853) главным образом на основании опытного материала, полученного при изучении реакции металепсии. Эти положения Лоран излагал следующим образом: «Если хлор, бром, кислород или азотная кислота действуют на углеводород, то каждый выделяющийся атом водорода замещается одним эквивалентом хлора, брома, кислорода. При этом образуются кислоты: хлористоводородная, бромистоводородная, азотистая или вода, которые либо освобождаются, либо остаются соединенными со вновь образованным радикалом». Дюма считал, что правило замещения играет в органической химки такую же роль, как представления об изоморфизме в неорганической химии. Обсуждая далее тот факт, что вещество, полученное при действии хлора на уксусную кислоту, также представляет собой кислоту (хлоруксусную), а при действии хлора на уксусный альдегид образуется также альдегид (хлораль), Дюма приходит к выводу, что «...в органической химии существуют определенные типы, которые сохраняют свой характер даже после того, как водород в них замещается равным объемом хлора, брома или иода...». Таким образом, правило замещения фактически перерастало в теорию типов, основные положения которой первоначально были сформулированы Дюма в следующей форме: 1. Элементы сложного тела могут во многих случаях замещаться эквивалентными количествами других элементов или сложных тел, играющих роль простых. 2. Если замещение происходит в соотношении эквивалент на эквивалент, то соединение после такого замещения сохраняет свой химический тип, а элемент или группа, вновь вступившие в соединение, играют в нем такую же роль, какую играл замещенный элемент. Как мы видели выше, теория радикалов принимала во внимание главным образом ту часть молекулы органических веществ, которая при обычных химических превращениях остается неизменной. Меньше внимания уделялось легко изменяющейся части молекулы и причинам ее изменений. Сменившая теорию радикалов теория типов, наоборот, сосредоточивала внимание именно на наиболее изменчивых частях молекулы и на причинах, от которых зависит эта изменчивость. После многих исканий (законы замещений, механическая теория типов, теория ядер и др.) было найдено следующее объяснение изменчивости и характера изменений органических молекул. В реакциях органических веществ обнаруживается глубокое сходство с реакциями простейших неорганических соединений; органические вещества можно считать происшедшими от простейших неорганических веществ замещением в молекулах последних одного или нескольких атомов на группы атомов, названные «остатками» (чтобы не употреблять отвергнутого слова «радикал»). Соответствующие простейшие неорганические вещества являются для происшедших от них органических веществ типами, и молекулы органических веществ обладают характерными («типическими») реакциями тех неорганических молекул, к типу которых они относятся.
Эти воззрения стали казаться ясными и убедительными, когда за типы органических веществ были приняты соединения различных элементов с водородом. Одним из первых был установлен тип воды, к которому были отнесены различные органические вещества, содержащие кислород. От воды органические вещества могут происходить замещением одного или двух атомов водорода на «остатки», например:
Химические реакции спирта объяснялись по аналогии с ре-а.кциями воды. Так, водородный атом воды при действии металлического натрия замещается на атом натрия. Подобно этому в этиловом спирте «типический» для воды атом водорода (не замещенный на остаток этил) также может замещаться на атом натрия. Протекающие при этом реакции и получающиеся продукты в обоих случаях аналогичны:
Характерная для воды реакция с пятихлористым фосфором та.кже протекает для спирта совершенно аналогично—атом кислорода обменивается на два атома хлора:
В первом случае, кроме хлорокиси фосфора, получаются две молекулы хлористого водорода, во втором — одна молекула хлор-истого водорода и одна молекула хлористого этила. В метиловом эфире нет «типических» водородных атомов воды, и это вещество не реагирует с натрием. Большим успехом теории типов было открытие соединений типа аммиака — органических оснований, названных аминами. В аммиаке имеются три атома водорода, которые можно заменить на органические остатки:
Первым был получен этиламин; оказалось, что он обладает всемитипическими свойствами аммиака. Это газ, растворимый в воде, дающий щелочной раствор. С кислотами этиламин дает соли, аналогичные солям аммония:
Несколько позднее были «получены все три соединения аммиака и четвертое, представляющее собой хлористый аммоний, в котором все четыре атома водорода замещены на органические остатки. В конечном счете были установлены следующие главные типы:
Теория типов позволила создать довольно совершенную, близкую к современной классификацию органических веществ, названную Жераром «унитарной» системой. Эта система разделяла органические вещества на классы, объединяемые рядом общих химических свойств. По принадлежности вещества к определенному классу иногда оказывалось возможным верно предсказать способы получения этого вещества и некоторые его химические свойства. Кроме того, сравнивая физические свойства веществ одного и того же класса или разных классов, можно было установить и некоторые правильности в изменении физических свойств органических веществ в зависимости от изменения их состава. Теория химического строения Новая эпоха в органической химии наступила с возникновением теории химического строения. Главная роль в создании, обосновании и подтверждении теории строения принадлежит знаменитому русскому ученому Александру Михайловичу Бутлерову, хотя кроме него элементы этой теории начали разрабатывать А. Купер (1831—1892) в Англии и А. Кекуле (1829— 1896) в Германии. В 1858 г. Купер опубликовал на трех языках (английском, французском и немецком) статью «О новой химической теории», где он отбрасывает теорию типов и высказывает точку зрения, согласно которой все особенности органических веществ могут быть объяснены, если учитывать только два свойства атомов: «избирательное сродство» (связь атомов) и «степень сродства» (валентность атомов). Купер писал: «С моей точки зрения этих двух свойств достаточно для объяснения всего того, что характерно для органической химии: именно это я докажу ниже... В молекуле, состоящей из трех, четырех, пяти и т. д. атомов углерода и эквивалентного количества водорода, кислорода и др., последние могут быть заменены другими элементами, в то время как углерод образует взаимно-связанный узел. Это означает, что один углерод связан с другим углеродом. Такое свойство придает углероду, так сказать, своеобразную физиономию и дает возможность понять непонятный до этого факт наслоения атомов углерода в органических соединениях». Придя таким образом к важному представлению о цепи углеродных атомов, Купер выражает далее свои взгляды в формулах, которые, по его замыслу, должны дать картину строения соединений. В качестве примера его формул, которые были первыми конституционными формулами, можно привести следующие:
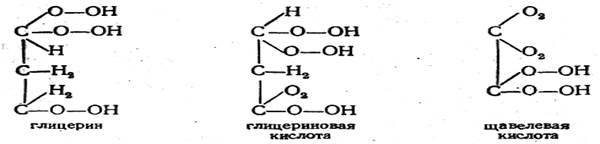
Из этих примеров видно, что Куперу удалось удивительно правильно передать конституцию этих соединений, а также некоторых более сложных и в то время мало исследованных (винная и виноградная кислоты). Однако все эти формулы были лишены опытного обоснования. Купер совершенно не ставил вопроса о возможности их экспериментальной проверки. Его формулы, как легко видеть, были основаны на формальной интерпретации понятий валентности и связи атомов, а отчасти даже на интуиции. Естественно, что при таком подходе невозможно избежать ошибок. Так, например, формулы глицерина, глицериновой кислоты и щавелевой кислоты, данные Купером, уже неверны:
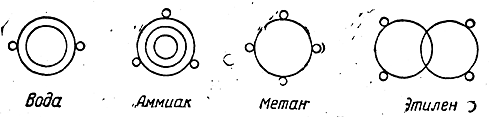
Таким образом, взгляды Купера, развитые им в его талантливой, интересной работе, не носят характера строгой теории. Другая попытка изображения органических соединений конституционными формулами была сделана в 1861 г. Лошмидтом. При построении своих формул Лошмидт рассматривал атомы как мельчайшие материальные частицы, подвергающиеся действию сил притяжения и отталкивания. Эти силы при сближении атомов уравновешиваются, и различные атомы удерживаются друг около друга в некотором равновесном положении. Сферы действия атомных сил Ло-шмидт условно обозначал кружками (например, атомы углерода и водорода — простыми кружками, кислорода—двойными, азота—тройными). Формулы Лошмидта имели следующий вид:
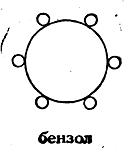
Не пытаясь составить какое-либо представление о способе связи шести углеродных атомов в молекуле бензола, Лошмидт обозначал бензол символом
В отличие от Купера, Лошмидт при выборе формул, кроме валентности («поллентности» по его выражению), иногда руководствовался и химическими свойствами. Однако в целом метод вывода формул Лошмидта был абстрактным, а зачастую просто необоснованным. Так, не опираясь на химические данные, Лошмидт пытался вывести формулы таких сложных веществ, как индиго, мочевая кислота и т. п. Естественно, что эти формулы оказались ошибочными. Несмотря на то, что многие из предложенных Лошмидтом формул органических соединений оказались удачными, работа его осталась почти не замеченной химиками того времени и не оказала сколько-нибудь существенного влияния на развитие теории органической химии. Большой вклад в создание структурной теории внес знаменитый немецкий химик Кекуле. Он установил четырехвалентность углерода, ввел тип метана, предложил известную формулу бензола и, что особенно важно, правильно сформулировал одну из основных задач органической химии того времени. Исходным пунктом для этого Кекуле считал «основность элемента» (валентность), а в отношении органических соединений прежде всего — природу углерода. Кекуле высказал также ряд других верных мыслей о связи атомов, выражая ее графическими формулами.
Как и другие сторонники теории типов, Кекуле изображал вещество несколькими типическими формулами. Так, например, чтобы передать известные тогда химические свойства уксусной кислоты, Кекуле предлагал изображать ее восемью формулами. Таким образом, хотя взгляды Кекуле и были близки к новым структурным воззрениям, хотя Кекуле и внес существенный вклад в развитие теории химического строения, он так и не смог полностью освободиться от представлений теории типов. Таким образом, А. М. Бутлеров первый установил, что каждая молекула имеет определенное химическое строение, что строение определяет свойства вещества и что, изучая химические превращения вещества, можно установить его строение. Что же касается способа написания структурных формул, то Бутлеров справедливо считал этот вопрос второстепенным: «Помня, что дело не в форме, а в сущности, в понятии, в идее,— и принимая во внимание, что формулами, обозначающими изомерию, логически-необходимо выражать настоящее частицы, т. е. некоторые химические отношения, в ней существующие,— не трудно притти к убеждению, что всякий способ писания может быть хорош, лишь бы только он с удобством выражал эти отношения. Весьма естественно даже употреблять разные способы, предпочитая тот, который является более выразительным для данного случая. Например, этан С2Н6 почти совершенно безразлично может быть изображен:
С возникновением теории химического строения органическая химия вышла из лабиринта типических формул; были показаны пути к познанию внутреннего строения молекул; появилась теоретическая основа для понимания химических процессов, для предсказания новых путей синтеза органических соединений. С самого момента своего возникновения теория химического строения дала возможность химикам проводить экспериментальные исследования направленно, целеустремленно. Замечательным успехом теории химического строения явилось объяснение явления изомерии, открытого в первой четверти прошлого столетия. Теория химического строения создавалась А. М. Бутлеровым в середине XIX века, в период, когда в России вырастали но-зые буржуазные общественно-экономические отношения и рост производительных сил привел к мощному развитию естествознания. В этот период И. М. Сеченов и затем И. П. Павлов создают материалистическое учение о высшей нервной деятельности человека и животных, К. А. Тимирязев и несколько позднее И. В. Мичурин закладывают начало нового этапа в развитии биологии, Д. И. Менделеев открывает важнейший закон природы — периодический закон, обобщивший все имевшиеся в то время знания о химических элементах. Н. И. Лобачевский открывает новую область математики. Теория химического строения создала возможность научной систематизации фактического материала органической химии, объяснила ее важнейшие закономерности и дала ключ к предсказанию новых фактов. Она явилась научной основой для создания современной органической химии. Типы химических связей Существует большое разнообразие химических связей, отличных по тем или иным признакам. Все связи могут быть подразделены на несколько типов по принципу их электронного строения. Ниже приводится принятая в настоящее время классификация химических связей.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.144.32 (0.017 с.) |