
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория электролитической диссоциацииСодержание книги
Поиск на нашем сайте
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные связи. Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Современное содержание этой теории можно свести к следующим положениям: 1. Молекулы электролитов – кислот, оснований, солей при растворении в воде распадаются на положительно и отрицательно заряженные ионы. Это явление называется электролитической диссоциацией. Легче всего диссоциируют вещества с ионной связью. При их растворении диполи воды ориентируются вокруг положительно и отрицательно заряженных ионов. Между ионами и диполями воды возникают силы взаимного притяжения.
Аналогично диссоциируют и электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды. В результате связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем образуются гидратированные ионы (рис. 5.3.).
Распад молекулы на ионы возможен только в растворителях, молекулы которых имеют полярное строение (вода, ацетон), такие растворители называются ионизирующими. 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, вторые – анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. 3. Диссоциация – обратимый процесс: одновременно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Гидратация ионов. Д. И. Менделеев экспериментально обосновал образование химических соединений при взаимодействии растворенного вещества с растворителем. Действительно, при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Эти ионы связаны с молекулами воды, т. е. гидратированы. Гидратированные ионы содержат как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ион водорода Н+, удерживающий одну молекулу воды, – это гидратированный протон Н+(Н2О), его изображают формулой Н3О+ и называют ионом гидроксония. Говоря об ионе водорода в растворе, всегда имеют в виду ион гидроксония, который для простоты обозначают Н+. Сильные и слабые электролиты. Лишь часть электролита диссоциирует на ионы, поэтому Аррениусом было введено понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу его молекул в растворе, α (выражается в % или долях единицы).
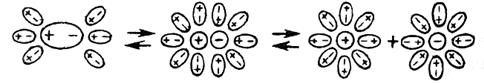
Например, выражение «степень диссоциации СН3СООН в 0,01 М растворе при данной температуре равна 0,042» означает, что 4,2 % уксусной кислоты в этом растворе продиссоциировало, а 95,8 % находятся в виде недиссоциированных молекул. Степень диссоциации зависит от природы электролита, природы растворителя, температуры и концентрации раствора. Электролиты можно разделить на две группы: сильные и слабые электролиты. Сильными обычно считают электролиты, у которых Сильные электролиты в водных растворах диссоциированы практически нацело; понятие степени диссоциации к ним по существу неприменимо. К ним относятся: 1. Почти все соли, за исключением тех, анионы и катионы которых образуют в растворе комплексные соединения. 2. Многие минеральные кислоты, например 3. Основания щелочных и щелочноземельных металлов, например, Как уже отмечалось, сильные электролиты находятся в растворах только в виде ионов, теоретически истинная степень их диссоциации равна 1 (100 %). Однако при экспериментальном определении для этих электролитов получают значение α < 1. Эту величину называют кажущейся степенью диссоциации. Несоответствие истинной и кажущейся степени диссоциации объясняется теорией сильных электролитов П. Дебая и Э. Хюккеля. Согласно этой теории между ионами, находящимися в растворе, возникают электростатические силы притяжения и отталкивания. В результате вокруг иона образуется ионная атмосфера (рис. 5.4), каждый ион оказывается окруженным некоторым числом ионов с зарядом противоположного знака.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы. К ним относятся: 1. Основания всех нещелочных и нещелочно-земельных металлов, например 2. Почти все органические кислоты, например 3. Вода К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия. и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты:
Константа равновесия имеет вид:
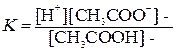
Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоцации. Величина К зависит от природы электролита и растворителя, а также от температуры и не зависит от концентрации раствора. Чем выше К, тем легче электролит диссоциирует. Закон разбавления Оствальда выводит математическую зависимость между К и
Для очень слабых электролитов
Из закона видно, что если концентрацию слабого электролита уменьшить в 100 раз, то Поскольку величина К от концентрации не зависит, из уравнений следует, что с разбавлением раствора, то есть с уменьшением концентрации степень диссоциации слабого электролита увеличивается. Теории кислот и оснований Кислотно-основные взаимодействия широко распространены в природе и технике, поэтому давно привлекали внимание ученых, предложивших несколько теорий этих процессов. Большинство теорий не противоречат друг другу, но имеют различные области применения. Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований. Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н+. Сильные кислоты диссоциируют практически полностью, у слабых диссоциирована лишь часть молекул. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем более диссоциирована кислота. Электролит, диссоциирующий с образованием ионов ОН-, называют основанием. Существуют электролиты, которые могут диссоциировать как кислоты, и как основания: H+ + RO- ↔ ROH ↔ R+ + OH- Такие электролиты называют амфотерными электролитами. Амфотерность электролитов объясняется малым различием связей R –H и O – H. Примером амфотерного электролита может быть гидроксид цинка: 2H+ + [Zn(OH)4]2- ↔ Zn(OH)2 + 2H2O ↔ [Zn(H2O)2]2+ + 2OH- При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка: Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O при взаимодействии же с гидроксидом калия – цинкат калия: Zn(OH)2 + 2KOH = K2[Zn(OH)4] К амфотерным электролитам также относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2 и др. Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фторидом водорода, образует соль фторид аммония NH3 + HF = NH4F. Аммиак, не имея в своем составе гидроксидной группы, ведет себя как основание. В 1923 г. Д. Брендстедом была предложена протонная теория кислот и оснований, применяемая как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протонов, а основание – акцептором протонов. При взаимодействии кислота отдает, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой Основание + Протон → Кислота Основание и кислота, связанные данным соотношением, называются сопряженными. Взаимодействие между кислотой и основанием согласно протонной теории обозначается схемой Кислота 1 + Основание 2 = Кислота 2 + Основание 1 Например, реакцию аммиака и фторида водорода можно записать уравнением HF + NH3 ↔ NH4+ + F- Кислота 1 Основание 2 Кислота 2 Основание 1 В этом уравнении кислоте HF соответствует сопряженное основание F-, а основанию NH3 – сопряженная кислота NH4+. В зависимости от партнера то или иное вещество может быть или кислотой, или основанием. Например, вода по отношению к аммиаку является кислотой, а по отношению к фториду водорода – основанием: H2O + NH3 ↔ OH- + NH4+ HF + H2O ↔ F- + Н3О+ кислота основание основание кислота Таким образом, как и во всех протолитических процессах, продуктом взаимодействия кислоты и основания является не соль, а сопряженные кислота и основание. В 1924 г. Дж. Льюис выдвинул и обосновал электронную теорию кислот и оснований, согласно которой кислота является акцептором, а основание – донором электронов. Если в состав кислоты входит водород, то она называется водородной. Однако кислота может и не содержать атома водорода, такая кислота называется апротонной. Взаимодействие кислоты и основания, по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму: основание кислота продукт нейтрализации Электронная теория охватывает более широкий круг соединений, чем протонная теория.
Ионные реакции в растворах
При нейтрализации любой сильной кислоты любым сильным основанием на каждый моль образующейся воды выделяется около 57,6 кДж теплоты: HCl + NaOH = NaCl + H2O + 57,53 кДж; HNO3 + KOH = KNO3 + H2O + 57,61 кДж. Это говорит о том, что подобные реакции сводятся к одному процессу. Уравнение этого процесса мы получим, если рассмотрим подробнее одну из приведенных реакций, например, первую. Перепишем ее уравнение, записывая сильные электролиты в ионной форме, поскольку они существуют в растворе в виде ионов, а слабые – в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул: H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O. Рассматривая получившееся уравнение, видим, что в ходе реакции ионы Na+ и Cl- не претерпели изменений. Поэтому перепишем уравнение еще раз, исключив эти ионы из обеих частей уравнения: H+ + OH- = H2O. Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к образованию молекул воды из ионов водорода и гидроксид-ионов. Ясно, что тепловые эффекты этих реакций тоже должны быть одинаковы. Строго говоря, реакция образования воды из ионов обратима, что можно выразить уравнением: H+ + OH- ↔ H2O. Протекание реакции между электролитами возможно в 3-х случаях: 1. Если ионы, соединяясь, образуют труднорастворимое соединение:
2. Если образуется летучее вещество:
3. Если образуется малодиссоциирующий электролит:
На основании ионного уравнения делают вывод о том, присутствие каких ионов необходимо для получения данного продукта реакции. Ионная форма уравнения реакции показывает и направление протекания этой реакции: реакция протекает в направлении связывания одного или более ионов в более прочное соединение, т. е. уменьшения концентрации его в растворе.
|
||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.32.115 (0.008 с.) |

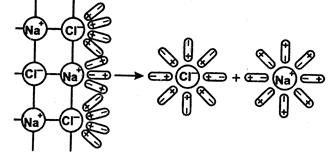 Рис. 5.2. Схема электролитической диссоциации хлорида натрия в водном растворе
Рис. 5.2. Схема электролитической диссоциации хлорида натрия в водном растворе
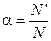
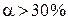 (в 0,1 Н растворах).
(в 0,1 Н растворах).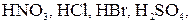
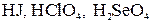 .
.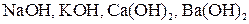 .
.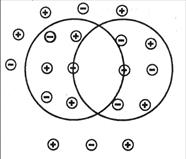 Рис. 5.4. Модель ионной атмосферы
Рис. 5.4. Модель ионной атмосферы
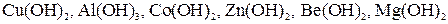 , а также NH4OH.
, а также NH4OH.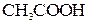 ; некоторые минеральные кислоты, например
; некоторые минеральные кислоты, например  ,
, 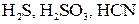 , HNO2, HClO, H2SiO3.
, HNO2, HClO, H2SiO3.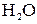 .
.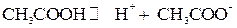
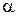 :
: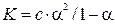
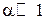
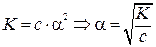
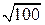 , то есть в 10 раз.
, то есть в 10 раз.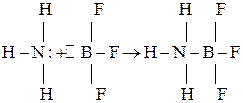
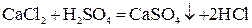 ;
;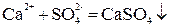 .
.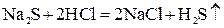 ;
;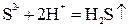 .
.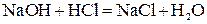 ;
;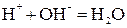 .
.


