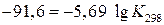Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости реакции от температуры
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа, согласно которому при повышении температуры на 10°С скорость реакции возрастает примерно в 2-4 раза. Число, показывающее во сколько раз увеличивается скорость химической реакции, а следовательно и константа скорости её при повышении температуры на 10°С, называется температурным коэффициентом скорости реакции
где
Пример. Срок хранения автомобильных покрышек при температуре 20˚С – 5 лет, а при температуре 10˚С – 13 лет. Сколько лет можно хранить покрышки при 5˚С? Решение. Средняя скорость старения резины обратно пропорциональна сроку хранения. Следовательно, при охлаждении с 20˚С до 10˚С скорость старения уменьшится в 13/5 = 2,6 раза. Это означает, что температурный коэффициент γ = 2,6. При охлаждении еще на 5˚С скорость реакции уменьшится в γ1/2 = 1,6 раза:
В такое же число раз возрастет срок хранения покрышек, который в этом случае составит уже 13 ∙ 1,6 = 21 год. Увеличение скорости реакции с повышением температуры объясняется тем, что для химической реакции необходимо соударение активных молекул. При повышении температуры число активных молекул возрастает, поэтому скорость химическойреакции резко возрастает. Избыточная энергия, которой должны обладать молекулы для того, что бы их столкновение могло привести к образованию нового вещества, называется энергией активации (в кДж/моль). Молекулы, обладающие такой энергией, называются активными молекулами. Если энергия активации мала (< 40 кДж/моль), то скорость химической реакции велика, если энергия активации велика (>120 кДж/моль) то скорость реакции очень мала. В 1889 году шведский ученый Аррениус вывел уравнение, которое носит его имя: Множитель
Реакции, требующие для своего протекания заметной энергии активации, начинаются с ослабления связи между атомами в молекулах исходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние с большим запасом энергии, это состояние называется активированным комплексом. Для его образования и необходима энергия активации (рис. 4.1.).
Катализ Наиболее мощным средством интенсификации химических реакций является применение катализаторов, т.е. веществ, которые ускоряют химические реакции, но в результате не испытывают химические превращения. Явление изменения скорости под воздействием катализаторов называется катализом. Кроме способности ускорять реакции, многие катализаторы обладают селективностью (избирательностью). Под влиянием катализаторов реакции могут протекать избирательно, т.е. с увеличением выхода определенных продуктов. Например, этанол в присутствии оксидов алюминия и тория разлагается на этилен и воду:
а в присутствии никеля, железа, серебра или меди – на ацетальдегид и водород:
Каталитическая активность, т.е. способность ускорения реакции, многих катализаторов возрастает при добавлении небольших количеств некоторых веществ, называемых промоторами, которые без катализатора могут быть каталитически неактивными. Например, скорость окисления
В то же время имеются вещества, которые ухудшают каталитическую активность. Их называют каталитическими ядами. Например, каталитическими ядами платиновых катализаторов являются соединения серы, мышьяка, ртуть. Особенности катализаторов: 1) Катализатор не меняет стехиометрическое уравнение реакции. 2) Катализатор в равной степени изменяет скорости прямой и обратной реакций, следовательно, с помощью катализатора невозможно сместить химическое равновесие. 3) Катализатор не изменяет энтальпию и энергию Гиббса. Если энергия Гиббса реакции положительна, то в присутствии катализаторов она не станет самопроизвольной. 4) Катализаторы уменьшают полную энергию активации процесса, так как каталитический процесс идет по другому пути, через другое переходное состояние, с образованием других промежуточных частиц. Активированный комплекс с участием катализаторов, имеет меньшую энергию, чем комплекс без катализаторов, поэтому энергия активации каталитической реакции ниже, чем энергия некаталитической реакции, т.е. Еа>Еа,к (рис. 4.2.).
Гомогенный катализ. При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. Механизм гомогенного катализа можно объяснить на основе теории промежуточных соединений. Согласно этой теории, катализатор образует с реагентами промежуточные соединения, причем разложение последнего является лимитирующей стадией. Это приводит к уменьшению энергии активации реакции. Например, реакция: АВ + D → A...B...D → A + BD в присутствии катализатора К может проходить по схеме: D + K ↔ D...K ↔ DK DK + AB ↔ A...B...D...K ↔ A + BD + K Как видим, в суммарное уравнение реакции катализатор К не входит, т.е. в результате реакции он не изменяется. Примером газофазной каталитической гомогенной реакции является реакция окисления оксида углерода в присутствии паров воды:
Более распространены гомогенные каталитические реакции в жидкой фазе. Например, реакция разложения пероксида водорода:
ускоряется иодид-ионами. Эту реакцию можно записать в виде схемы:
Гетерогенный катализ. Если катализаторы и реагенты находятся в разных фазах и имеют границу раздела, то катализ называется гетерогенным. Гетерогенными обычно являются твердые катализаторы, на поверхности которых реагируют газообразные или жидкие вещества. Суммарная скорость химического превращения на гетерогенном катализаторе зависит от площади его поверхности, поэтому обычно применяют катализаторы с развитой поверхностью. Механизм каталитических гетерогенных реакций очень сложен и зависит от природы реакции. Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции. За счет энергии адсорбционного взаимодействия с поверхностными атомами катализатора химические связи реагирующих веществ ослабляются, а иногда и разрываются. Например, реакция гидрогенизации этилена на катализаторе протекает через стадии:
адсорбции
и десорбции
Химическое равновесие Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного расхода одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях. Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится – данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой – необратимая реакция. Пример 2. Синтез аммиака протекает согласно уравнению:
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Таким образом, синтез аммиака – обратимая реакция. На рисунке 4.3. показано изменение скоростей прямой и обратной реакций с течением времени.
Когда скорости прямой и обратной реакции становится одинаковыми, наступает химическое равновесие. Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза йодоводорода:
Согласно закону действия масс скорости прямой (
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
или
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
Отсюда окончательно
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии – равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину. Можно показать, что в общем случае обратимой реакции
константа равновесия выразится уравнением:
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия. В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции:
константа имеет вид:
Величина константы равновесия зависит от природы реагирующих веществ и от температуры, но не зависит от присутствия катализаторов. Константа равновесия связана со стандартным изменением энергии Гиббса уравнением:
При подстановке значения R = 8,31 Дж/моль ∙ К
При Т = 298 К
Пример. Вычислить константу равновесия реакции
Найденное значение подставим в уравнение (1):
Большое значение К показывает, что при стандартных условиях равновесие данной реакции сильно смещено вправо, т.е. при 25˚С NH4Cl – устойчивое соединение.
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.97.64 (0.035 с.) |
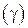 .
.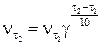 ,
,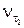 – скорость реакции при температуре
– скорость реакции при температуре 
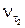 – скорость реакции при температуре
– скорость реакции при температуре 
 – температура коэффициент скорости равный
– температура коэффициент скорости равный 
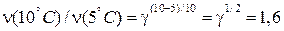
 – уравнение Аррениуса, где k – константа скорости реакции, ЕА – энергия активации, R – газовая постоянная, T – абсолютная температура, Z – число столкновений.
– уравнение Аррениуса, где k – константа скорости реакции, ЕА – энергия активации, R – газовая постоянная, T – абсолютная температура, Z – число столкновений.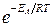 характеризует долю активных столкновений от их общего числа. Мы видим, что константа скорости тем больше, чем меньше энергия активации и чем выше температура.
характеризует долю активных столкновений от их общего числа. Мы видим, что константа скорости тем больше, чем меньше энергия активации и чем выше температура. Рис. 4.1. Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В.
Рис. 4.1. Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В.

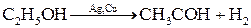
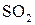 на катализаторе оксиде ванадия
на катализаторе оксиде ванадия 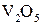 возрастает в сотни раз при добавлении в систему сульфатов щелочных металлов.
возрастает в сотни раз при добавлении в систему сульфатов щелочных металлов.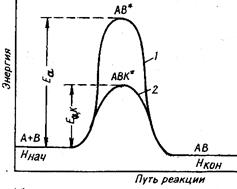 Рис. 4.2. Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
А + В = АВ
Рис. 4.2. Энергетическая диаграмма некаталитической (1) и каталитической (2) реакции
А + В = АВ
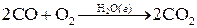
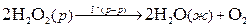
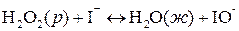

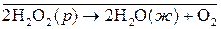


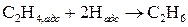
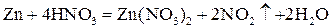
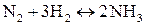
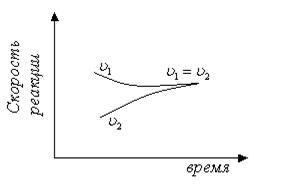 Рис. 4.3. Изменение скоростей прямой и обратной реакций с течением времени
Рис. 4.3. Изменение скоростей прямой и обратной реакций с течением времени

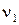 ) и обратной(
) и обратной( ) реакции выражаются уравнениями:
) реакции выражаются уравнениями: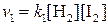 ;
; 
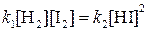
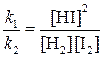
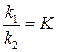

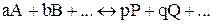

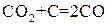
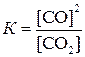
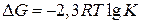

 (1)
(1)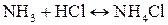
 -16,7 -95,4 -203,7
-16,7 -95,4 -203,7