
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Самопроизвольные процессы. Энергия ГиббсаСодержание книги
Поиск на нашем сайте
Процессы, протекающие без подвода энергии от внешнего источника, называются самопроизвольными. Например, образование ржавчины, реакция натрия с водой, растворение соли в воде и др. Выясним критерии самопроизвольных процессов. 1. Большинство экзотермических реакций ( 2. Кроме уменьшения Энтропийный и энтальпийный факторы, взятые по отдельности, не могут быть критериями самопроизвольного течения химических реакций. Для изобарно – изотермических процессов их объединяет функция, называемая энергией Гиббса: а в общем случае Эти уравнения позволяют вычислить Стандартные энергии Гиббса Как уже было упомянуто, движущая сила химической реакции определяется ее энергией Гиббса Энергия Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно – изотермических процессах. Химическая реакция принципиально возможна, если энергия Гиббса уменьшается, т.е.
Химическая реакция не может протекать самопроизвольно, если энергия Гиббса системы возрастает, т.е. Наконец, если Поскольку энергию Гиббса можно превратить в работу, то её также называют свободной энергией. Если T → 0, то Δ G →Δ H. Таким образом, при низких температурах величина и знак Δ G определяются величиной и знаком Δ H. При низких температурах самопроизвольно протекают, как правило, экзотермические реакции. Если T → ¥, то Δ G → T Δ S. При высоких температурах величина и знак Δ G определяются величиной и знаком Δ S. При высоких температурах самопроизвольно протекают, как правило, реакции, ведущие к увеличению энтропии. Таким образом, процессы в закрытой системе идут самопроизвольно в сторону понижения энергии Гиббса (Δ G = 0), что дает возможность установить границу, позволяющую судить о начале развития реакции в нужном направлении. Для этого в уравнении: Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К, называется энергией Гиббса образования вещества. Если исходные вещества и продукты реакции находятся в стандартных состояниях, то энергия Гиббса называется стандартной энергией Гиббса химической реакции Δ G0 и является критерием самопроизвольного протекания реакции. Используя закон Гесса, энергию Гиббса можно рассчитать как сумму энергий Гиббса образования продуктов реакции за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов: Δ G = ∑ nk Δ G обр - ∑ n н Δ G обр.
Решение типовых задач Пример 1. При сгорании 16 г магния выделилось 400,8 кДж. Определите энтальпию образования MgO(к.).
Решение. Запишем термохимическое уравнение реакции: Mg(к.) + 1/2 O2(г.) = MgO(к.), DНреак.= х кДж. Из условия задачи следует, что при сгорании некоторого числа молей магния выделилось 400,8 кДж, поэтому, сначала находим количество вещества прореагировавшего магния: ν = m/М = 16/24 = 0,66(6) моль. Если при сгорании 0,66(6) моль магния выделяется 400,8 кДж, то при сгорании 1 моль магния выделяется х кДж (это и есть теплота образования MgO(к.)): х = 1·(–400,8)/0,66(6) = – 601,2 кДж Ответ: DН f (MgO) = – 601,2 кДж/моль. Пример 2. Найти тепловой эффект реакции B2O3(к.) + 3 Mg(к.) = 2 B(к.) + 3 MgO(к.), DНреак = х кДж, если энтальпии образования B2O3(к.) и MgO(к.) равны соответственно –1272,8 и –601,2 кДж/моль. Решение: Воспользуемся следствием из закона Гесса, которое гласит: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ: DНх = 3·DН f (MgO) – DН f (B2O3) = –1803,6 – (– 1272,8) = –530,8 кДж/моль. Напомним, что стандартные теплоты образования простых веществ равны нулю. Ответ: – 530,8 кДж/моль Пример 3. Определить стандартную энтальпию сгорания метана, если стандартные энтальпии образования CH4(г.), CO2(г.) и H2O(ж.) равны соответственно –74,8; –393,5 и –285,8 кДж/моль. Решение: Запишем термохимическое уравнение реакции: CH4(г.) + 2 02(г.) = CO2(г.) + 2 H2O(ж.); DHºреакц. =? Используя первое следствие из закона Гесса, находим, что DHºреакц. = 2 DH f (H2O) + DH f (CO2) – DH f (СН4); DHºреакц = [2 (–285,8) + (–393,5)] – (–74,8) = –890,3 кДж/моль Ответ: – 890,3 кДж/моль Пример 4. Определите, как изменится энтропия при протекании химического процесса Na2O(т) + H2O(ж) = 2NaOH(т). Решение: В данном процессе при взаимодействии 1 моль кристаллического и 1 моль жидкого вещества образуется 2 моль кристаллического вещества. Следовательно, система переходит в состояние с меньшим беспорядком, и энтропия уменьшается (Δ S <0). Пример 5. Пользуясь данными справочника, определите, может ли при стандартной температуре самопроизвольно протекать реакция Fe2O3(к.) + H2(г.) = 2 FeO(к.) + H2O(г.)? Решение: По справочнику находим, что DGобрFe2O3(к.) = –740,3 кДж/моль; DGобрFeO(к.) = –244,3кДж/моль; DGобрH2O(г.) = –228,6 кДж/моль. Тогда, DGреакц = 2×DGобр (FeO(к.)) + DGобр.(H2O(г.)) – DGобр(Fe2O3(к.)) = [2 (–244,3) + (–228,6)] – (–740,35) = –23,17 кДж Так как DGреакц < 0, процесс может протекать самопроизвольно при стандартной температуре 298,15 К. Пример 6. Пользуясь значениями а) COCl2=CO+Cl2 б) SO2+NO2=SO3 (г)+NO и определить, возможно ли их осуществление в стандартных условиях. Решение: а)
б)
Итак, Пример 7. Установите, возможно ли при температурах 298 и1000 К восстановление оксида Fe(III) до свободного металла по уравнению Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г) При стандартных состояниях. Решение. В справочных таблицах найдем значения
Рассчитаем стандартные энтальпию и энтропию реакции:
Энергия Гиббса химической реакции равна
Для данного процесса при 298 К Рассчитаем энергию Гиббса реакции при 1000 К:
Для данного процесса при 1000 К 3.8. Задачи для самостоятельного решения 1. Пользуясь табличными данными, вычислите тепловые эффекты следующих реакций: а) CH4(г.) + 2 O2(г.) = CO2(г.)+ 2H2O(г.); б) Fe2O3(к.) + 2 Al(к.) = Al2O3(к.) + 2 Fe(к.); в) MgCO3 (к.) = MgO(к.) + CO2 (г.). г) 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г) Какие из этих реакций будут экзотермическими, какие – эндотермическими? 2. Приведены термодинамические уравнения химических реакций получения НBr(г): H2(г) + Br2(ж) = 2HBr(г), ∆Н0 = -72 кДж; ½H2(г) + ½Br2(г) = HBr(г), ∆Н0 = -21 кДж; H(г) + Br(ж) = HBr(г), ∆Н0 = -366 кДж; ½H2(г) + ½Br2(ж) = HBr(г), ∆Н0 = -36 кДж. Какое из приведенных значений ∆Н0 можно принять непосредственно в качестве стандартной энтальпии образования HBr(г)? Объсните, почему другие из указанных значений не равны искомой величине. 3. Вычислите энтальпию реакции 1/4Р4(г) + 5/2Сl2(г) = PCl5(к), если известны энтальпии следующих реакций: P(к) + 3/2 Сl2(г) = PCl3(к), ∆Н0 = -287 кДж; PCl3(к) + Сl2(г) = PCl5(к), ∆Н0 = -56 кДж; 4P(к) = P4(г), ∆Н0 = +128,9 кДж. 4. Вычислить изменение стандартной энтропии для реакций а) H2(г.) + Br2(г.) = 2 HBr(г.); б) H2(г.) + Br2(ж.) = 2 HBr(г.); в) CO(г.) + 1/2O2(г.) = CO2(г.); г) C(графит) + O2(г.) = CO2(г.). Как можно объяснить значительное различие в изменении энтропии для реакций а) и б), а также в) и г)? 5. Укажите знаки DН°, DSº и ΔG° для следующих процессов: а) расширение идеального газа в вакуум; б) испарение воды при 100ºС и парциальном давлении паров воды 101,3 кПа (760 мм рт.ст.); в) кристаллизация переохлажденной воды. 6. Не проводя расчета, определите качественно, в каких химических реакциях ΔS реакции будет < 0; = 0; > 0. а) 2H2(г.) + O2(г.) = 2H2O(г.); б) 2H2(г.) + O2(г.) = 2H2O(ж.); г) N2 (г.) + 3H2(г.) = 2NH3(г.); д) CaO(к.) + CO2(г.) = CaCO3(к.); е) 4Fe(к.) + 3O2(г.) = 2Fe2O3(к.); ж) N2O4(г.) = 2NO2(г.); з) N2(г.) + O2(г.) = 2NO(г.). 7. Для галогенидов алюминия в газообразном состоянии характерно образование димеров. Будет ли самопроизвольно протекать реакция 2AlBr3(г) = Al2Br6(г)? Ответ подтвердите расчетом 8. Можно ли считать NH4NO3 устойчивым соединением? Распад соли возможен по уравнению NH4NO3(к) = N2(г) + 1/2O2(г) + 2H2O(г). Ответ подтвердите расчетом 9. Возможно ли использовать металлический магний для получения металлического титана, восстанавливая хлорид титана магнием TiCl4(ж) + 2 Mg(к) = Ti(к) + 2MgCl2(к)? Ответ подтвердите расчетом
10. Вычислите значения ΔG°298 следующих реакций восстановления оксида железа (II): а) FeO(к.) + ½ C(графит) = Fe(к.) + ½ CO2 (г.); б) FeO(к.) + C(графит) = Fe(к.) + CO(г.); в) FeO(к.) + CO(г.) = Fe(к.) + CO2 (г.). Протекание какой из этих реакций наиболее вероятно? 11. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CaO, FeO, CuO, PbO, Fe2O3, Cr2O3?
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 396; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.50.169 (0.012 с.) |

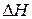 <0) протекают самопроизвольно. Однако существуют и эндотермические процессы, которые протекают самопроизвольно (растворение солей KCl и NH4NO3 в воде), следовательно,
<0) протекают самопроизвольно. Однако существуют и эндотермические процессы, которые протекают самопроизвольно (растворение солей KCl и NH4NO3 в воде), следовательно, 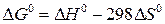 , (1)
, (1) 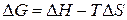 , (2)
, (2) 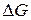 любой химической реакции, если известны
любой химической реакции, если известны 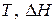 и
и 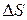 .
.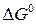 , энтальпии образования
, энтальпии образования 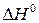 и энтропии
и энтропии 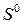 приводятся в справочных таблицах, в которых
приводятся в справочных таблицах, в которых 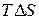 - энтропийный фактор. Первый из них отражает тенденцию системы к образованию связей в результате взаимного притяжения частиц – молекул или атомов, что приводит к их усложнению, а второй – тенденцию к усилению процессов диссоциации сложных частиц на более простые и их менее упорядоченному состоянию. Оба фактора обычно действуют в противоположных направлениях, и общее направление реакции определяется влиянием преобладающего фактора.
- энтропийный фактор. Первый из них отражает тенденцию системы к образованию связей в результате взаимного притяжения частиц – молекул или атомов, что приводит к их усложнению, а второй – тенденцию к усилению процессов диссоциации сложных частиц на более простые и их менее упорядоченному состоянию. Оба фактора обычно действуют в противоположных направлениях, и общее направление реакции определяется влиянием преобладающего фактора.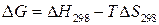 полагаем,
полагаем, 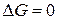 следовательно,
следовательно, 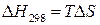 и
и 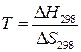 – температура при которой
– температура при которой 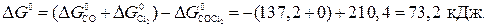

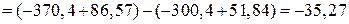 кДж.
кДж.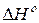 298,
298, 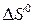 298 для исходных веществ и продуктов реакции.
298 для исходных веществ и продуктов реакции.


